动脉套管联合聚乙二醇在大鼠周围神经损伤中的应用
聂广辰,薛 岩,郝旭光,刘 丽,石 健,房玉利,刘 勇
哈尔滨市五院骨外科,哈尔滨 150088
周围神经损伤临床发病率极高,中国每年新增周围神经损伤患者60万~90万例,且大部分患者需要神经移植进行修复[1-2]。在周围神经损伤的患者中只有不到一半恢复良好的感觉和运动功能[3]。周围神经损伤现阶段恢复连续性的方法为外膜缝合、束膜缝合、外膜联合束膜缝合,这些方法在不能明确鉴别神经的运动、感觉束的情况下,均难以避免神经功能束的错误匹对,且断端神经因为延迟修复导致连续性恢复的过程受阻,错过了修复时机,导致神经纤维瘤的形成[4]。近年来对周围神经损伤修复的研究中,动脉套管及聚乙二醇(PEG)表现出了明显的优势,其中动脉套管的作用机制在于周围神经损伤后,神经近端的再生过程表现出趋化性,如果有一定空间的间隙,新生的运动、感觉神经纤维可以经它自动长入远端相应的功能束中,最后到达靶器官[5-7]。PEG作为一种非离子化亲水性聚合物,在生物化学和药物学上应用广泛,常用作细胞融合相关领域所需的乳化剂以及均质物质[8]。PEG 能够在生物体内环境形成对周围水分结构的结构化作用[9],形成相对的疏水结构域,这种特殊的结构域能减少细胞膜产生的线性弹性,促使破裂细胞膜发生融合,同时促进邻近磷脂层的再塑,为细胞结构和功能的再塑提供良好条件。在哺乳动物中轴突的离断常导致不可逆性的远端轴突的华勒变性,但近端节段功能尚保存,PEG可通过轴突融合在细胞水平连接损伤神经的远端和近端,避免损伤远端神经的华勒变性,促进周围神经再生[10]。动脉套管及PEG在周围神经损伤的修复中,单独的报道很多,但两者联合应用的文献鲜有报道。本研究通过构建大鼠坐骨神经损伤动物模型,联合两种方法进行修复,旨在为临床上周围神经损伤患者提供一种新的治疗思路。
材料与方法
1 实验分组及动物模型的制备
本研究实验动物购自哈尔滨医科大学附属二院动物实验中心,雄性Sprague-Dawley(SD)大鼠体重(200~250g)。本研究动物实验操作均严格按照哈尔滨医科大学医学伦理委员会制订的《哈尔滨医科大学动物实验操作规范》执行。
实验分组,共144只大鼠,平均分为4组,每组36只。A组:小间隙缝合生理盐水冲洗;B组:小间隙缝合PEG冲洗;C组:动脉套管(同种异体血管)联合小间隙缝合生理盐水冲洗;D组:动脉套管联合小间隙缝合PEG冲洗。对实验大鼠腹腔内注射麻醉药戊巴比妥钠(60mg/kg),备皮后对右后肢进行手术。将大鼠翻至俯卧位并固定四肢,找到大鼠右侧大腿股骨位置,以此为骨性标志在股骨下 0.5cm 处浅层剪开皮肤,作一1~2cm切口,切口位置为股骨在体表的投影位置。打开皮肤后可见一条明显的白线,为肌肉间的筋膜,在显微镜下,沿此白线将其剪开一个小口,深入血管钳沿白线方向钝性分离,用显微剪刀锐性分离坐骨神经周围的结缔组织,暴露坐骨神经干。将A组和B组大鼠坐骨神经游离暴露1cm左右,并在手术显微镜下于中间切断并立即小间隙缝合(1mm),将生理盐水(0.5mL,A组)或 PEG-600(西安晋湘药用辅料有限公司,0.5mL,B组)注入缝合界面。将C组和D组大鼠暴露1cm的坐骨神经然后于中间切断。将近端和远端残端插入主动脉套管的两端,然后将套管的两个末端固定到神经外膜上,最后将盐水(0.5mL,C组)或PEG-600(0.5mL,D组)注入动脉导管(图1)。所有组进行止血并以标准方式闭合伤口。
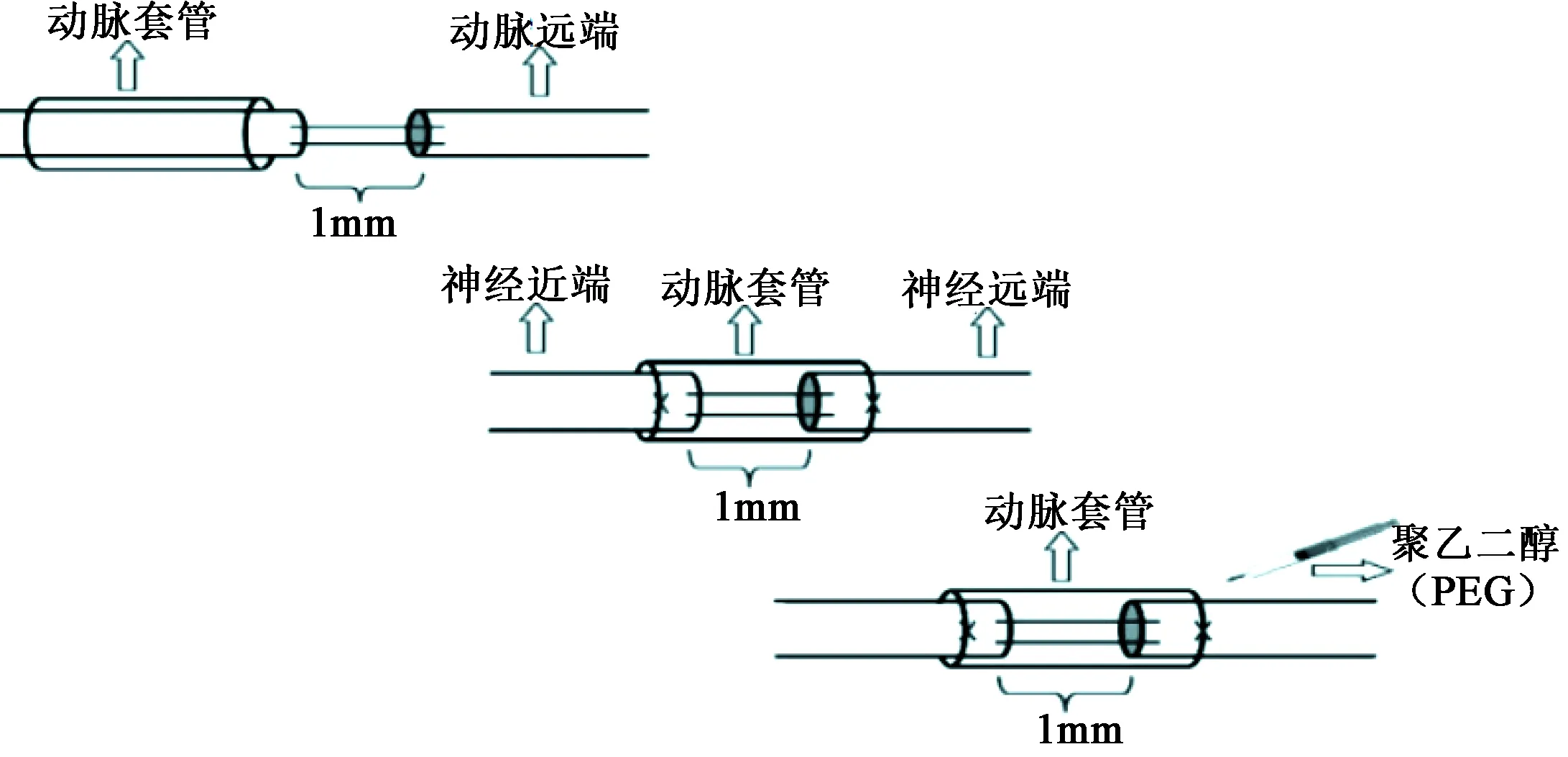
图1 小间隙缝合及动脉套管使用示意图
将所有大鼠放置在舒适的环境中,12h/12h交替光暗循环并自由喂食。
本研究设计涉及4组SD大鼠(n=144),每组在1、4周和8周各评估12只大鼠(n=36)。1周,每组9只大鼠进行行为学评估及电生理检测,3只取材坐骨神经组织,进行组织学评估以及电镜观察。
2 行为学坐骨神经功能指数(SFI)检测
该项评估在自制坐骨神经指数盒内进行,制作一高10cm、长60cm、宽10cm、两端开口的木质通道,将白纸裁成与木质通道等长等宽铺至木板表面。训练大鼠自行通过木板行走。用染料使大鼠双下肢染色,大鼠置于通道的一开口端,任其行走至另一开口端,双下肢在白纸上可留下5~6个脚印。评估利用了包括感觉反馈和运动控制在内的SFI。选择印迹清晰的足印分别测量正常足(N)和伤侧足(E)的3个指标:PL(脚印长度)、TS(趾宽度)、IT(中间趾宽度)。把获得的指标代入Bain[9-10]公式,最后获得SFI。从第3周开始,SFI值有较强指导意义[11]。SFI的评价标准为:SFI=0为运动感觉功能正常,SFI=100为神经完全损伤。
3 电生理学检测
复合肌肉动作电位(CMAP)是指电刺激坐骨神经,记录远端坐骨神经所支配的腓肠肌同步放电的电生理信号,评估受损的坐骨神经恢复情况。受检大鼠腹腔注射麻醉后,暴露并游离包括动脉套管在内的约2cm坐骨神经,将钩形刺激电极放置在离近端神经约1cm处。将针记录电极放置在相应的目标腓肠肌上测量CAMP并观察记录其振幅。
4 组织病理学检测
取缝合部位的神经节段和目标腓肠肌,并对其进行处理,以对治疗后的神经进行组织学分析。HE染色观察各组腓肠肌萎缩情况及神经再生排序情况。透射电子显微镜观察再生神经纤维数量、轴突及髓鞘外观。
5 统计学分析

结 果
1 实验动物情况
在本实验中A组及C组大鼠各有1只因麻醉意外死亡,其余大鼠在饲养过程中无意外死亡发生。
2 行为学结果
结果显示D组在任何时间节点数据明显优与其他三组,且差异有统计学意义。见表1。
表1 坐骨神经指数计算数值分)
3 电生理学结果
术后1、4、8周行混合肌肉运动电位CMAP检查。术后第1周D组动作电位峰值显著高于其余三组,术后4周及8周,B组动作电位峰值有所提高,但显著低于D组,A组及C组动作电位恢复不良。结果提示接受PEG的冲洗对周围神经正常的生物电传导功能恢复有帮助。见图2。
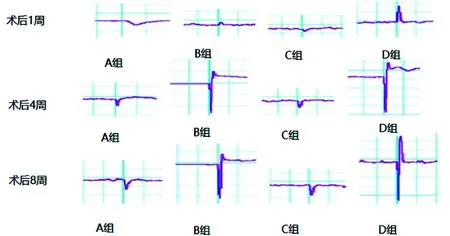
图2 各组腓肠肌的体内复合肌肉动作电位(CMAP)
4 HE染色
通过GraphPad Prism 6 图像软件分析,观察肌肉纤维化程度、肌肉纤维排列的顺序和形态。术后1周各组可观察到肌肉萎缩,各组间差异无统计学意义(P>0.05)。A组和C组在4周时萎缩显著,而B组及D组则萎缩较少。在8周时,A组和C组的肌肉萎缩情况进一步加重,而B组及D组无论是在肌肉纤维化程度、排列的顺序及形态上较4周时无明显变化。在4周和8周对坐骨神经断端进行HE染色时,目视检查 B组及D组中再生纤维有序排列,具有正常直径和施万细胞数;成纤维细胞增生很少。A组呈现无序排列,少量再生纤维和稀疏的施万细胞,C组情况略好于A组。见图3。
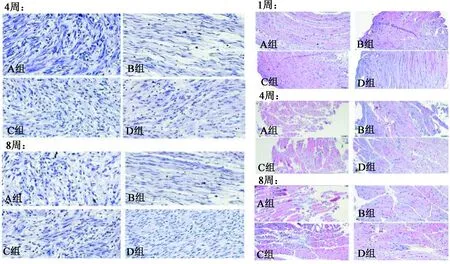
图3 HE 肌肉(左)和神经(右)染色
5 透射电子显微镜
术后4周,尤其是术后8周,D组再生神经纤维数最多,轴突最厚,髓鞘外观正常。在B组中,轴突是圆形的,偶有扭曲。再生神经纤维的数量不高,但轴突显示有序排列,有较规则的髓鞘层状分层。而A组及C组中,再生轴突呈不规则样,纤维数较少,髓鞘变形且薄、不规则。 见图4。

图4 透射电子显微镜显示术后4周和8周轴突形态的变化
讨 论
周围神经重建的效果一直不理想,高质量显微设备和显微器械的出现,伴随的显微镜下操作能力的提升使得显微修复技术和显微外科得到了迅速的发展[12-14]。近年来,PEG及动脉套管在治疗周围神经损伤上取得了较大的进展,但将两者联合应用于周围神经损伤报道较少。
PEG治疗周围神经损伤的主要机制是PEG作为一种膜融合剂,能够在周围神经损伤早期促进轴索细胞膜融合、线粒体膜通透性降低、细胞色素C释放、Ca2+浓度调控,进而延缓华勒变性[15]。然而,仅用PEG进行轴突融合并不能完全避免华勒变性,因为细胞骨架并未完全修复,细胞骨架的迅速重建对于恢复轴突转运至关重要,重建神经连续性和良好的生物力学环境也不可或缺。
动脉套管联合小间隙缝合很好解决了神经连续性恢复的问题,动脉套管联合小间隙缝合的应用已有近20年历史,近似封闭的动脉套管环境为近端与远端神经提供了营养支持,形成了一个有利于神经修复的微环境[16]。将离断神经近端和远端分别插入套管内中间保留间隙,近端神经高度选择性地长入到远端相应位置,避免了标准神经修复模式下近远端匹配错位的问题。本研究应用大鼠自体动脉作为套管桥接神经断端,但在临床工作中选用自体血管作为动脉套管增加患者副损伤同时也受到大小等方面的限制[17-18]。目前临床上可应用的套管分为自体动脉套管和可降解生物型套管。可降解生物型套管材质多样,但作用机理及效果大致相同。
本研究创新性地应用了PEG冲洗动脉套管联合小间隙缝合法缝合的神经断端,包括电生理学、行为学、组织学在内的结果共同显示,1mm小间隙动脉套管联合PEG冲洗可使周围神经离断损伤后形态甚至肢体功能恢复接近正常,效果明显优于单独应用PEG及单独应用动脉套管。
本研究未能在更多的时间点取材并进行所述检测,也未能完成远期大鼠下肢功能恢复情况的观察,未能验证PEG应用的长期效果。并且PEG对于周围神经功能的影响,包括运动和电生理学上的影响作用具体到何种程度,其具体作用机制尚未完全明了;实验组采用PEG600断端冲洗,不同分子量及PEG的应用方式也未进行对比,有待进一步研究。本实验采用动脉套管为5mm,神经断端保留小间隙1mm,不同的套管长度及小间隙长度对神经重建的影响也有待进一步验证。动脉套管联合小间隙缝合PEG冲洗在体内对周围神经损伤修复的具体作用以及分子机制也还需要进一步探究。但从现有的数据来看,PEG联合动脉套管在治疗大鼠周围神经损伤上效果明显优于两者单独应用,可为临床治疗周围神经损伤提供一种新的思路。

