脓毒症药物治疗进展
刘玉新,向弘利
1.重庆大学附属三峡医院百安分院急诊科,重庆 万州 404000;2,重庆大学附属三峡医院全科医学科百安病区,重庆 万州 404000
创伤是严重危害人类健康的疾患。近年来,随着创伤急救系统的不断完善和急救技术的不断改进,严重创伤患者因创伤本身即刻致死的病死率已有所下降,但由创伤严重并发症——脓毒症和多器官功能衰竭引起的病死率却居高不下。如何防治创伤严重并发症,进一步提高严重创伤救治水平是当前创伤医学研究中的重点和难点。除了创伤,脓毒症也常发生在烧伤、外科手术后的患者,是一种发生率高、病情凶险、病死率高的疾病。全球每年有超过1 800万严重脓毒症患者,美国每年有150万例脓毒症患者,并且这一数字还以每年1.5%~8.0%的速度上升[1]。据国外流行病学调查显示,脓毒症的病死率已经超过心肌梗死,成为重症监护病房内非心脏病患者死亡的主要原因。近年来,尽管抗感染治疗和器官功能支持治疗技术取得了长足的进步,脓毒症的病死率仍高达30%~70%。2001年欧洲重症学会、美国重症学会和国际脓毒症论坛发起“拯救脓毒症战役”(surviving sepsis campain,SSC),2002年欧美国家多个组织共同发起并签署“巴塞罗那宣言”,进一步制定基于对脓毒症研究的循证医学证据,并不断更新《脓毒症治疗指南》即SSC指南,以改进脓毒症的治疗措施,降低脓毒症的病死率[2]。目前,脓毒症的治疗方法仍以对症和支持治疗为主,主要包括:抗生素治疗、手术或介入消除感染源、静脉输液维持足够的血容量;收缩和(或)正性肌力药物的给予(如血管加压素、去甲肾上腺素);支持治疗如机械通气、血液透析、体外氧合等。目前脓毒症临床治疗尚缺乏特异性药物,其原因在于包括进行临床试验之前缺乏可靠的临床前数据,将异质性较大的患者纳入临床试验,以及治疗时间抉择错误等。
本文介绍了脓毒症药物治疗的现状和发展,还介绍了一些可能有前景的新治疗方法,包括:更多更完整的体外实验筛选候选药物,建立更接近人体脓毒症的脓毒症动物模型,以及规范化临床试验的脓毒症人群等。
1 脓毒症药物治疗的现状和发展
脓毒症的最主要病原体是细菌,革兰阴性菌的主要毒力成分是脂多糖(LPS),因此,科学家最先想到的脓毒症药物就是LPS的抗体。最早的脓毒症治疗药物探索,是一种靶向J5株大肠杆菌LPS的多克隆抗体,可用作脓毒症药物。皮质类固醇是一类可以减轻免疫炎症反应的药物,因此科学家也较早观察了这类药物在脓毒症中的治疗作用。自此,国内外先后涌现出80余种脓毒症药物治疗的临床Ⅱ期和Ⅲ期临床随机对照实验。在这些实验中,只有少数药物能提高脓毒症患者生存率,大部分药物对患者生存率均无保护作用。这些药物的种类包括:皮质类固醇、LPS抗体、Toll样受体4(TLR4)拮抗剂、肿瘤坏死因子拮抗剂、白介素-1β拮抗剂、靶向血小板活化因子药物、靶向凝血级联反应药物、增强免疫反应药物等。
1.1皮质类固醇 已被用于治疗脓毒症的皮质类固醇类药物包括强效合成糖皮质激素甲基强的松龙和地塞米松,以及天然氢化可的松。糖皮质激素抑制炎症通过多种机制,包括:(1)促进NF-κB抑制剂-α(IκBα)转录增强;(2)抑制促炎转录因子NF-κB信号通路的活化[3];(3)促进annexin-1(又称脂皮质蛋白)蛋白的活化和表达;(4)抑制类花生酸类物质如前列腺素I2(PGI2)和血栓素A2生成途径的早期步骤等[4]。
因为糖皮质激素具有广泛的免疫抑制作用,因此被广泛应用于哮喘或风湿性关节炎等的治疗,并被延伸到脓毒症和感染性休克的治疗上。此外,一些研究显示脓毒症患者常合并肾上腺皮质功能不全[6]。因此,糖皮质激素被尝试用于脓毒症的治疗,但结果显示,仅氢化可的松可能有一定治疗效果,其他几类糖皮质激素类治疗结果均失败[5-6]。
1.2LPS抗体 Ziegler等[7]研究发现,用LPS特异性抗体对小鼠进行被动免疫,可以降低小鼠LPS或革兰氏阴性菌引起的病死率。某些突变菌株产生的LPS分子缺乏LPS关键糖成分,而这些糖成分是决定LPS血清型的关键成分,用这些菌株给动物或人类志愿者被动免疫,产生的疫苗用于对抗来自同源和异源革兰氏阴性菌的LPS。
这些在内毒素血症和革兰氏阴性菌感染动物模型中的研究结果,促使了许多多克隆和单克隆LPS特异性抗体的临床试验(表1)[8-9]。Ziegler等[4]用J5大肠杆菌LPS的多克隆抗体获得了较好的治疗效果,但其患者入组存在偏倚:不是所有参与研究的患者和死亡患者均被纳入评估。人抗LPS免疫球蛋白M单克隆抗体(HA-1A)是一种旨在中和LPS的人类单克隆抗体,在HA-1A的第一阶段Ⅲ期研究中,使用药物治疗的患者生存率有所提高。然而,这项研究有如下几个问题:(1)本领域专家对HA-1A结合和中和LPS的能力仍有异议;(2)在第一阶段Ⅲ期研究中,治疗效果的统计意义很小,只有在病死率高的临床中心和感染性休克患者中才观察到保护作用;(3)在犬腹膜炎模型中,HA-1A抗体治疗的动物病死率高于对照组。这些因素显示HA-1A 未提供任何治疗益处,故HA-1A抗体的开发已被放弃。
1.3TLR4和TNF拮抗剂 脂多糖(LPS)介导的免疫细胞活化由LPS与Toll样受体-4(Toll-like receptor 4,TLR4)相互作用后介导(图1),据此研究者开发了TLR4抑制剂TAK-242[10]和依立托仑(Eritoran,E5564)[11],并进行了相关的临床研究。大量天然阳离子多肽具有抗菌和LPS中和活性,其中杀菌通透性增加蛋白(BPI)由真核细胞产生。一种被称为rBPI21的重组BPI蛋白被证明有LPS中和活性,并已在临床试验中进行了评估。美国多家研究机构组成的科研小组在《自然》杂志上发布了一项研究成果,TLR4受体拮抗剂-Eritoran可以保护致死剂量流感病毒感染的小鼠。然而,在后期的脓毒症患者临床试验中,与安慰剂相比,没有证据能够证明Eritoran有效,因而其临床治疗研究失败[23]。此外,TAK-242和rBPI21的Ⅱ期或Ⅲ期临床试验结果也均为阴性,因此这些化合物的开发均被放弃(表1)[10-11]。
肿瘤坏死因子(TNF)是一种关键的“报警期”细胞因子,是由巨噬细胞、单核细胞或其他多种细胞在炎症反应早期分泌的关键细胞因子(图1)。对实验动物或人类受试者给予TNF时,重组人TNF会引起多种脓毒症的症状和体征,包括发热、白细胞增多、肌痛和低血压。一项前瞻性研究证明,小鼠TNF特异性单克隆抗体F(ab’)2片段可以提高脓毒症患者生存率[12]。然而,在其他研究中,抗肿瘤坏死因子仅能稍微提高脓毒症患者生存率,但结果没有统计学意义(表1)[13-14]。
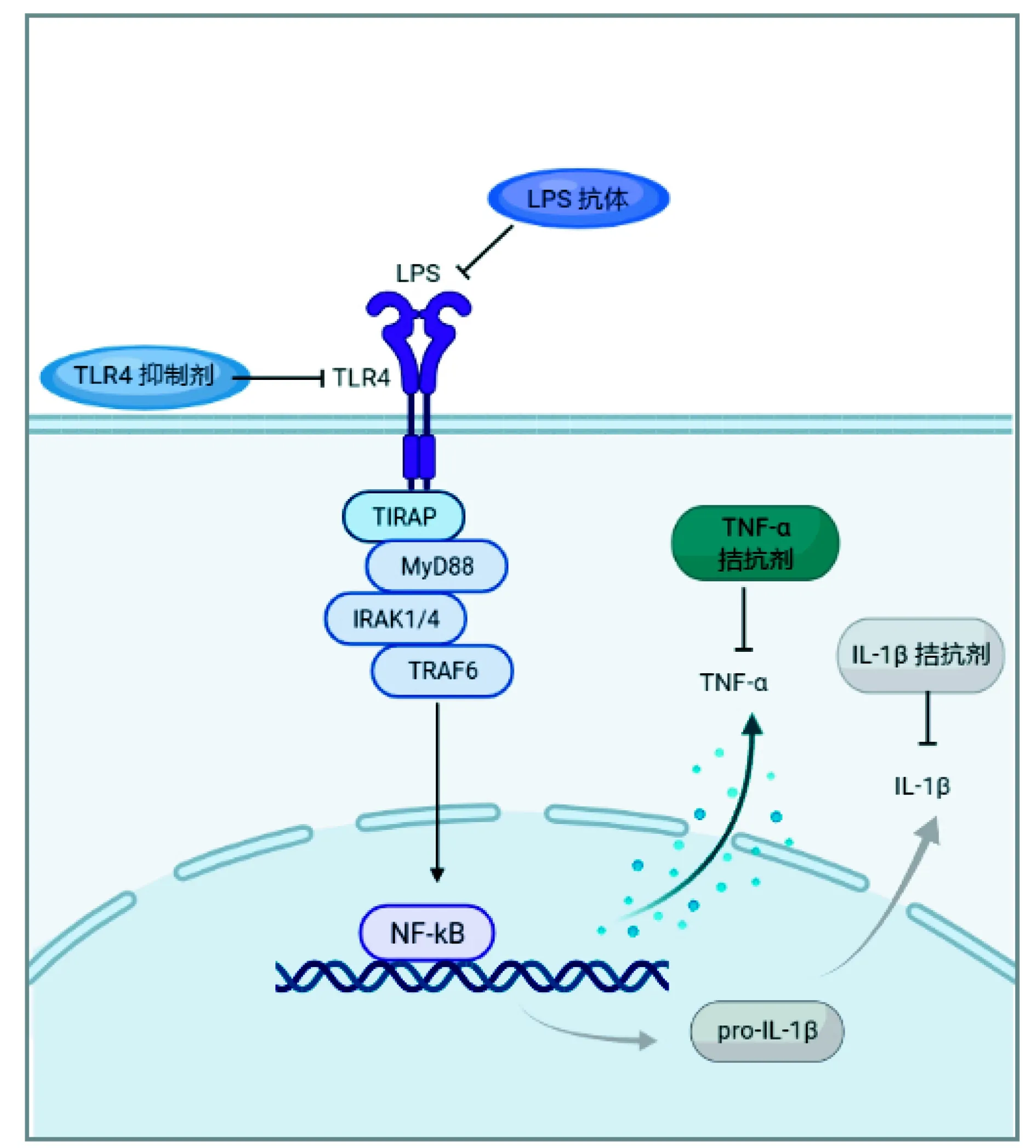
图1 靶向脓毒症炎症反应的治疗药物作用示意图。LPS:脂多糖;TLR4:Toll样受体4;TIRAP:Toll/IL-1的接头蛋白;MyD88:髓样分化因子88;IRAK1/4:白介素受体相关激酶1/4;TRAF6:TNF-α:肿瘤坏死因子α;NF-kB:核转录因子-kB;pro-IL-1β:白细胞介素1β前体
1.4IL-1β拮抗剂 跟TNF类似,白介素-1β(IL-1β)也是一种跟临床脓毒症发生和发展相关的细胞因子(图1)。白介素-1受体拮抗剂(IL-1RA)是一种可以中和IL-1β致炎反应的天然拮抗剂,能与IL-1受体(IL-1R)结合却不激活炎症信号通路。在一项动物实验中,重组IL-1RA能显著提高脓毒症动物的生存率[15]。一项重组人IL-1RA(Anakinra)的临床Ⅱ期实验结果效果很好[16],但Ⅲ期临床实验均已失败[17](表1)。
1.5靶向PAF的药物 血小板活化因子(PAF)是由多种细胞合成和分泌的多能性磷脂炎症介质,可诱发脓毒症的体征和症状,包括全身性动脉低血压、毛细血管渗漏综合征、心肌功能障碍和肺血管收缩。BB-882是一种阻断PAF与其受体结合的药物[18], Pafase则是一种PAF乙酰水解酶[19],是靶向PAF的药物。这两种药物均在严重脓毒症或感染性休克患者进行了临床实验,Ⅱ期临床实验均有效,但Ⅲ期临床实验显示两种药物对脓毒症和脓毒症休克均没有治疗作用[20]。
1.6靶向凝血级联反应的药物 严重脓毒症和感染性休克常伴有弥散性血管内凝血(DIC),临床表现为微血管灌注障碍,以及多个部位的异常出血,如胃肠黏膜、愈合外科伤口或皮肤静脉穿刺部位。虽然许多病理状态可使患者发生DIC,但脓毒症是导致这种致命凝血系统紊乱的最常见原因。目前,有基于狒狒的临床前期实验表明,阻断凝血系统的过度激活可以降低脓毒症病死率[21]。几项实验研究评估了重组人活化蛋白C,一种内源性抗凝血蛋白-重组人活化蛋白C(Drotrecogin alfa)的作用。活化的Drotrecogin alfa在最初的临床Ⅲ期有效[22],但在后续的临床治疗中却被证实无效[23],因此该商售药品自2012年从市场撤出。重组人血栓调节蛋白ART-123(重组蛋白;日本旭化成公司)已被日本批准用于治疗DIC。ART-123临床Ⅲ期实验,用于治疗严重脓毒症凝血障碍患者的试验正在招募参与者。
1.7增强免疫反应的药物 研究者逐渐认识到,脓毒症的特征伴随着炎症反应的过度激活和不同程度的免疫麻痹,研究人员进行了重组粒细胞集落刺激因子(Filgrastim)和人粒细胞巨噬细胞集落刺激因子(Sargramostim)的临床试验,这两种药物能够增加中性粒细胞或巨噬细胞的数量并增强细胞功能[24-25]。然而,这些试验的结果令人失望。在一项关于静脉注射免疫球蛋白M(IgM)的试验中,IgM对腹部手术后脓毒症患者有效[26]。然而,在另一项试验中,IgM对脓毒症的治疗没有任何益处[27]。进入脓毒症治疗临床Ⅱ期或Ⅲ期试验的主要药物及研究结果见表1。
2 脓毒症药物治疗的瓶颈问题
脓毒症是极其复杂的临床综合征,全身炎症反应和免疫功能抑制是其病程中十分突出的两种临床表现,二者并不是简单的独立存在,常常同时并存于脓毒症病理进程。这对脓毒症的炎症和免疫的精准调控,选择合适的治疗药物造成了非常大的困难。而脓毒症治疗药物活性问题、治疗持续时间、患者群体异质性和脓毒症动物模型等几个关键问题,更是脓毒症药物治疗在临床和研究中遇到的瓶颈问题,值得深入探讨。
2.1药物活性问题 一些已经进入晚期临床试验的药物后来被研究发现缺乏相应的药物活性,例如,HA-1A和E5是两种LPS特异性单克隆抗体,在第Ⅲ期临床试验中使用的这两种单克隆抗体,均不能有效综合LPS的促炎作用和促炎反应[28-29]。
2.2治疗持续时间 在迄今为止进行的几乎所有试验中,使用实验药物治疗的持续时间不够规范,没有根据临床或生化检测结果及时进行调整。因此,在某些情况下,治疗时间太短或者太长均不能达到良好的治疗效果。
2.3患者群体异质性 脓毒症药物治疗的临床试验纳入的患者群体通常有较大的异质性。如脑膜炎双球菌脓毒症休克患者入院时平均TNF血液浓度为323pg/mL,而社区获得性肺炎和严重脓毒症患者为7.5 pg/mL[30]。此外,在一项583例严重脓毒症患者的前瞻性研究中,超过半数的患者在入院后第1周内每天检测到的血TNF水平均<8.1pg/mL[31]。因此,在对各种中和TNF的抗体、抗体片段等的研究中,许多患者的TNF血清浓度可能本身就很低,得到阴性结果不足为奇。临床前研究和临床研究的结果表明,有些治疗脓毒症的药物可能对部分患者有益,而对另一部分患者无益。这些截然不同的试验可能会掩盖药物的真正效果。因此,部分因Ⅱ期或Ⅲ期临床试验的结果令人失望而被搁置的药物,如果给药剂量、治疗持续时间和患者亚群合适,对脓毒症的治疗可能有效,例如几种抗TNF的化合物,如TNF特异性单克隆抗体(Afelimomab)和人粒细胞巨噬细胞集落刺激因子(Sargramostim)。
2.4脓毒症动物模型问题 研究者采用过数十种脓毒症和脓毒症休克的动物模型,脓毒症动物模型可分为两大类:感染模型和中毒模型。感染模型采用活菌制作动物模型,中毒模型的动物会给予LPS、脂磷壁酸(LTA,一种金黄色葡萄球菌的细胞壁成分)或发酵多糖制作。其中,一种啮齿类动物的细菌性腹膜炎,盲肠结扎穿刺(cecal ligation and puncture,CLP)被广泛应用,并被视为脓毒症动物模型“金标准”。小鼠CLP模型可以复制人继发性细菌性腹膜炎的许多关键特征,包括多重细菌感染、循环高迁移率族蛋白B1(HMGB1)水平持续升高和急性肺损伤等[32-33]。
在进入临床试验之前,许多脓毒症药物均被证明能够提高一种或多种脓毒症动物模型的存活率。然而,当这些化合物在患者身上进行试验时,对存活率的改善不明显,没有统计学意义。在某些情况下,治疗脓毒症或脓毒症休克的药物在临床前药理研究中产生了相互矛盾的结果。例如,LPS、活的革兰氏阴性杆菌、金黄色葡萄球菌或B组链球菌的脓毒症小鼠模型中,TNF中和抗体是有保护作用的。然而,TNF中和抗体对动物肺炎模型却是有害的,可能因为TNF中和抗体损害了宿主的抗菌防御[34]。
目前没有非常好的脓毒症动物模型有如下几个原因:(1)大多数动物实验使用青壮年期的健康动物,没有严重并发症。然而人类脓毒症通常发生在老年人,患者常伴有一种或多种并发症,如恶性肿瘤或慢性病。(2)实验动物很少有支持性护理,如机械通气,而危重患者常有支持性治疗。(3)许多动物实验用LPS注射模拟急性内毒素血症模型,LPS剂量大的时候,先天免疫系统的过度激活会导致动物休克而最终致死,因此抑制炎症的药物一般能降低动物脓毒症模型病死率。相比之下,抑制炎症的药物由于影响了入侵病原体的清除,对部分脓毒症患者反而可能起到了有害的作用。
脓毒症动物模型还有一个有别于人类的特点,包括小鼠、大鼠和狒狒等物种,对LPS的毒性或致死作用的敏感性均显著低于人类[35]。小鼠的脂多糖半数致死量为1~25mg/kg[36],而诱导人类产生炎症反应的症状,如发热和肌痛的LPS剂量为2~4ng/kg。LPS的小鼠半数致死剂量是诱发人类低血压等严重反应剂量的1 000~10 000倍。然而,导致小鼠和人类对LPS反应性巨大差异的机制仍有待阐明。此外,通过对人类烧伤、创伤和急性内毒素血症相关基因的系统分析,人类脓毒症时表达改变的基因也与小鼠有较大差异,这表明,如果使用小鼠模型来探寻治疗脓毒症的药物,那么应该谨慎评估其是否适用于人类脓毒症患者[37]。
3 脓毒症药物治疗前景与展望
针对脓毒症药物治疗中的各种难以解决的问题,以下几个方面改进可能会为后续的药物研究提供新的思路。(1)动物模型方面。与鼠龄低的大鼠相比,老年大鼠的循环炎症细胞因子水平更高,脾淋巴细胞凋亡更广泛,使用老年动物代替低鼠龄动物可以增强脓毒症动物模型的临床相关性。(2)可以尝试使用“人源化小鼠”制作脓毒症动物模型。 “人源化小鼠”是一种将人CD34+脐带血造血干细胞移植到受γ射线照射的新生缺乏IL-2受体γ-链的联合免疫缺陷小鼠产生[38]。小鼠发育出一个完整的人类细胞系的先天性和适应性免疫系统,包括单核细胞、巨噬细胞、浆细胞和髓样树突状细胞、自然杀伤细胞、T细胞和B细胞,然后对该小鼠制作CLP脓毒症模型。然而该方法成本较高,难度也较大。(3)采用大动物制作脓毒症模型。小鼠模型具有体积小、成本低等优点,因此被广泛用于治疗脓毒症新型药物的临床前研究。然而,羊、猪和兔子对脂多糖的反应均比小鼠大很多,与人类更相似,且免疫功能也更接近人类,故大动物的临床前研究结果可能更好地预测人临床试验的结果。
尽管脓毒症的药物治疗领域被称为“百慕大三角”,目前仍没有特异性药物,但近年来随着临床医学生命支持治疗领域的发展,脓毒症病死率正在逐渐下降。近几年,脓毒症治疗领域仍有较多进展并带来新的期望。快速发展的基因组学让人们深入认识了脓毒症的病理生理基础,揭示了系列脓毒症相关的信号通路,也涌现出了较多的脓毒症生物标志物,例如补体因子B、胃泌素释放肽受体和基质金属蛋白酶8(MMP8)等。靶向脓毒症“细胞因子风暴”关键分子的药物治疗领域,也有较多新的突破。如间变性淋巴瘤酶(ALK)介导了“细胞因子风暴”关键通路-干扰素基因刺激蛋白(STING)通路的活化,因此阻断了脓毒症过量的细胞因子释放,ALK抑制剂可能是一种有前景的脓毒症“细胞因子风暴”靶向治疗药物[39]。此外,STING在单核巨噬细胞的过度活化也是导致脓毒症免疫凝血紊乱的关键正调控信号[40],STING的非I型干扰素依赖通路-STING-焦孔素(GSDMD)-F3是脓毒症细菌感染时DIC的关键调控通路,跨膜蛋白173(TMEM173)-GSDMD信号通路的遗传或药理学阻断药物牛磺熊去氧胆酸(TUDCA)和2-氨基乙氧基二苯硼酸酯(2-APB),可以显著降低脓毒症DIC病死率。据此,有理由相信,随着对脓毒症发生发展分子机制的进一步揭示,动物模型的深入研究以及更多临床试验的完善,脓毒症的药物治疗前景将是非常乐观的。

