去泛素化酶OTUD3调控胆固醇酯化酶SOAT1蛋白稳定性的机制
盖文彬,毕明霞,姜宏
(青岛大学国家生理学重点(培育)学科,山东青岛 266071)
胆固醇酯化酶甾醇O-酰基转移酶1(SOAT1)是胆固醇酯生物合成的关键酶[1],对维持细胞内脂代谢的稳态至关重要。SOAT1在多种肿瘤中异常高表达,与原发性肝癌、胰腺癌、肾癌和前列腺癌等的预后不良密切相关,提示SOAT1或可作为多种肿瘤的预后生物标志物和治疗靶点。在肝癌细胞中SOAT1通过促进胆固醇的合成,进而影响癌细胞的生长和迁移,促进肿瘤的发生发展[2-5]。因此,研究肝癌细胞中SOAT1蛋白稳定性的调控机制,可以为深入了解肝癌的发病机制及寻找新型药物治疗提供新的思路。
在肿瘤中SOAT1 转录水平并没有明显变化,而蛋白表达上调却十分显著,提示肿瘤中异常高表达的SOAT1 主要受到蛋白水平的调控[3]。泛素-蛋白酶体系统是生物体内维持蛋白质稳态的重要途径,蛋白发生泛素化修饰后会被蛋白酶体降解。泛素化修饰是一种依赖ATP 的级联反应,需要泛素激活酶E1、泛素结合酶E2和泛素连接酶E3的参与[6-8]。泛素化修饰是一种可逆的动态过程,除了上述酶分子,去泛素化酶(DUB)也参与其中,它与泛素连接酶E3共同维持蛋白质的稳态[9]。已有研究证实,SOAT1的表达受到泛素-蛋白酶体系统的调控[10],但维持其蛋白稳定性的DUB却未见报道。本研究旨在鉴定SOAT1的DUB,揭示在肝癌细胞中SOAT1蛋白异常高表达的分子机制,为研发靶向SOAT1的肿瘤治疗药物提供理论依据。
1 材料与方法
1.1 实验材料
Protein A/G-agarose beads、GAPDH、SOAT1抗体、Normal IgG、相关二抗购自Santa Cruz公司;Flag抗体、蛋白酶体抑制剂MG132购自Sigma公司;HA-Ubiquitin 抗体购自MBL 公司;Lipofectamine2000购自Invitrogen 公司;OTUD3 抗体购自abcam 公司;RPMI-1640(1∶1)培养液、胎牛血清(FBS)、MEM 和DMEM 购自Gibco公司;Super-Signal west pico chemiluminescence substract购自Thermo公司;PBS粉末、抗原修复液购自北京中杉金桥公司。
1.2 细胞培养
人肾上皮细胞系HEK293T、人高转移性肝癌细胞HCCLM3、人肝星形细胞LX2、人肝癌细胞SK-HEP-1、人高转移性肝癌细胞97 H 培养于含有体积分数0.10 FBS、100 mg/L 青链霉素混合液的DMEM 细胞培养液中;正常人肝上皮细胞HL-7702、人肝癌细胞系SSMC7721、人肝癌细胞BEL-7402培养于含有体积分数0.10 FBS、100 mg/L 青链霉素混合液的RPMI-1640细胞培养液中;肝癌亚力山大细胞PLC/PRF/5培养于含有体积分数0.10 FBS、100 mg/L青链霉素混合液的MEM 细胞培养液中。上述细胞均应用细胞培养皿,置于37 ℃、体积分数0.05 CO2的细胞培养箱中进行培养。传代时用与细胞等渗的PBS洗去血清,加入2.5 g/L 胰蛋白酶进行消化,并根据实验需要将细胞铺于不同规格的细胞培养板或培养皿中。
1.3 质粒及引物构建
人源DUB文库(载体pCMV6-entry)购自Ori-Gene 公司。OTUD3 及OTUD3 的酶活突变体C76A 购自生物工程(上海)公司。引物序列见表1。

表1 载体引物序列
1.4 细胞转染
脂质体转染采用Lipofectamine2000转染试剂。在无血清的细胞培养液中分别加入需要转入细胞的质粒DNA 和所需量的脂质体,单独混合室温放置,5 min后将含有质粒DNA 和所需量脂质体的无血清培养液混合孵育,30 min后加入细胞培养液中,37 ℃培养4 h后弃去含DNA-脂质体复合物的培养液,换成含血清和抗生素的培养液继续培养24 h。
1.5 免疫共沉淀实验
用25 cm2的培养瓶培养细胞到70%融合,转染质粒48 h 后收集细胞;用预冷的PBS 洗涤3 次,4 ℃下以3 000 r/min离心5 min;用HEPES裂解液裂解细胞,超声处理2 min;4 ℃下以12 000 r/min离心10 min,取上清,除少量作为lysate蛋白样品外,其余上清中加入相应抗体1μg,4 ℃下在旋转混合器上混匀3 h;加入protein A/G-agarose,4 ℃混匀8 h以上;4℃下以3 000 r/min离心5 min,用裂解液洗涤3次,加入2×Sample buffer,100 ℃变性15 min,样品进行免疫印迹检测。
1.6 体内泛素化修饰实验
应用Lipofectamine2000转入各种目的质粒;收获细胞前8 h 加入20μmol/L MG132 处理;36~48 h后用RIPA 裂解液裂解细胞,并超声破碎;收集部分裂解液检测各种质粒的表达;加入相应抗体进行免疫沉淀,4 ℃混匀8 h以上;用RIPA 裂解液洗涤,加入2×Sample buffer,100 ℃变性15 min,样品进行免疫印迹检测。
1.7 免疫印迹检测
收集细胞后,加入实验所需的细胞裂解液及等量的2×Sample buffer混合,100 ℃沸水煮15 min后进行SDS-PAGE电泳;分离实验所需目的条带的SDS变性胶,将蛋白转移到硝酸纤维素膜上,置含50 g/L脱脂牛奶的TBST 缓冲液中封闭90 min;然后加一抗室温孵育3 h或4 ℃过夜,用TBST 缓冲液洗膜3次,每次10 min;加耦联HRP的二抗孵育1 h,用TBST 洗膜3次后,加入底物化学发光剂,于暗室中进行X 线片曝光显影。
2 结 果
2.1 泛素-蛋白酶体系统对SOAT1蛋白表达影响
免疫印迹检测结果显示,SOAT1 在不同肝癌细胞系中的表达水平不同(图1A),选择SOAT1表达较低的HCCLM3细胞系,加入蛋白酶体抑制剂MG132后,SOAT1的蛋白表达水平回升(图1B)。此外,SOAT1可以在肝癌细胞HCCLM3中发生多聚泛素化修饰(图1C)。该结果表明,泛素-蛋白酶体系统参与调控SOAT1的蛋白稳定性。

图1 泛素-蛋白酶体系统对SOAT1蛋白表达影响
2.2 OTUD3与SOAT1的相互作用
选用人肾上皮细胞系HEK293T 进行实验,在人源去泛素化酶OTU 家族成员中进行无偏性相互作用筛选,结果显示,OTUD3 可以特异地与内源SOAT1发生相互作用(图2)。
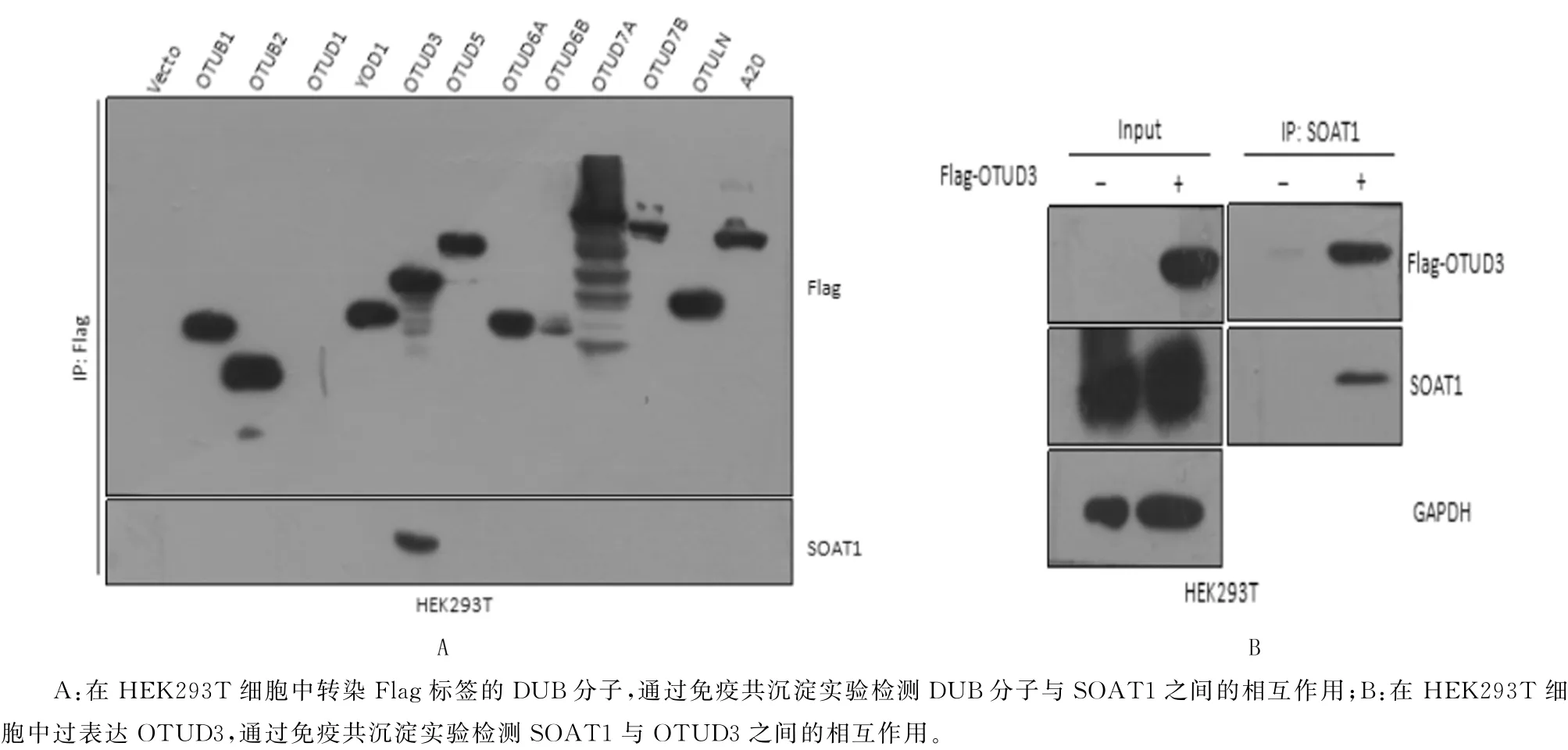
图2 OTUD3与SOAT1相互作用的免疫共沉淀实验检测
2.3 OTUD3对SOAT1多聚泛素化的影响
选用人肾上皮细胞系HEK293T 进行泛素化实验,结果显示,过表达OTUD3能有效去除SOAT1蛋白的多聚泛素化(图3A)。并且,只有野生型的OTUD3可以去泛素化修饰SOAT1,而酶活突变体OTUD3-C76A 无法去除SOAT1 蛋白的多聚泛素化(图3B),说明OTUD3的去泛素化酶活性对稳定SOAT1至关重要。
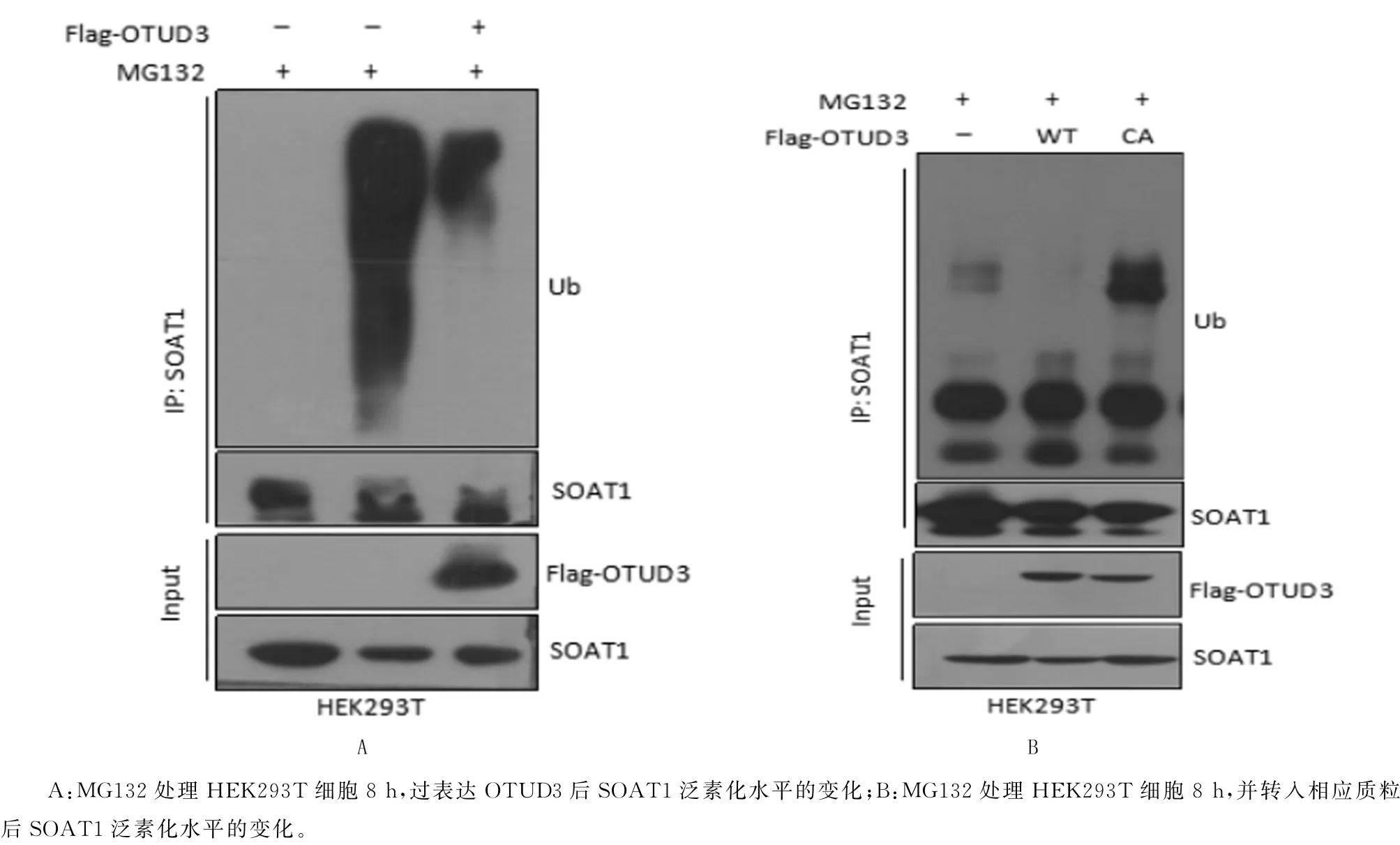
图3 OTUD3对SOAT1多聚泛素化的影响
2.4 OTUD3对SOAT1蛋白稳定性的影响
在HEK293T 细胞中梯度过表达OTUD3,可特异性上调SOAT1的蛋白表达水平(图4),表明OTUD3通过去除SOAT1的多聚泛素化修饰维持SOAT1的蛋白稳定性。
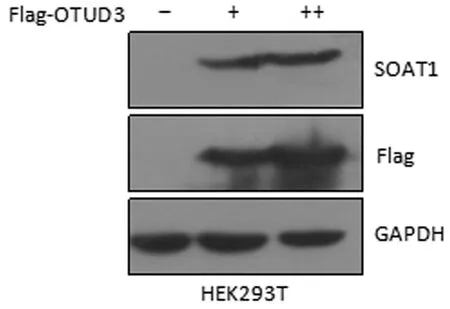
图4 OTUD3对SOAT1蛋白稳定性的影响
3 讨 论
本研究鉴定出了调控SOAT1 蛋白表达的DUB分子OTUD3,OTUD3依赖其去泛素化酶活性,通过特异性去除SOAT1的多聚泛素化修饰,维持SOAT1的蛋白稳定性。
SOAT1是一种定位于内质网的5 次跨膜蛋白[1]。内质网是蛋白质合成和折叠的重要场所,内质网中的蛋白稳态由一套精细的质量控制系统调控。当新合成的蛋白质发生错误折叠时,它最终会从内质网中被逆向转运到细胞质,随后被泛素化降解,这一途径被称为内质网相关蛋白降解,简称为ERAD[7,11]。近年来的研究结果表明,ERAD 减轻了蛋白质错误折叠引起的细胞毒性,其对突变蛋白的降解在多种疾病中发挥作用[12-14]。在ERAD 过程中,已经鉴定出的泛素连接酶E3数量并不多[11],并且在底物的特异性识别过程中DUB承担关键的作用[15]。因此,鉴定出SOAT1 的DUB 对于阐明维持SOAT1蛋白稳态的分子机制尤为重要。
胆固醇是生物体内一种重要的分子,它既是细胞膜的重要组成部分,也是很多固醇类激素的前体[1,16]。但是,细胞内的游离胆固醇过多是有害的,其会在内质网被酰基化,以疏水的胆固醇酯的形式储存起来,这一过程由SOAT1催化[1,12,17-19]。有研究表明,癌细胞中高表达的SOAT1通过影响胆固醇酯的合成,促进癌症的发生与转移[3],敲除或者抑制SOAT1后,肝癌细胞的增殖和迁移能力降低[3]。SOAT1高表达与肝癌、甲状腺癌、头颈癌、胃癌、肾癌、前列腺癌、胰腺癌等不良预后均有关,有望被用作多种肿瘤的预后生物标志物和治疗靶点[17,20-22]。近年来,肿瘤免疫治疗备受关注,已有研究结果显示,联合应用SOAT1 抑制剂Avasimibe和抗程序性死亡受体1抗体对小鼠黑色素瘤进展的控制效果优于单用Avasimibe[23]。因此,研究维持SOAT1蛋白稳定性的分子机制对于疾病的治疗及预后评估具有重要意义。
SOAT1的蛋白稳定性受到泛素-蛋白酶体系统的调控[10],泛素化与去泛素化作为一种重要的蛋白质翻译后修饰,在控制底物降解中起着至关重要的作用,参与了调控细胞内蛋白稳态和各项生命活动[2]。目前,调控SOAT1的泛素连接酶E3未见文献报道,本研究鉴定出的SOAT1 的去泛素化酶OTUD3,可特异性去除SOAT1 的多聚泛素化修饰,从而维持其蛋白稳定性。OTUD3是OTU 家族的去泛素化酶。本实验室前期研究显示,在乳癌、结肠癌、肝癌和宫颈癌中,OTUD3 通过稳定人第10号染色体缺失的磷酸酶以及张力蛋白同源物基因(PTEN)发挥抑癌作用[24];而在肺癌中,OTUD3通过稳定促癌蛋白GRP78发挥促癌作用[25]。
综上所述,本研究首次揭示OTUD3是SOAT1的去泛素化酶,该结果对于明确SOAT1蛋白稳定性的调控机制以及靶向SOAT1的肿瘤治疗具有重要意义。

