电针与穴位注射法治疗腹泻型肠易激综合征小鼠模型效果的比较研究*
付怡茗,魏晓彤,柏寒,王翠平,杨继国
(山东中医药大学,山东 济南 250355)
肠易激综合征(irritable bowel syndrome,IBS)是一种以持续或间歇性腹痛并伴有大便性状异常为特征的功能性胃肠疾病,临床以腹泻型(IBS-D)患者最为多见。IBS发病机制复杂,病程较长且迁延难愈,常给患者带来严重的生活困扰。近年来,针刺治疗IBS-D以其独特的治疗优势引起了国内外的广泛关注[1]。研究发现,精神异常与心理障碍是导致IBS发生的重要因素,其作用机制可能与“脑-肠轴”有关[2]。基于这一特点,临床研究发现以“健脾调神”法针刺治疗IBS-D能显著改善胃肠功能,降低疾病复发率[3]。穴位注射与电针作为针刺的常规治疗方式,目前广泛应用于临床IBS患者的治疗当中,现代研究中鲜有二者的治疗效果对比的相关报道。故本研究以“健脾调神”针刺法为基础,观察穴位注射与电针治疗IBS-D模型小鼠的效果差异,以期为临床治疗IBS-D提供方案选择的理论依据和数据参考。
1 材料与方法
1.1 实验动物4个月龄SPF级KM孕鼠5只,体质量80~120 g,购自济南朋悦实验动物繁育有限公司,许可证号:SCXK(鲁)2019-0003。实验在山东中医药大学实验动物中心进行,实验动物使用许可证号:SYXK(鲁)2017-0022,实验前将孕鼠适应性饲养1周,自由进食与饮水,室温(24±2)℃,湿度(50±5)%。实验动物所有操作经山东中医药大学实验动物福利伦理审查委员会批准,批号:SDUTCM20200907003。
1.2 药物与试剂0.5%乙酸水溶液(安徽雷根生物技术有限公司,批号:0917A20);番泻叶水煎液(山东中医药大学中药房);黄芪注射液(神威药业集团有限公司,批号:Z13021000);75%医用消毒酒精(湖南广盛源医药科技有限公司,批号:20180722);10%福尔马林中性固定液(南昌雨露实验器材有限公司,批号:200904);碳素墨汁(北京一得阁公司,批号:20201011);甲苯胺蓝染色液(北京索莱宝科技有限公司,批号:G3663)。
1.3 主要仪器SDZ-V型华佗牌电子针疗仪(苏州医疗用品厂有限公司);YH-A3001型电子天平(五鑫衡器有限公司);华佗牌0.18 mm×13 mm一次性使用无菌针灸针(苏州医疗用品厂有限公司,批号:200135);一次性无菌注射器(江苏治宇医疗器械有限公司,医疗器械注册证编号:国械标准20173150338);2.7 mm双腔球囊导尿管(浙江优特格尔医疗用品有限公司,医疗器械注册证编号:浙械标准20192140251);0.5 mm×1 mm毛细硅胶管(上海深辉橡塑五金有限公司,批号:200510);EG1160型生物组织包埋机(德国徕卡公司);RM2135型石蜡切片机(德国徕卡公司);E400型生物显微镜(日本尼康公司);BX40型显微镜照相系统(日本Olympus公司)。
1.4 造模与分组5只KM孕鼠在适应性饲养1周后生产幼鼠共56只,筛选体质量10~20 g、雌雄各半的新生幼鼠32只,按随机原则选取8只作为空白组,不予干预,正常饲养。剩余24只采用母婴分离、乙酸灌肠、番泻叶灌胃及夹尾刺激联合制备实验所需IBS-D模型小鼠[4-5]。造模新生幼鼠于出生后第2天开始进行不可预测性[6]母婴分离,每日持续3 h;从第12天开始叠加0.5%乙酸灌肠刺激,具体实验剂量见表1,以上均持续至第26天结束。其后正常饲养至第50天,同日开始对造模小鼠进行番泻叶水煎液灌胃(29.4 g/100 mL),并在自制束缚袋中对小鼠尾外侧1/3处行夹尾刺激,每日持续夹尾5 min,持续至第57天结束。造模后,模型小鼠出现符合中医辨证的肝郁脾虚证候的情况,如精神抑郁(情绪敏感度增高、易怒易嘶叫,日常倦怠懒卧,毛发枯黄无光泽),排便异常(稀便率增加、排便次数增多),胃肠道功能紊乱(肠道敏感度增加、饮食减少、体质量增长速度减缓)。

表1 小鼠结肠0.5%乙酸灌肠量(mL)
造模结束后,24只模型小鼠按随机原则分为模型组、穴位注射组和电针组,每组8只,并在空白组、模型组、穴位注射组和电针组中分别随机选取2只小鼠,取结肠组织行HE染色,以结肠组织无明显病理性改变作为造模成功的依据。
1.5 实验给药造模成功后,第60天开始进行针刺干预刺激。取穴参考《实验针灸学》[7]中定位标准:“足三里”位于膝关节外侧,腓骨小头下约3 mm,皮下直刺6 mm;“百会”位于顶骨正中,向前平刺2 mm。采用棉绳捆绑小鼠四肢并系于解剖板进行固定,电针组小鼠常规穴区消毒后,应用0.18 mm×13 mm针灸针快速进针,连接电针仪,采用疏密波(2/100 Hz),调整强度为1,穴位单侧取用次日轮换,每日持续15 min。穴位注射组采用1 mL无菌注射器给予各穴位0.05 mL黄芪注射液,并按电针组相同束缚方法束缚15 min。模型组小鼠以相同的束缚方法束缚15 min,此外不给予任何刺激。空白组正常饲养,不给予任何刺激。以6 d为1个疗程,中间休息1 d,共治疗4个疗程。
1.6 观察指标
1.6.1 一般情况观察 每日观察各组小鼠的精神行为状态、毛发色泽状况、活动情况、排便情况及粪便性状等。
1.6.2 Bristol粪便性状评分 参考Bristol粪便性状7级评分标准[8](见表2),针刺干预结束后当日,收集各组小鼠16:00:00—18:00:00的粪便并对各组小鼠粪便情况进行评分。

表2 Bristol粪便性状量表
1.6.3 腹壁回缩反射(abdominal withdrawal reflex,AWR)于造模结束后、针刺干预结束后当日,依据AWR评分标准[5](见表3),分别测定各组小鼠在AWR评价达到3分时的最小容量阈值。实验前禁食不禁水12 h,用棉绳将小鼠四肢绑在解剖板上固定,将涂抹石蜡油的带扩张球囊的硅胶导尿管轻柔地插入小鼠肛门,使球囊末端深入肛门约5 mm,将导管与小鼠尾部用无菌胶布固定牢固。待小鼠适应20 min后,经导管向球囊匀速注入24℃温水,使肠道扩张,扩张时间持续20 s,观察并记录引起小鼠腹部抬起(AWR评价为3分)的最小注水量。用注射器将球囊内的水吸净,待10 min后进行下一次球囊扩张实验,重复扩张3次,取3次所得最小注水量的均值代表该小鼠的最小容量阈值,评价小鼠对直肠扩张刺激的敏感性。

表3 腹壁回缩反射(AWR)评分(分)
1.6.4 小肠推进率测定 实验前禁食不禁水24 h,于针刺结束当日按0.15 mL/10 g对各组小鼠进行墨汁灌胃,静置15 min后,快速脱颈处死,剖开小鼠腹腔,迅速取出小鼠整个胃肠道,拉直后测定小肠推进率。小肠推进率=墨汁前沿至幽门的距离/小肠总长度×100%。
1.6.5 结肠组织的病理学改变 于小肠推进率测定结束后取距离肛门6 cm处结肠段各3 cm,经生理盐水冲洗后放入10%中性福尔马林固定液固定。经常规石蜡包埋组织切片,HE染色后光镜(×200)下观察结肠组织形态。
1.6.6 结肠组织肥大细胞(mast cells,MC)计数 取“1.6.5”经常规石蜡包埋组织切片,行甲苯胺蓝染色,随机选取3个视野光镜(×400)下观察MC形态,连续计数后取平均值。
1.7 统计学方法采用SPSS 23.0软件进行统计学分析。计量资料均以(±s)表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠一般行为学观察空白组小鼠精神状态良好,毛发顺滑有光泽,饮食、大便正常。造模小鼠较空白组小鼠体型偏瘦小,精神状态较差,易怒易嘶叫打斗,毛发枯黄稀疏,日活动减少,饮食减少且出现不同程度的稀便。经穴位注射与电针治疗后,小鼠情绪易激状态明显改善,活动增加,毛发逐渐恢复亮白色,饮食量增加。
2.2 各组小鼠Bristol粪便性状评分比较模型组小鼠Bristol粪便性状评分明显高于空白组(P<0.05);穴位注射组、电针组小鼠Bristol粪便性状评分明显低于模型组(P<0.05);电针组小鼠Bristol粪便性状评分明显低于穴位注射组(P<0.05);表明穴位注射与电针均能改善IBS-D小鼠腹泻状态,但电针效果明显优于穴位注射。(见表4)
表4 各组小鼠Bristol粪便性状评分比较(±s,分)

表4 各组小鼠Bristol粪便性状评分比较(±s,分)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与穴位注射组比较,cP<0.05
组别 动物数(只) 粪便性状评分空白组 6 3.73±0.45模型组 6 5.70±0.46a穴位注射组 6 4.71±0.46b电针组 6 4.20±0.40b c
2.3 各组小鼠AWR最小容量阈值比较造模后,模型组、穴位注射组、电针组小鼠AWR最小容量阈值均明显低于空白组(P<0.05),说明造模后小鼠肠道敏感性增高。干预后,电针组小鼠AWR最小容量阈值高于模型组(P<0.05),穴位注射组小鼠AWR最小容量阈值高于模型组,但差异无统计学意义(P>0.05);电针组小鼠AWR最小容量阈值明显高于穴位注射组(P<0.05),说明电针能改善IBS-D小鼠肠道高敏感状态。(见表5)
表5 各组小鼠AWR最低容量阈值比较(±s,mL)
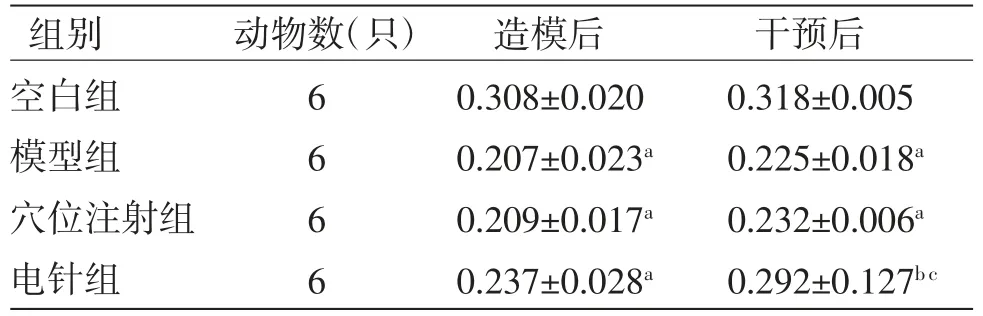
表5 各组小鼠AWR最低容量阈值比较(±s,mL)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与穴位注射组比较,cP<0.05
组别 动物数(只) 造模后 干预后空白组 6 0.308±0.020 0.318±0.005模型组 6 0.207±0.023a 0.225±0.018a穴位注射组 6 0.209±0.017a 0.232±0.006a电针组 6 0.237±0.028a 0.292±0.127b c
2.4 各组小鼠小肠推进率比较模型组小鼠小肠推进率明显高于空白组(P<0.05);穴位注射组、电针组小鼠小肠推进率均明显低于模型组(P<0.05);电针组小鼠小肠推进率明显低于穴位注射组(P<0.05);表明穴位注射、电针均能改善IBS-D小鼠胃肠功能紊乱状态,但电针效果优于穴位注射。(见表6)
表6 各组小鼠小肠推进率比较(±s,%)

表6 各组小鼠小肠推进率比较(±s,%)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与穴位注射组比较,cP<0.05
组别 动物数(只) 小肠推进率空白组 6 0.743±0.015模型组 6 0.832±0.021a穴位注射组 6 0.786±0.008b电针组 6 0.740±0.007b c
2.5 各组小鼠结肠组织黏膜形态观察各组小鼠结肠黏膜形态完好,无炎症,黏膜固有层中无中性粒细胞浸润,间质无水肿,柱状细胞排列整齐,杯状细胞数量较多。(见图1)
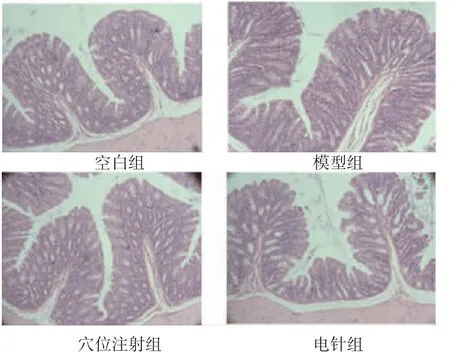
图1 各组小鼠结肠组织的病理图(HE,×200)
2.6 各组小鼠结肠组织肥大细胞(MC)浸润程度比较空白组小鼠结肠组织MC呈圆形,外观平整均匀,单个散布于组织中,浸润程度低;模型组小鼠结肠组织MC以不规则形状集中分布为主,且浸润程度明显高于空白组(P<0.05);穴位注射组、电针组小鼠结肠组织MC以不规则椭圆形为主、边界清晰、散在分布于组织中,且浸润程度均明显低于模型组(P<0.05);电针组小鼠结肠组织MC浸润程度明显低于穴位注射组(P<0.05)。(见图2、表7)

图2 各组小鼠结肠组织MC浸润程度(甲苯胺蓝,×400)
表7 各组小鼠结肠组织肥大细胞数目比较(±s,个/视野)

表7 各组小鼠结肠组织肥大细胞数目比较(±s,个/视野)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与穴位注射组比较,cP<0.05
组别 动物数(只) 肥大细胞数目空白组 6 0.67±0.37模型组 6 4.61±1.65a穴位注射组 6 3.45±0.72b电针组 6 1.78±0.46b c
3 讨 论
研究发现,IBS-D的发病机制可能与胃肠动力紊乱、内脏高敏感性及脑肠互动关系密切[2]。随着脑肠轴理论研究的不断深入,精神心理因素已成为导致IBS-D发生的重要因素,并且与疾病发展预后密切相关。IBS-D在中医学中多属于“泄泻、肠郁”的范畴,IBS-D的基本病机为肝郁脾虚,其中脾胃失调是基础,而情不遂、神不和则为发病的关键。张介宾在《景岳全书》中有言:“脾胃之伤于情志者,较之饮食寒暑为更多也。”当情志生变,累及脾胃而无力化生气血,易导致出现以气血不足、心神失养为主要表现的临床症状。基于对发病机理的认知,“健脾调神”针刺治疗IBS-D在临床收效甚佳。“百会”位于巅顶,具有调神健脑之功,依据经络循行,脑与胃、大肠、小肠经均相通,且为掌管人体一切思维与情志的“元神之府”,同时又能够升阳固脱,对治疗泄泻有一定的疗效;“足三里”为胃之下合穴,所谓“肚腹三里留”,该穴具有健运中州,维持胃肠运动稳定的功能。两穴相配,调情志而理气血,健脾胃而畅气机,不仅能够改善胃痛、泄泻等症状,又可以缓解患者抑郁、焦虑的情绪。目前认为,针刺治疗IBS-D具有独特优势。相较于单纯的运用西医治疗,电针治疗IBS-D能够更好地缓解患者腹痛的症状,平衡胃肠功能,改善精神状况[9]。韦丽萍等[10]采用穴位注射黄芪注射液治疗IBS-D,结果显示其治疗有效率显著高于西医对照组,且复发率明显降低。此外,相较于中药内服,电针与穴位注射具有操作简便、副作用小、用药量小且作用迅速的特点,更有利于患者接受及临床的推广使用。
本实验采用母婴分离、乙酸灌肠、番泻叶灌胃和夹尾刺激联合制备实验所需IBS-D小鼠模型。实验结果表明,模型小鼠Bristol粪便性状评分提高,AWR最小容量阈值降低(P<0.05),HE染色显示模型小鼠结肠黏膜形态完好、无炎症细胞浸润、无器质性病理改变。以上各项指标均符合肝郁脾虚型IBS-D模型的病理特点。通过比较干预后各组小鼠的Bristol粪便性状评分、AWR最小容量阈值、小肠推进率,我们发现穴位注射组与电针组小鼠的排便异常、内脏高敏感性及胃肠紊乱情况均有所改善,但电针的治疗效果明显优于穴位注射。
MC与IBS-D的关系主要体现在增加内脏敏感度,造成胃肠动力紊乱,以及破坏肠道的免疫屏障功能[11]。当人体受到外来刺激时会导致肠道内MC大量活化脱颗粒,从而释放多种活性介质和细胞因子,其中5-羟色胺(5-HT)是重要的介质之一。5-HT广泛存在于胃肠道中,其受体5-HT3、5-HT4广泛参与对肠道蠕动反射的调节,从而导致IBS患者胃肠功能紊乱的形成[12]。IBS患者内脏敏感性的升高也可能与5-HT损害迷走神经的调控能力有关[13]。有研究表明,相较于正常人,IBS患者肠道MC的数量不仅在全结肠呈现整体上升趋势,而且在单个结肠段仍显著增加[14],这一结果表明MC与IBS存在密切的关联。本实验结果显示,模型组小鼠结肠组织MC浸润程度明显高于空白组(P<0.05),说明IBS-D的发病机制可能与MC存在密切联系;与模型组比较,穴位注射组与电针组小鼠结肠组织MC浸润程度均降低,但电针组浸润程度明显低于穴位注射组(P<0.05),这表明电针治疗IBS-D的机制可能与降低MC水平有关。
综上所述,电针和穴位注射均可对IBS-D模型小鼠起到治疗作用,但两者存在效应差异,即电针的作用优于穴位注射。需要说明的是,IBS-D属于慢性疾病,临床治疗过程一般长达几个月,考虑到本实验治疗时间短暂且样本量较少,故实验结果具有一定的局限性。电针与穴位注射治疗IBS-D的作用机制仍需进一步探究。

