慢性肾脏病合并认知障碍大鼠模型的研究
黄梦兰,马瑞莺,肖宇,黄美英,黄非凡,黄芳,鲍美霜,王洁
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 广西百色市人民医院,右江民族医学院附属西南医院,广西 百色 533000;3. 右江民族医学院附属医院,广西 百色 533000)
慢性肾脏病(chronic kidney disease,CKD)是指各原因引起的肾小球滤过率<60 ml/(min·1.73 m2)或肾脏损伤>3个月的一类疾病[1]。在过去的30年里CKD在世界人口疾病死亡率排行榜上排名不断攀升,2016年排名第16位,预测2040年将上升至第5位[2],已被视为重要的全球公共卫生事件。随着人们对CKD的认识不断加深,其并发症也得到了广泛的研究。其中,神经系统并发症几乎发生在所有患有严重CKD的患者中,而早期CKD也可能合并认知功能障碍[3]。多项研究已证实肾小球滤过率越低,发生认知功能障碍的风险越高,且程度越重[4]。然而CKD合并认知功能障碍的机制尚有许多未解之谜,需要深入的探究,而构建合适的动物模型是深刻揭示CKD认知障碍发病机制的基础。但目前国内针对CKD合并认知功能障碍的动物模型研究较少。本研究拟使用两次尾静脉注射阿霉素诱导CKD,并在不同时间点进行认知功能的行为学检测,探索CKD合并认知功能障碍大鼠模型的建立,为疾病的机制研究奠定基础。
1 材料和方法
1.1 材料
1.1.1 动物 SPF级10周龄雄性Wistar大鼠,22只,体重约250 g,由长沙市天勤生物技术有限公司提供,SCXK(湘)2019-0014。实验大鼠分笼饲养于右江民族医学院实验动物中心,SYXK(桂)2017-0004,温度25°、12 h光照/黑暗交替、45%湿度的环境中,自由饮水,进食标准普通饲料。实验方案经右江民族医学院动物实验伦理委员会批准。
1.1.2 药物及主要试剂 注射用盐酸阿霉素50毫克/支(MedChemExpress公司,批号58647)。尿蛋白定量试剂盒、尿素氮试剂盒、肌酐试剂盒(南京建成)。
1.1.3 主要仪器 高速冷冻离心机(Eppendorf公司)、多功能酶标仪(德国Berthold)、全自动脱水机(德国徕卡)、LEICA RM2235切片机(德国徕卡)、全自动染色机(德国徕卡)、显微镜(NIKON Eclipse Ci)、电子天平(上海梅特勒一托利多)、Morris水迷宫(上海吉量)。
1.2 方法
1.2.1 造模与分组 取22只Wistar大鼠随机分为3组,A组:正常对照组(n=6),B组:模型10周组(n=8),C组:模型14周组(n=8)。造模方法:按4 mg/kg阿霉素予尾静脉注射1次,于2周后按相同剂量予第二次尾静脉注射。B、C组按以上方法造模,B组较C组晚4周进行;A组予等量生理盐水(见图1)。
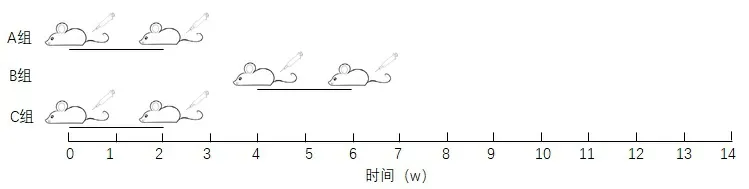
注:A组为对照组,于实验开始第0周和第2周末予生理盐水;B组于实验开始第4周和第6周末予阿霉素;C组为模型14周组,与A组同步注射阿霉素。
1.2.2 称重 各组大鼠于第一次注射阿霉素前及第二次注射阿霉素后4周、8周、12周分别测体重。
1.2.3 收集尿液 第14周末用大鼠代谢笼收集24 h尿液,记尿量,并予离心(5000 r/min,3 min,4°)取上清备用。
1.2.4 认知功能检测-Morris水迷宫
1.2.4.1 定位航行试验 将水放入水池内使平台淹没在水面以下1 cm处,水温约25℃。周围设布帘,帘上有醒目图案,将水池分为东、南、西、北4个象限,平台放在东北象限。每天大鼠被从不同的方位(东南、西南、东北、西北)放入水中同时开始记录。最长游泳时间设为90 s。如果大鼠在90 s之前到达站台,并在平台上停留10 s时结束计时。如果超过90 s大鼠仍未到达平台,将大鼠引导到平台,并在平台上停留30 s。按以上步骤共训练6 d并记录逃避潜伏期(即大鼠入水后到其第1次登台所用的时间)。
1.2.4.2 空间探索实验 实验第7天,将平台从池中取出,将大鼠从西南象限放入水中,大鼠自由游泳90 s,记录其游泳轨迹及穿越平台次数。
1.2.5 取材及标本备制 水迷宫实验结束后麻醉大鼠,摘眼球法取血,血液在室温静置1 h后离心取上清即为血清标本。取出肾脏并置入4%多聚甲醛固定24 h后,使用全自动脱水机脱水,浸蜡包埋,将包埋后的肾组织在切片机上以3 μm厚度切片备HE染色。
1.2.6 检测指标 检测各组大鼠24 h尿蛋白定量、血清肌酐及尿素氮。HE染色观察肾组织病理。
2 结果
2.1 一般情况 造模前各组大鼠的体重无显著差异,于阿霉素注射后第1~2周后B、C组大鼠均出现进食减少、消瘦、脱毛、活动能力减退、眼周及阴囊水肿的表现,部分出现腹泻或消化道出血等。B、C组大鼠造模后体重较A组明显下降(P<0.001),而B、C组间差异无统计学意义(P>0.05),见表1。期间共有4只大鼠死亡,死亡率为25%,多在注射后2~4周死亡。

表1 各组大鼠的体重变化 单位:g
2.2 24 h尿蛋白定量及血清肌酐、尿素氮测定 B、C组24 h尿蛋白定量较A组升高(P<0.001);血清肌酐和尿素氮水平也升高(P<0.05),而B、C两组间差异无统计学意义(P>0.05),见表2。
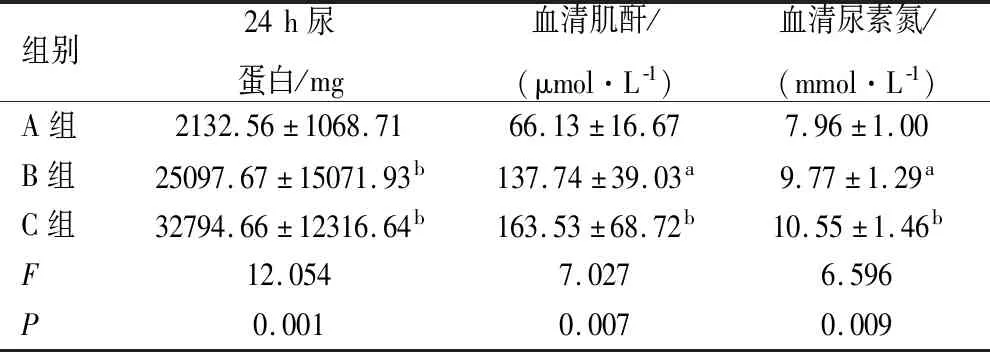
表2 各组大鼠的尿蛋白及血清肌酐、尿素氮的比较
2.3 Morris水迷宫 在定位航行实验中,第1~5天各组大鼠的潜伏期无统计学差异,第6天时C组大鼠潜伏期较A组长(P<0.05),B组与A组比较潜伏期无明显差异(P>0.05)。在空间探索实验中,C组大鼠穿台次数较A组减少(P<0.05),而B组与A组比较穿台次数无明显差异(P>0.05),见表3。
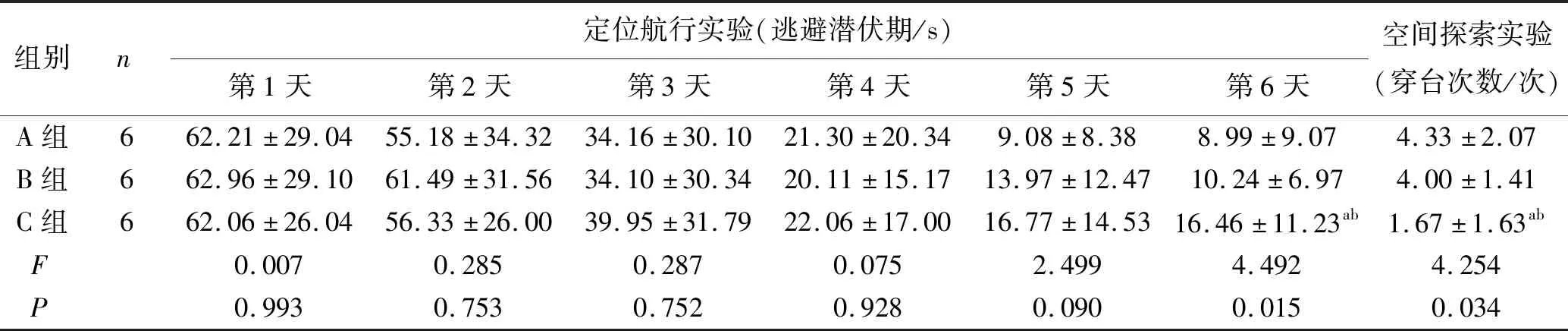
表3 Morris水迷宫实验结果
2.4 病理结果 HE染色光学显微镜可见:A组肾小球及肾小管结构完整(见图2a),B组肾组织结构异常,肾小管数量明显减少,管腔广泛扩张,大量肾小管上皮细胞数量减少,并可见大量蛋白管型,部分肾小管变性坏死(见图2b);C组除B组出现的损害外,还可见部分肾小球毛细血管袢扩张,部分肾小球萎缩,囊腔可见大量蛋白黏液;间质可见大量纤维组织增生,及炎症细胞灶性浸润(见图2c)。观察海马CA1区:A组细胞数量未见减少,排列较为整齐(见图2d);B组细胞数量有所减少,排列稍紊乱(见图2e);C组细胞数量减少,可见部分神经元变性,胞体固缩深染(见图2f)。
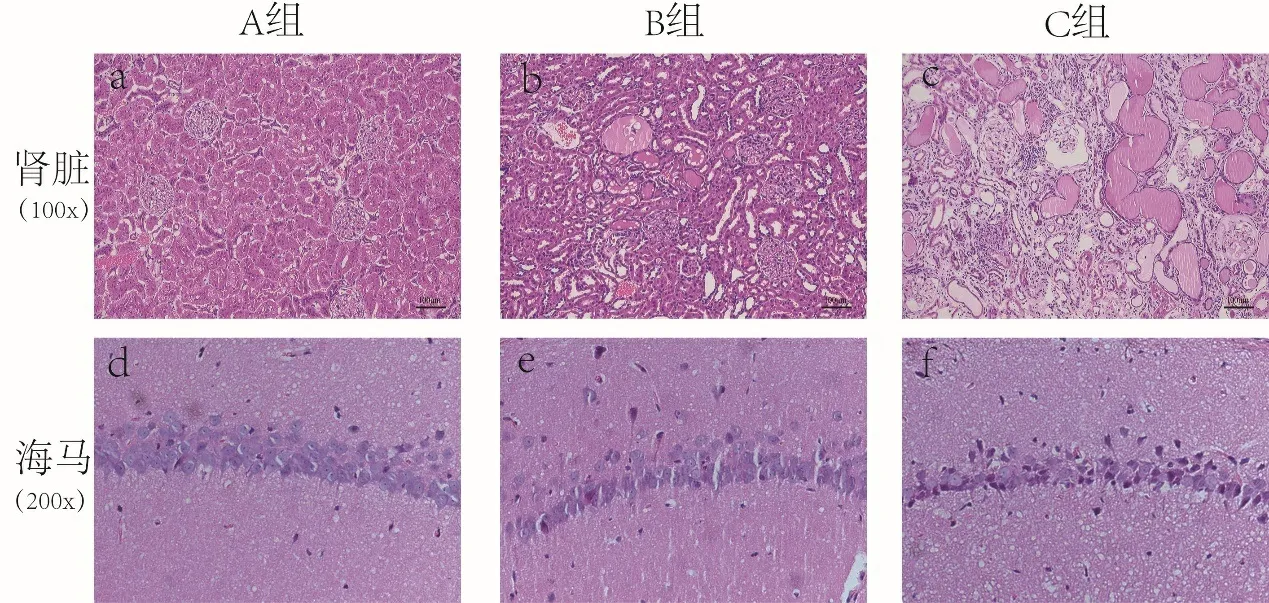
图2 各组大鼠肾脏及海马CA1区的HE染色
3 讨论
认知功能障碍在CKD中具有较高发病率,临床中常依赖于蒙特利尔认知评估量表等各种量表来评估认知功能[5]。但在实验动物方面,尚未有明确指标验证模型的成功,多数研究通过Morris水迷宫等行为学实验评估组间差异的显著性来判断有无认知功能障碍[6-7]。本文旨在通过建立肾脏损害模型,研究其并发症——认知功能障碍出现的时间点。建立CKD小鼠模型常用的有物理法,包括肾大部分切除法(约5/6)、肾动脉分支部分结扎方法、单侧输尿管结扎法[8];化学法,药物包括腺嘌呤、阿霉素、顺铂[9-10];基因工程法,包括特定基因敲除和基因干扰等。基于其他造模方式对技术水平的高要求,故本研究选用阿霉素诱导大鼠肾脏损害。鉴于阿霉素的毒副作用,其诱导的肾病在疾病早期与临床存在一定差异,但当肾脏损害到一定程度——大量蛋白尿、血清肌酐及尿素氮升高、肾脏病理改变等时,其与人类CKD具有显著相似性[11-12]。阿霉素肾病的损害程度与注射剂量呈正相关,给药剂量多控制在10 mg/kg以内,且较低剂量阿霉素多次注射不仅能造成持续的肾损伤且具有较低死亡率和更高稳定性的优点[13-14]。故本研究选用间隔2周两次尾静脉注射阿霉素的方法,结果显示模型组大鼠均出现了大量蛋白尿、血清肌酐及尿素氮升高、慢性肾炎的病理改变,与其他以阿霉素造模的研究所得肾病模型相类似[15-16]。阿霉素通过激活氧化应激、炎症反应、细胞凋亡和肾脏纤维化促使肾脏病变,其病变发展过程与临床肾病的发展规律相似[17-18]。而C组肾功能损害较B组稍重,这与肾脏损害持续进展有关。认知功能包括记忆力、计算力等。其中海马是记忆功能形成和维持不可或缺的重要部分,尤其是CA1区的细胞结构及蛋白变化[19]。当海马CA1区的细胞形态发生凋亡、萎缩时,实验鼠显示出记忆功能受损[20]。实验中海马组织HE染色可见模型海马组织CA1区细胞均有损害,但C组更为明显,表现为细胞数量减少,排列稍紊乱,部分神经元变性,胞体固缩深染等。Morris水迷宫利用动物厌恶水环境的特性,强迫动物游泳并从水中逃跑来激发其学习记忆能力,用于评估啮齿动物的空间探索和学习记忆能力[21]。本研究中C组大鼠的潜伏期延长且穿台次数减少,可见C组大鼠的空间探索和记忆功能减退。Fujisaki K等[7]通过5/6肾脏切除的方法制备CKD小鼠模型,发现在放射臂水迷宫CKD 8周小鼠的空间记忆较CKD 4周的减退,与本研究的结果相似。虽本研究的周期相对较长,这可能与动物的种属和诱导肾脏损伤的周期不同有关,但是本研究死亡率低,成本低,技术难度不高,利于实施。有研究表明,CKD患者合并认知障碍的程度与肾功能衰竭程度密切相关[22]。肾脏是清除β淀粉样蛋白的主要器官,肾脏受损加重脑内β淀粉样蛋白的沉积,从而加重认知缺陷[23]。而且,肾功能受损会导致脑微血管系统的改变,从而影响大脑的健康[24]。多数研究已表明尿毒症毒素及血管病变是导致神经系统损伤的主要因素[25]。
综上所述,本研究通过尾静脉注射阿霉素建立CKD合并认知障碍的大鼠模型,该模型简便易行,死亡率低,且确定了认知功能出现明显障碍的时间点,为进一步探究CKD合并认知障碍的机制研究奠定基础。
声明: 本研究不存在任何利益冲突。

