基于生信分析ANKRD26在肝细胞癌中的表达、预后及与化学物质的相互作用
况云舒,詹雪冰,罗倩,董芳媛,孙恩涛,陈冰
(1. 皖南医学院病理教研室,安徽 芜湖 241002;2. 皖南医学院检验学院,安徽 芜湖 241002)
原发性肝癌(hepatocellular carcinoma,HCC)是全球恶性肿瘤的第三大死亡原因,每年造成近74.5万人死亡[1]。它通常发生在慢性肝病的背景下,尤其是肝硬化,因此限制了手术切除的可行性[2]。虽然早期局部治疗方法有所改进,但晚期患者的预后仍然很差。因此急需可靠的生物标志物来预测HCC患者的预后并指导治疗。利用数据库挖掘寻找有效的生物标志物并进行功能验证已成为临床研究的热点之一。
ANKRD26编码的蛋白质,含有N末端的锚蛋白重复区域,在蛋白质相互作用中起锚连作用[3]。该基因突变与常染色体显性遗传性血小板减少症-2有关。在7号、10号、13号和16号染色体上发现了该基因的假基因,已发现该基因编码不同亚型的多种转录变体[4]。目前该基因的研究主要集中于血液系统疾病,如常染色体显性遗传性血小板减少症的研究及脂肪代谢的研究,而在肝癌中的研究报道较少[5-6]。对其在肝癌预后中的功能的探究可能为我们提供新的生物标志物。
本研究通过TCGA数据库中的肝癌资料分析ANKRD26 mRNA在肝细胞癌中的表达情况,探讨ANKRD26 mRNA表达量与生存预后之间的关系,并结合临床资料构建预后模型,同时,通过Human Protein Atlas(HPA)数据库观察ANKRD26蛋白的表达情况,并利用String数据库分析与其相互作用的蛋白;此外通过CTD数据库[7]探索与ANKRD26相互作用的化学物质,从而为肝细胞癌患者的预后评估和临床诊疗提供新思路。
1 资料与方法
1.1 ANKRD26 mRNA在33种肿瘤的表达和临床资料整理 从TCGA数据库(https://portal.gdc.cancer.gov/)下载33种肿瘤的转录组数据和肝癌的临床资料。利用Perl语言整理数据和提取ANKRD26 mRNA在33种肿瘤的表达量。再利用R语言中的ggpubr包生成ANKRD26 mRNA在33种肿瘤的表达的箱式图。同时,利用Perl语言提取有完整临床资料的肝癌病例234例,男性160例,女性74例,年龄17~85岁,平均年龄(57.05±13.24)岁。
1.2 基于Cox模型的单因素与多因素分析 通过R语言利用比例风险回归模型(proportional hazards model,简称Cox模型)进行单因素与多因素分析。提取临床资料中的生存时间和生存状态、分级、分期及T、M、N数据并与ANKRD26 mRNA结合在一起。利用R包(survival包)进行单因素、多因素独立预后分析并汇制森林图。
1.3 预后模型的构建生存曲线图绘制 将单因素分析结果中P<0.05的ANKRD26的表达量、STAGE、T、M再次进行Cox回归分析,并根据ANKRD26的表达量和N值计算的风险分数,且依据风险分数中值将234例肝癌病例分为低风险组与高风险组,并利用R包(survival包和survminer包)作生存曲线图。
1.4 ROC曲线图 基于上述风险公式与风险评分利用R包(survival ROC包)分别绘制1、3、5年的ROC曲线图。
1.5 HumanProteinAtlas数据库 HPA数据库(https://www.proteinatlas.org)提供24000种人类蛋白质的组织和细胞分布信息,并免费提供公众查询。搜索框搜索基因“ANKRD26”点选:①tissue;②cell;③pathology选项卡收集整理相关数据。
1.6 KaplanMeier-plotter数据库 KaplanMeier-plotter数据库(http://kmplot.com/analysis/)筛选方式:①条目:Liver cancer;②Genesymobol:ANKRD26;③分组:Auto select best cut off;④Survival:OS。
1.7 String数据库 String数据库(https://www.string-db.org/)输入“ANKRD26”:①物种:Homo sapiens;②置信度:medium confidence 0.400;③相互作用最大数:10。
1.8 The Comparative Toxicogenomics Database(CTD)数据库 CTD数据库(http://ctdbase.org/)筛选方式:①选择Chemical-Gene Interaction Query条目;②Chemical:equals空白;③Chemical-gene interaction:ANY;④Gene:equals,在弹出窗口输入ANKRD26;⑤Organism:Homo sapiens。

2 结果
2.1 ANKRD26 mRNA在多种肿瘤组织中的表达情况 ANKRD26 mRNA在多种肿瘤中均有表达,与正常组织比较,其在乳腺癌、胆管癌、结肠癌、多形性胶质母细胞瘤、肝细胞癌、肺腺癌、肺鳞癌、胃癌、甲状腺癌、子宫内膜癌组织中表达有差异性(P<0.05);其中,与正常组织比较,肝癌组织中呈高表达(P<0.01),见图1。

注:ACC:肾上腺皮质癌;BLCA:膀胱尿路上皮癌;BRCA:乳腺浸润癌;CESC:宫颈鳞癌和腺癌;CHOL:胆管癌;COAD:结肠癌;DLBC:弥漫性大B细胞淋巴瘤;ESCA:食管癌;GBM:多形性胶质母细胞瘤;HNSC:头颈鳞状细胞癌;KICH:肾嫌色细胞癌;KIRC:肾透明细胞癌;KIRP:肾乳头状细胞癌;LAML:急性髓细胞样白血病;LGG:脑低级别胶质瘤;LIHC:肝细胞癌;LUAD:肺腺癌;LUSC:肺鳞癌; MESO:间皮瘤;OV:卵巢浆液性囊腺癌;PAAD:胰腺癌;PCPG:嗜铬细胞瘤和副神经节瘤;PRAD:前列腺癌;READ:直肠腺癌;SARC:肉瘤;SKCM:皮肤黑色素瘤;STAD:胃癌;TGCT:睾丸癌;THCA:甲状腺癌;THYM:胸腺癌;UCEC:子宫内膜癌;UCS:子宫癌内瘤;UVM:葡萄膜黑色素瘤;*P<0.05,***P<0.01。
2.2 Cox回归模型单因素与多因素分析结果 单因素分析结果显示,ANKRD26 mRNA的表达量、临床分期、肿瘤的大小、有无远处转移是独立的预后因子(P<0.05);多因素分析结果显示ANKRD26 mRNA的表达量是独立的预后因子(P<0.05),见图2。

图2 Cox回归模型单因素与多因素分析图
2.3 ANKRD26 mRNA的表达与临床病理资料的相关性 结果显示,ANKRD26 mRNA的表达在年龄≤60岁组和>60岁组差异有统计学意义(P<0.05);不同的分级水平有一定差异性,其中分级ANKRD26 mRNA的表达分级中StageⅠ和Ⅲ、StageⅡ和Ⅲ差异有统计学意义(P<0.05),见图3。

图3 ANKRD26 mRNA的表达与临床病理资料的相关性
2.4 风险分组及生存分析 基于ANKRD26 mRNA的表达量及N值,计算风险分数,并根据风险分数的中位值,将234例肝癌患者分为高风险组及低风险组,生存曲线提示低风险组具有更长的生存时间(P<0.05),见图4。

图4 高风险组与低风险组生存时间比较
2.5 基于风险分组的ROC曲线 结果显示,结合ANKRD26 mRNA的表达量及N值的风险分组,AUC值均>0.7,对于患者的预后评估有参考价值,见图5。
2.6 KaplanMeier-plotter数据库ANKRD26在肝癌患者中的生存曲线 基于KaplanMeier-plotter数据库,分析364例肝细胞癌患者的生存资料,显示ANKRD26表达水平对预后有显著影响[HR=1.71(1.2~2.43),P=0.0024]。ANKRD26表达量高的肝癌患者,总体生存时间相对更短,见图6。

注:A:1年;B:3年;C:5年。

图6 ANKRD26表达量与患者总体生存率生存曲线
2.7 ANKRD26在肝癌组织中蛋白层面的表达情况 对HPA数据库中收集的免疫组织化学图片进行分析。结果显示ANKRD26在肝细胞癌组织中的染色强度为中等,定位于细胞质或细胞膜上,而其在正常肝组织中染色强度表现较弱,见图7。

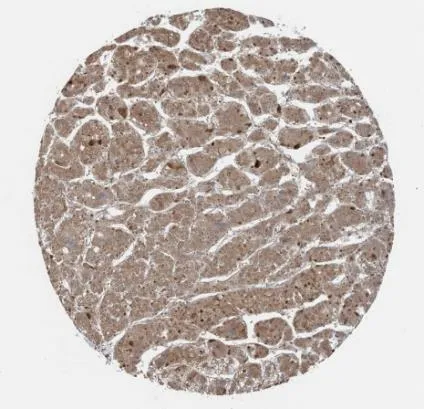
图7 ANKRD26蛋白在肝癌中的表达情况
2.8 ANKRD26蛋白在肝癌组织中的分布情况 免疫荧光图片中经选择“Anti-body”、“ER”、“Nucleus”选项,显示ANKRD26主要分布于细胞质中,见图8。


图8 ANKRD26蛋白主要分布于胞质
2.9 与ANKRD26相互作用的蛋白 相互作用的有:UBAP1、MASTL、GAS7、ETV6、SRP72、SBDS、SMC1B、SMC2、SMC4、SMC3。功能上主要有参与人体造血相关的有MASTL、GAS7、ETV6、SBDS,与染色质结构维持有关的蛋白SMC1B、SMC2、SMC4、SMC3,参与信号转导的SRP72以及参与蛋白质降解的UBAP1,见图9。

图9 与ANKRD26相互作用的蛋白PPI图
2.10 与ANKRD26有相互作用的化学物质 删除重复的化学物质,共有26种化学物质与ANKRD26有相互作用,有抑制ANKRD26表达作用的为benzamide、Aflatoxin B1、Atrazine、benzo(e)pyrene、butyraldehyde、Carbamazepine、Copper Sulfate、Cyclosporine、dicrotophos、dorsomorphin、Doxorubicin、K7174、Methapyrilene、methylmercuric chloride、p-Chloromercuribenzoic Acid、pentanal、perfluorooctane sulfonic acid、Plant Extracts、potassium chromate(VI),有促进ANKRD26表达作用的为Acetaminophen、Antirheumatic Agents、epigallocatechin gallate、pirinixic acid、Silicon Dioxide、Sunitinib、Vorinostat,见图10。
3 讨论
随着基因组学的快速发展,可以根据有效、特异性高且敏感的分子生物学标志物将患者区分为不同类型,再根据不同的类型可以给予患者精准治疗,提高了患者的生存率,因此,寻找特异性、敏感性的生物学标志物一直是研究的热点[8-9]。利用AFP或APFmRNA检测有可能预测肝癌的浸润和转移,但对于AFP阴性者,目前尚无可靠敏感的预测指标。因此,积极寻找高敏感且与预后临床指标密切相关的生物学标志物可能为AFP阴性者提供有效地预测。ANKRD26基因最初被鉴定为灵长类动物特定的祖先ANKRD30A和POTE基因家族,它映射到10p12.1染色体,编码192 kDa的蛋白质,该蛋白质位于质膜的内部附近[10]。ANKRD26蛋白包含两个保守结构域:锚蛋白重复序列(位于74-199位氨基酸)和螺旋区,已知这两个域介导蛋白质-蛋白质相互作用,表明其可能起衔接蛋白的作用[11]。目前,ANKRD26相关研究仍局限在血液相关及脂肪代谢相关的疾病为主[12]。目前对于其在肝细胞癌中的研究则罕见报道。

注:绿色为抑制,红色为促进。
本研究中基于Cox回归模型进行独立的单因素与多因素分析均显示,ANKRD26是独立的预后因子,提示ANKRD26表达量的检测可作为肝癌患者预后的重要指标。而且结合临床上的淋巴结转移情况进行分组后,显示ANKRD26高表达和发生淋巴结转移的肝细胞患者可能预后较差。而且利用KaplanMeier-plotter数据库的生存曲线亦验证了ANKRD26高表达是肝细胞癌患者总生存期更短。ANKRD26的表达在年龄上具有差异,提示对于>60岁的患者更应检测ANKRD26的表达;而且,分级中StageⅠ和Ⅲ、StageⅡ和Ⅲ亦有差异,提示ANKRD26的表达可作为临床分组的参考指标。
通过HPA等数据库挖掘,发现ANKRD26在肝细胞癌组织中表达量显著升高,提示其可能是促癌基因,若能开发出抑制ANKRD26表达的药物,对肝癌的治疗可能有新的改观。
与ANKRD26相互作用蛋白主要是造血、信号转导与蛋白降解相关的蛋白。所以ANKRD26可能参与了造血系统相关疾病的发生,因而目前大多数研究集中在这一方面。但其参与蛋白降解以及细胞信号转导等生物过程,目前报道较少,因此研究其中具体机制可能有助于理解其在肿瘤中的分子机制,为其在肝细胞癌的研究提供了新的方向。
本研究结果显示,ANKRD26蛋白主要定位于胞质中,且在肝细胞癌组织的染色强度与正常肝组织染色强度有着明显的差异。依据364例患者生存分析结果,显示ANKRD26表达量与肝细胞癌患者总体生存时间具有明显的相关性,提示后续可进一步研究与开发,根据ANKRD26表达量的水平来判断肝癌患者的预后。
我们探索ANKRD26和现有化学物质之间相互作用的潜在信息后,发现多种化学物质可能会影响其表达水平。其中起到促进ANKRD26表达的有7种,肝细胞癌的患者应避免接触或应用这7种化学物质/药物。而起到抑制ANKRD26表达作用的有19种,其中苯并芘、黄曲霉素B1等是我们已经认识到的引起肿瘤的危险因素,因此在开发药物时,不能只考虑到对ANKRD26的抑制作用,更需要从长远的角度来衡量患者的受益情况。所以更需要注意的是,有待进一步的实验来支持具有ANKRD26过度表达的肝细胞癌患者能否受益于ANKRD26的被抑制;而且具体的药物机制和毒理,仍需大量的生物学实验来验证。综上所述,ANKRD26在肝细胞癌组织中高表达,且与患者的生存有一定的关系,因此,进一步深入研究可能为患者预后评估提供新的检测指标。但其和AFP表达有无相关性及其在生物学功能的研究还有待于从临床标本、细胞水平、动物水平等方面进一步研究。同时,阐明ANKRD26蛋白在肝细胞癌的发生中的分子作用机制,也会为临床的诊疗提供新的思路和新的分子生物学标志。

