基于Box-Behnken设计-响应面法与质量综合评价优化经典名方桃红四物汤煎煮工艺
何 瑶,江华娟,成颜芬,杜克群,李敏敏,杨青波,王振中,傅超美,段 毅
基于Box-Behnken设计-响应面法与质量综合评价优化经典名方桃红四物汤煎煮工艺
何 瑶1,江华娟1,成颜芬1,杜克群1,李敏敏1,杨青波2,王振中3, 4,傅超美1*,段 毅2*
1.西南特色中药资源国家重点实验室,成都中医药大学药学院,四川 成都 611137 2.贵州益佰制药股份有限公司,贵州 贵阳 550000 3.江苏康缘药业股份有限公司,江苏 连云港 222001 4.中药制剂过程新技术国家重点实验室,江苏 连云港 222001
遵古优化和科学评价桃红四物汤(Taohong Siwu Decoction,TSD)的煎煮工艺,为其经典名方中药复方制剂研究奠定基础。以指纹图谱概貌结合多指标定量为综合评价,采用Box-Behnken设计-响应面设计对加水量、浸泡时间、煎煮时间、煎煮次数进行优化。指纹图谱研究采用SunFire-C18色谱柱(150 mm×3.0 mm,3.5 μm),流动相为乙腈-0.5%磷酸水溶液,体积流量为0.2 mL/min,柱温为25 ℃,检测波长为230 nm;建立HPLC指纹图谱,对色谱信息进行主成分分析,进一步建立UPLC多波长检测方法测定6个关键质控成分含量,计算各样品综合得分,通过响应面法进行工艺优化。建立了29个试验号TSD UPLC指纹图谱,选择16个共有峰,指认出地黄苷D、苦杏仁苷、羟基红花黄色素A、芍药苷、阿魏酸、藁本内酯共6个成分。主成分分析提取出4个主成分,综合得分结果显示15号工艺为最佳工艺。含量测定显示,地黄苷D、苦杏仁苷、芍药苷、阿魏酸、藁本内酯、羟基红花黄色素A 6种成分线性关系良好,综合得分结果显示,15号工艺为最佳工艺。进一步根据回归模型拟合,得到最优工艺为加水量9.90倍、浸泡时间0.58 h、煎煮时间1.19 h、煎煮次数1.60次,最终确定TSD煎煮工艺为加10倍量水,浸泡0.5 h,煎煮2次,每次1 h。指纹图谱质量概貌结合关键质控成分可作为TSD制备工艺的质量评控方法,得出的最佳煎煮工艺稳定可行,可用于经典名方TSD复方制剂进一步研究开发。
桃红四物汤;经典名方;煎煮工艺;指纹图谱;Box-Behnken设计-响应面法;质量综合评价;主成分分析;HPLC;UPLC;地黄苷D;苦杏仁苷;羟基红花黄色素A;芍药苷;阿魏酸;藁本内酯
桃红四物汤(Taohong Siwu Decoction,TSD)出自《妇科冰鉴》(清•柴得华),是国家公布的第一批经典名方目录方剂,也是2020年首批公布“古代经典名方关键信息”的7个方剂之一。关键信息明确,该方原方为生地三钱(酒洗)、当归四钱(酒洗)、白芍钱五分(酒炒)、川芎一钱、桃仁十四粒(去皮尖研泥)、红花一钱(酒洗),服用方法为水煎服,功效养血、活血、逐瘀,主治血虚血瘀证[1-3]。基于其活血逐瘀功效,该方剂在现代临床上广泛用于妇科、骨科、内科,治疗原发性痛经的有效率在90%以上,经常用于治疗骨折、术后血栓和(或)凝血等,以及TSD或单用、或与中西药合用,治疗冠心病、心绞痛、偏头痛、脑卒中、面神经炎、糖尿病及其并发症等多种疾病,具有确切的临床疗效和较大的临床价值[4-9],将其开发为中药经典名方制剂有较大的临床需求。
在经典名方制剂研发中,遵古制备和构建质量控制体系是两个核心要素。关键信息中公布TSD的服用方法为“水煎温服”,没有明确提及煎煮次数、加水量等参数,在研究中可根据卫生部、国家中医药管理局《医疗机构中药煎药室管理规范》(国中医药发〔2009〕3号)相关规定对重要工艺参数进行优化确定。Box-Behnken设计-响应面法(Box- Behnken design-response surface methodology,BBD-RSM)是采用多元回归方程拟合因素和效应值之间的函数关系,通过对其分析来寻求最佳工艺参数,是解决多变量问题的一种有效统计方法,广泛应用于多因素优化试验。BBD-RSM弥补了传统方法在反映非线性关系中的不足,多因素多水平之间的关系通过数学模型建立可更稳定准确,在研究复杂非线性系统中提供了有利的方法[10-12]。而中药复方具有多成分、多靶点、多层次、多途径、整体作用的特点,少数几个指标成分难以科学地评价制剂工艺优劣和制剂质量,进而得到与方剂功能主治相关的最优提取工艺,以保障临床用药的有效性和安全性。通过应用现代分析技术构建中药复方的指纹图谱和指标成分含量测定,从定性和定量2个角度综合优化中药复方工艺过程和关键参数,是建立科学合理中药制备工艺体系的重要策略[13]。
课题组基于前期对基于质量标志物辨识原则和TSD制备过程关键质控指标的辨识并结合成分可测性[14-15],筛选得到6个成分作为TSD的质量评价指标,分别为地黄苷D、阿魏酸、芍药苷、羟基红花黄色素A、苦杏仁苷、藁本内酯。因此,本实验在BBD-RSM设计的基础上,以指纹图谱概貌、关键成分含量测定结果为评价指标,对TSD煎煮工艺进行试验设计和参数优化,可为其后续中药经典名方复方制剂研究提供基础。
1 仪器与材料
1.1 仪器
Thermo Dionex ULtiMate 3000高效液相色谱系统,包括7311959四元梯度泵、8153411进样器、6021984柱温箱、8155073 DAD检测器、7313241在线脱气机和Chromelon Console工作站,赛默飞世尔科技有限公司;DL-720D型数控超声波清洗器,上海之信仪器有限公司;FTS-10A型液体加热器,潮州市一壶百饮电器实业有限公司;N-1100型旋转蒸发仪,上海泉杰仪器有限公司;UPK-I-10T型优普系列超纯水器,四川优普超纯科技有限公司;SHB-IIIA型循环水式真空泵,北京中兴伟业有限公司;DD5型台式大容量低速离心机,湖南赫西仪器装备有限公司。
1.2 药材
地黄(批号1904138,产地河南)、当归(批号1901137,产地甘肃)、白芍(批号1812034,产地安徽)、川芎(批号1901002,产地四川)、桃仁(批号1905004,产地北京)、红花(批号2003015,产地新疆)6味药材购自道地产区,经成都中医药大学中药鉴定专业裴瑾教授鉴定,红花为菊科红花属植物红花L.的干燥花,桃仁为蔷薇科桃属植物桃(L.) Batsch的干燥成熟种子,地黄为玄参科地黄属植物地黄Libosch.的新鲜或干燥块根,白芍为毛茛科芍药属植物芍药Pall.的干燥根,川芎为伞形科藁本属植物川芎Hort.的干燥根茎,当归为伞形科当归属植物当归(Oliv.) Diels的干燥根,经检验均符合《中国药典》2020年版要求。上述药材经实验室炮制得到酒炙地黄、酒炙当归、酒炙红花、川芎、燀桃仁、酒炙白芍。
1.3 对照品及试剂
对照品地黄苷D(批号wkq20051709)、阿魏酸(批号wkq19030705)、芍药苷(批号wkq19090808)、羟基红花黄色素A(批号wkq20061509)、苦杏仁苷(批号wkq20061207)、藁本内酯(批号wkq20012006)购自四川维克奇生物科技有限公司。色谱纯磷酸(批号2019122601)、乙腈(批号WXBC8826V)、甲醇(批号WXBC9153V)购自西格玛奥德里奇贸易有限公司。
2 方法和结果
2.1 供试品和对照品溶液制备
2.1.1 供试品溶液 按古籍记载处方的2.68倍量,称取酒炙地黄30 g、酒炙当归40 g、酒炒白芍15 g、川芎10 g、酒炙红花10 g、燀桃仁10 g,各试验号样品按表1因素水平进行煎煮,合并煎液,定容到2300 mL(饮片量0.05 g/mL),取10 mL,4000 r/min离心10 min,取上清液过0.22 μm微孔滤膜,即得供试品溶液。
2.1.2 对照品溶液 分别精密称定芍药苷、苦杏仁苷对照品15.795、6.435 mg,加入甲醇定容到5 mL,溶解制成质量浓度分别为3.195、1.287 mg/mL的单一对照品储备溶液;分别精密称定地黄苷D、阿魏酸、羟基红花黄色素A、藁本内酯对照品5.035、2.625、5.650、5.000 mg,加入甲醇定容到10 mL,溶解制成质量浓度分别为503.5、262.5、565.0、500.0 μg/mL的单一对照品储备溶液。
2.2 BBD-RSM因素和水平设计
在单因素实验的基础上,并参考卫生部、国家中医药管理局《医疗机构中药煎药室管理规范》(国中医药发〔2009〕3号)相关规定,分别对浸泡时间、加水量、提取时间、提取次数进行单因素实验,选取加水量(A)、浸泡时间(B)、煎煮时间(C)、煎煮次数(D)为考察因素,因素水平见表1,得到29个试验样品。
2.3 TSD指纹图谱概貌评价研究
2.3.1 色谱条件 色谱柱为SunFire-C18色谱柱(150 mm×3.0 mm,3.5 μm);流动相为乙腈-0.5%磷酸水溶液,梯度洗脱:0~10 min,5%~17%乙腈;10~35 min,17%~22%乙腈;35~40 min,22%~65%乙腈;40~45 min,65%~80%乙腈;45~50 min,80%乙腈;体积流量为0.2 mL/min;柱温为25 ℃;进样量为10 μL;230 nm波长检测。精密吸取空白溶液甲醇、混合对照品溶液和供试品溶液各10 μL,注入液相色谱仪,测定,记录色谱图。
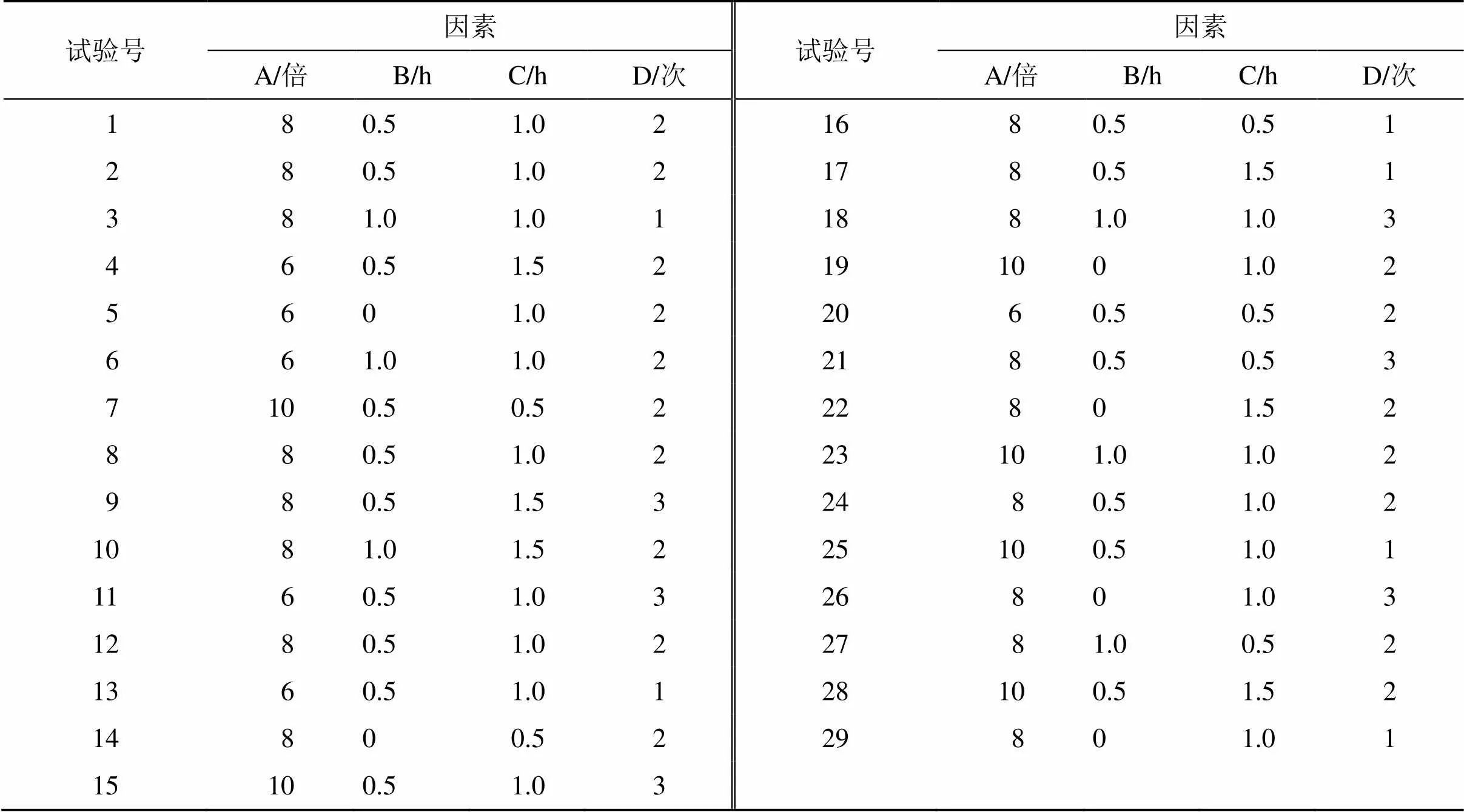
表1 TSD煎煮工艺响应面优化试验设计
2.3.2 精密度试验 取试验号1样品,按照“2.1”项下方法制得的同一供试品溶液,按照“2.3.1”项下色谱条件进行检测,连续进样6次,记录指纹图谱,选择出峰稳定、响应值高、峰面积较大的阿魏酸为参照峰,各共有峰相对保留时间和相对峰面积的RSD均小于2%,表明本方法精密度良好。
2.3.3 稳定性试验 取试验号1样品,按照“2.1”项下方法制得的同一供试品溶液,分别于0、4、8、12、16、24、48 h进行检测,记录指纹图谱,以阿魏酸为参照峰,各共有峰相对保留时间和相对峰面积的RSD均小于2%,表明供试品溶液在48 h内稳定性良好。
2.3.4 重复性试验 取试验号1样品,按照“2.1”项下方法平行制备供试品溶液6份,记录指纹图谱,以阿魏酸为参照峰,各共有峰相对保留时间和相对峰面积RSD均小于3%,表明方法重复性良好。
2.3.5 指纹图谱分析 经各对照品溶液色谱图的保留时间比对,选择了特征明显、重复性好、稳定性好的16个色谱峰为共有峰,16个色谱峰中指认出6个成分,分别是1号峰(地黄苷D)、9号峰(苦杏仁苷)、11号峰(羟基红花黄色素A)、12号峰(芍药苷)、13号峰(阿魏酸)、15号峰(藁本内酯)。记录各样品色谱图及峰面积信号值,分析不同煎煮工艺过程中16个共有峰相对峰面积变化过程,结果见图1和表2。
2.3.6 指纹信息主成分分析(principal component analysis,PCA) 将指纹图谱的16个共有峰峰面积分别导入SPSS 20.0软件,进行PCA,结果见表3和图2。主成分特征值、累积方差贡献率以特征 值>1为提取标准,共提取出4个主成分,得到主成分的累积方差贡献率79.069%,故选取前4个主成分进行评价,它代表了16个成分量的79.069%的信息量,可较好地反映总体成分信息。在4个主成分中,特征值较大的是主成分1,其累积方差贡献率达52.903%,是信息量较全面的指标。从表4中可以看出根据因子载荷矩阵,在主成分1中,除了5、14、1、9、7号色谱峰以外,其余11个成分的因子载荷非常接近,均是主成分1的重要贡献成分,说明主成分1很好地表达了TSD多成分物质群。
用计算得到的主成分对29个样品进行得分计算,将得到的特征向量与标准化后的数据相乘,得到主成分表达式,再以每个主成分所对应的特征值占提取主成分总的特征值之和的比例作为权重得到主成分综合模型,根据主成分综合模型计算29个样品的主成分得分及综合得分值,如表5所示。综合得分结果显示,15号工艺为最佳工艺。
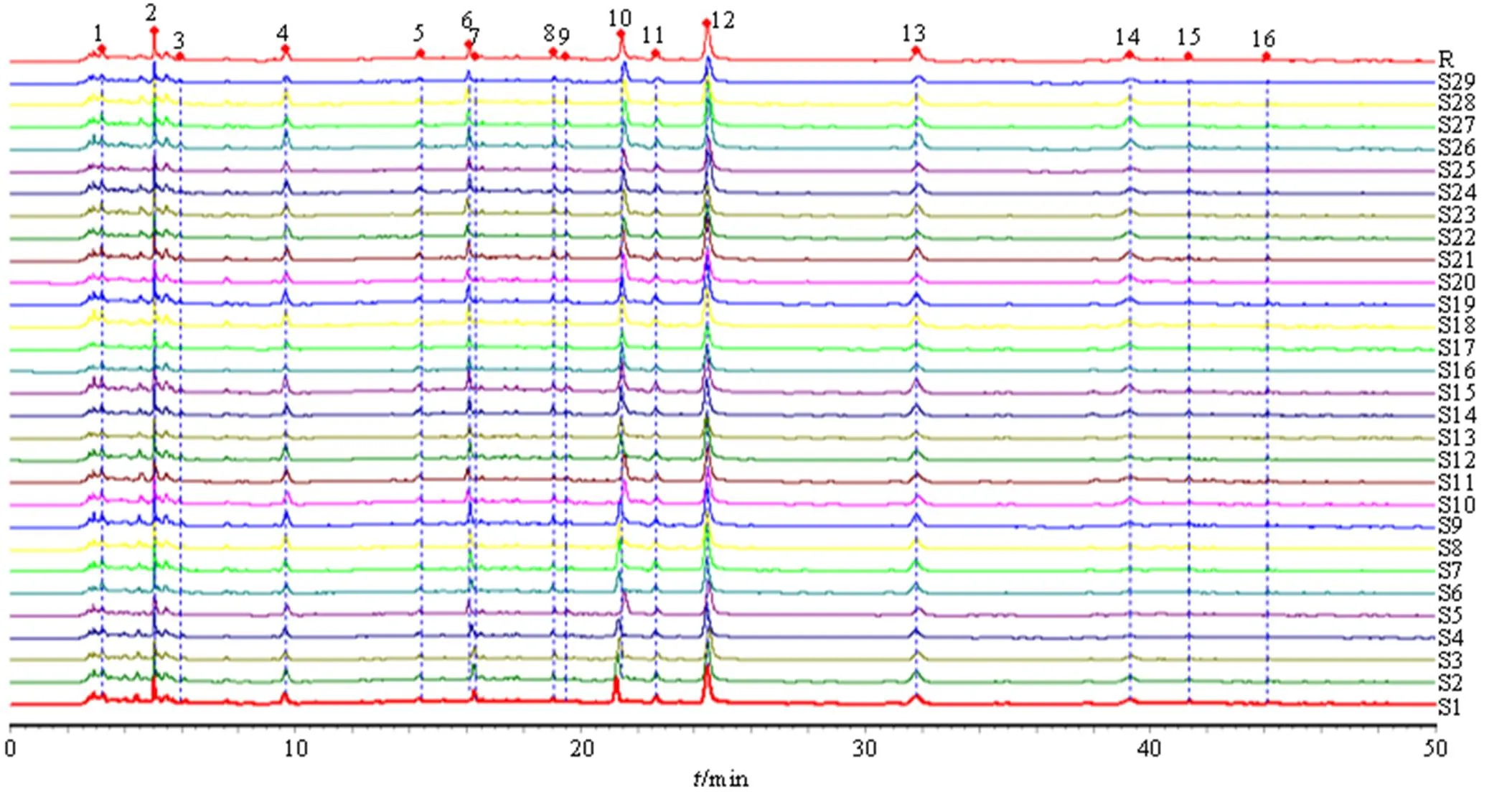
1-地黄苷D 9-苦杏仁苷 11-羟基红花黄色素A 12-芍药苷 13-阿魏酸 15-藁本内酯
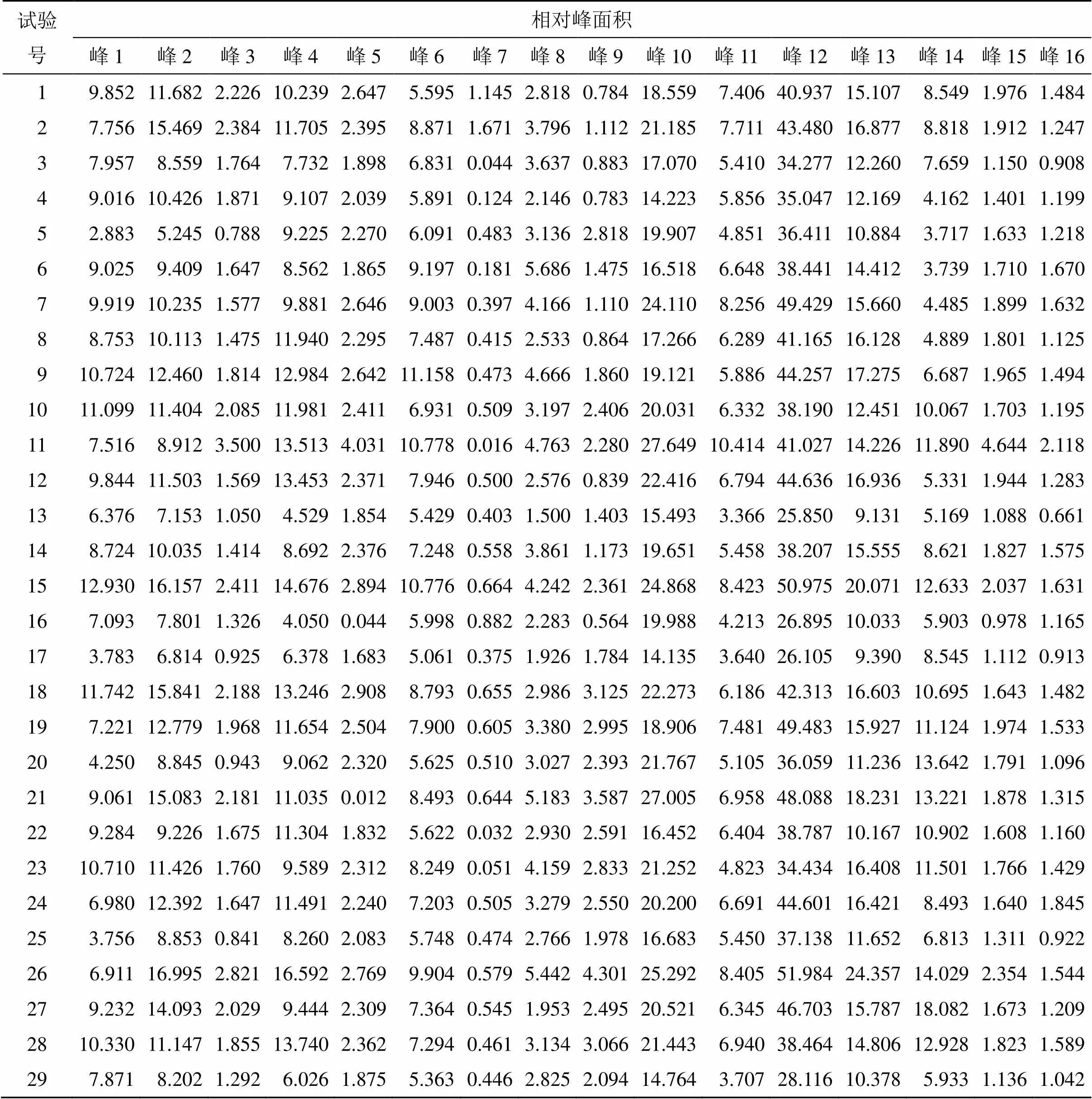
表2 不同煎煮工艺TSD样品色谱峰峰面积
2.4 TSD多成分含量测定评价研究
2.4.1 色谱条件 按“2.3.1”项下描述色谱条件,分别在210 nm(地黄苷D和苦杏仁苷)、230 nm(芍药苷)、328 nm(阿魏酸和藁本内酯)、403 nm(羟基红花黄色素A)波长下检测。
2.4.2 系统适应性试验 分别吸取混合对照品溶液、供试品溶液各10 μL,注入液相色谱仪,按“2.4.1”项下色谱条件进样测定,6种成分可达基线分离,各吸收峰的理论塔板数均不低于5000,分离度大于1.5,色谱图见图3。
2.4.3 线性关系考察 分别精密量取“2.1”项下制备的对照品储备液各1 mL,混合定容至10 mL,制备得到混合对照品溶液母液,用甲醇通过2倍稀释法分别稀释2、4、8、16、32倍,制得各质量浓度的混合对照品溶液,分别按照“2.4.1”项下色谱条件进行测定,以质控浓度为横坐标(),峰面积为纵坐标()进行线性回归,得到回归方程、相关系数()和线性范围分别为芍药苷=0.416 9+0.410 5,=0.999 8,线性范围9.871 9~315.900 0 μg/mL;地黄苷D=0.055 3-0.013 1,=0.993 8,线性范围1.573 4~50.350 0 μg/mL;阿魏酸=1.056 4-0.851 5,=0.999 1,线性范围0.820 3~26.250 0 μg/mL;羟基红花黄色素A=0.566 1+0.342 3,=0.999 5,线性范围1.765 6~56.500 0 μg/mL;苦杏仁苷=0.426 9+0.051 7,=0.999 9,线性范围4.021 9~128.700 0 μg/mL;藁本内酯=0.530+0.011 3,=0.999 7,线性范围1.562 5~50.000 0 μg/mL。

表3 主成分因子的特征值和方差贡献率
*提取平方和载入的主成分
*select the principal component loaded by the sum of squares
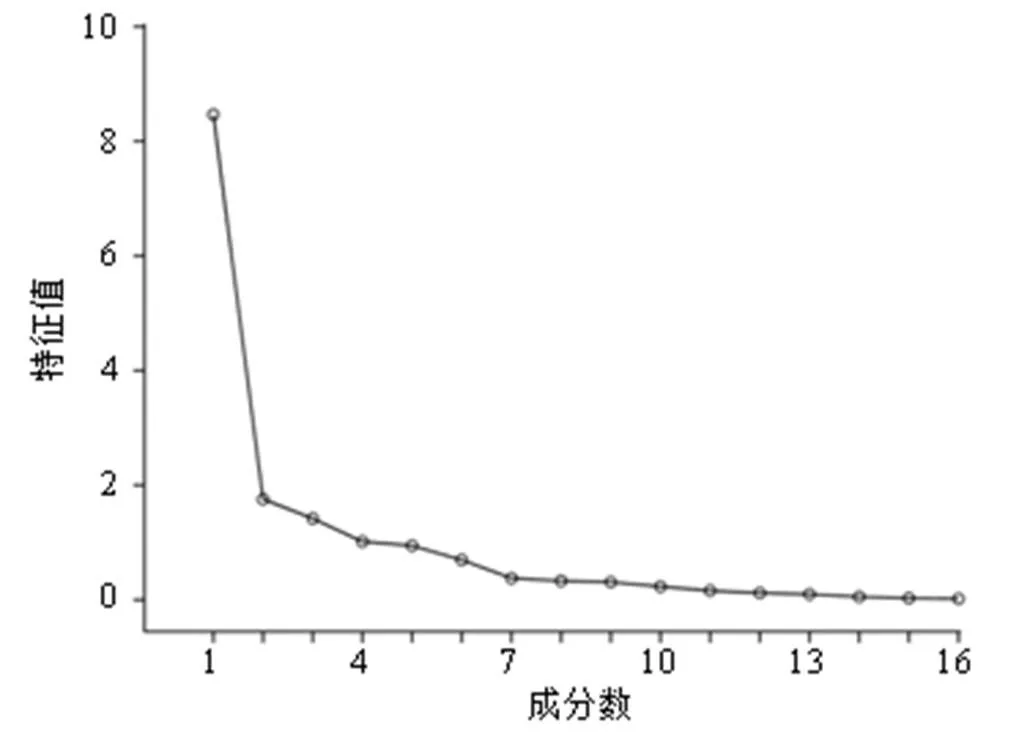
图2 公共因子碎石图
2.4.4 精密度试验 将配制得到的混合对照品母液,按照“2.4.1”项下色谱条件,连续进样5次,记录各组分色谱峰峰面积,计算RSD。结果地黄苷D、阿魏酸、羟基红花黄色素A、芍药苷、苦杏仁苷、藁本内酯峰面积的RSD分别为3.56%、0.79%、1.04%、0.60%、1.74%、1.33%,表明仪器精密度良好。
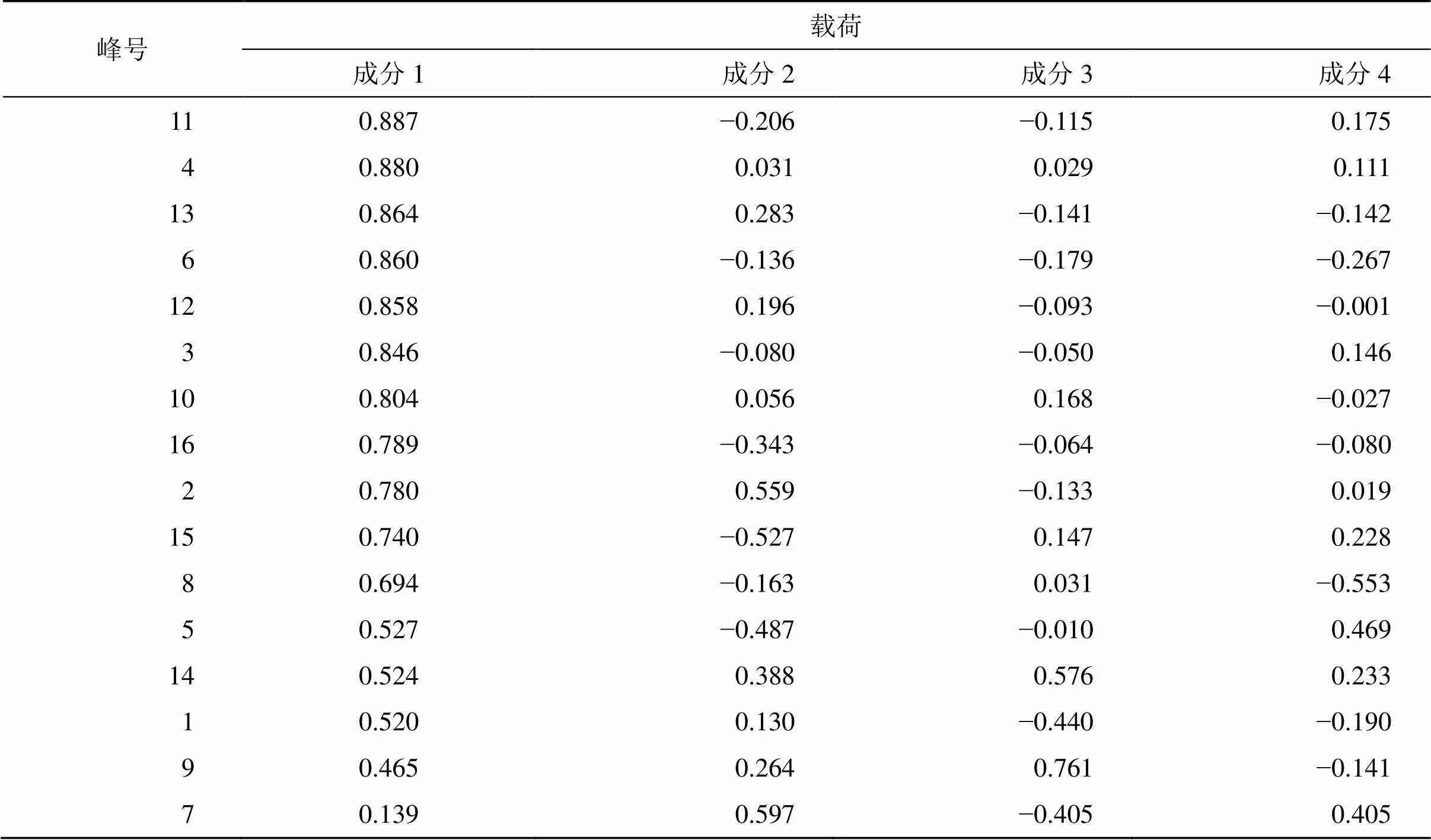
表4 初始因子载荷矩阵
2.4.5 稳定性试验 将试验号1制备的同一供试品溶液,室温放置,按照“2.4.1”项下色谱条件,于0、2、4、8、12、24、48 h进样,记录各组分色谱峰峰面积,计算RSD。结果地黄苷D、阿魏酸、羟基红花黄色素A、芍药苷、苦杏仁苷、藁本内酯峰面积的RSD分别为3.08%、1.03%、1.00%、1.86%、3.66%、3.96%,表明供试品溶液在室温下48 h内稳定良好。
2.4.6 重复性试验 按试验号1的制备方法平行制备6份供试品溶液,按照“2.4.1”项下色谱条件测定,记录各组分色谱峰峰面积,计算其质量浓度的RSD。结果地黄苷D、阿魏酸、羟基红花黄色素A、芍药苷、苦杏仁苷、藁本内酯质量浓度的RSD分别为3.17%、1.62%、1.02%、2.97%、1.40%、4.53%,表明方法重复性良好。
2.4.7 加样回收率试验 按试验号1的制备方法平行制备6份供试品溶液,每份精密量取1 mL,分别按样品中各成分含量的100%水平加入地黄苷D、阿魏酸、羟基红花黄色素A、芍药苷、苦杏仁苷、藁本内酯6种对照品,进行含量测定,计算6种成分的加样回收率。结果地黄苷D、阿魏酸、羟基红花黄色素A、芍药苷、苦杏仁苷、藁本内酯的平均加样回收率分别为99.0%、99.2%、98.5%、98.8%、98.6%、99.2%,RSD分别为0.94%、0.67%、1.40%、0.72%、1.05%、0.74%,表明该方法准确可靠。

表5 主成分综合得分排序
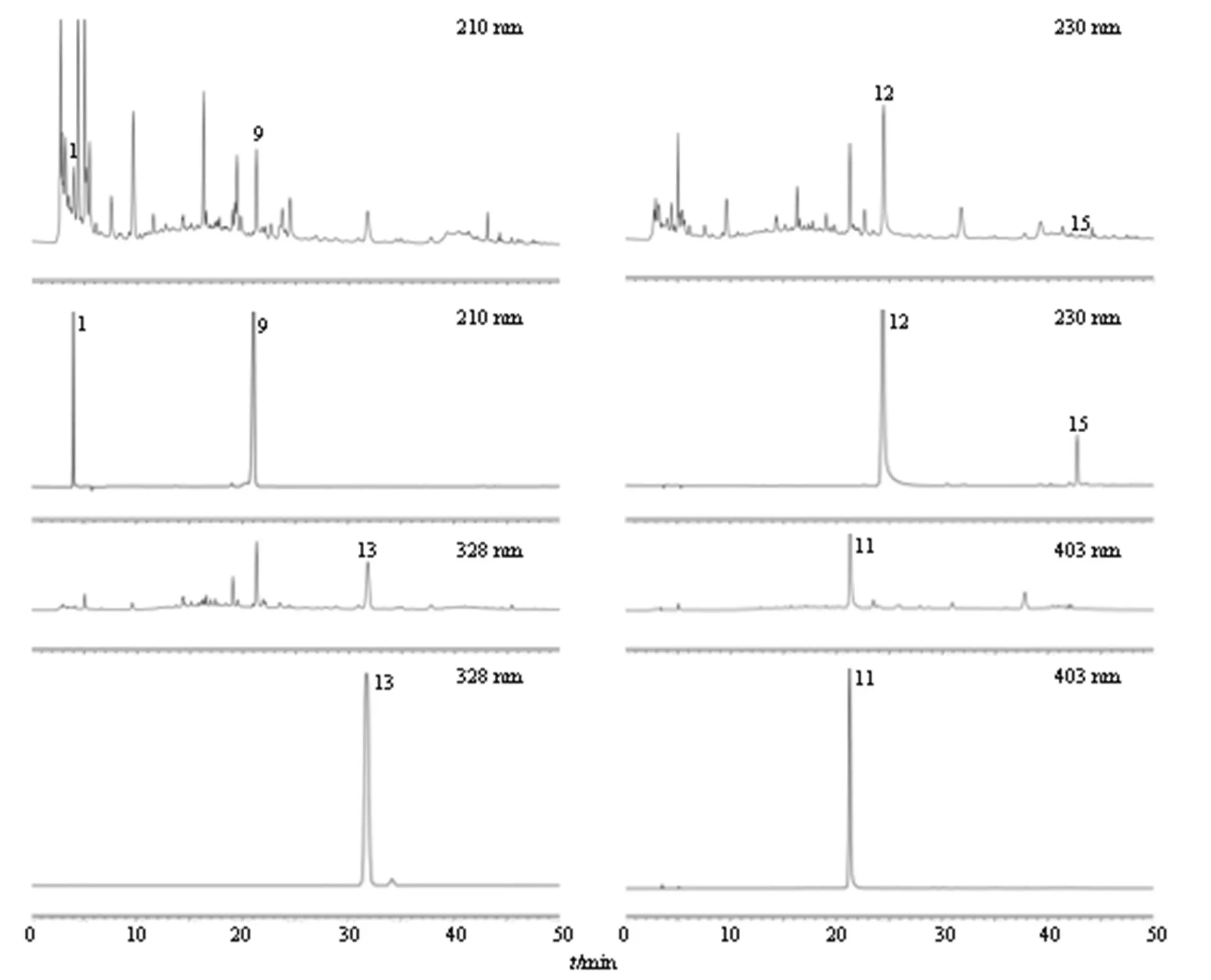
1-地黄苷D 9-苦杏仁苷 12-芍药苷 15-藁本内酯 13-阿魏酸 11-羟基红花黄色素A
2.4.8 多指标含量测定评价结果 计算各指标性成分含量测定结果,赋予6个关键质控成分相同权重(6个成分均代表了6味药的核心关键成分,故赋予了相同的权重),1~6分别代表地黄苷D、苦杏仁苷、羟基红花黄色素A、芍药苷、阿魏酸、藁本内酯。综合评分=(1/max+2/max+3/max+4/max+5/max+6/max)/6进行评价,如表6所示。综合得分结果显示,15号工艺为最佳工艺,与指纹图谱综合评分结果相同,说明这6种关键质控成分可较好地代表TSD质量概貌。
2.5 BBD-RSM回归模型的建立及方差分析
采用Design Expert 8.05软件,通过响应面法进行工艺优化。分别对各因素水平进行多元线性和非线性回归,建立各指标综合评分()对4个因素(加水量A、浸泡时间B、煎煮时间C、煎煮次数D)的2次回归模型方程=4.32+0.46 A-0.06 B-0.20 C+0.92 D-0.19 AB+0.01 AC+0.06 AD-0.03 BC-0.2 BD-0.05 CD-0.16 A2-0.05 B2-0.22 C2-0.23 D2。相关系数=0.947 4,校正系数0.894 8,说明该模型拟合度良好,试验误差小,可用此模型对综合评分进行分析和预测。

表6 TSD中6种指标成分含量测定综合评分结果
方差分析结果见表7,自变量1次项C,2次项BD、C2、D2显著(<0.05);自变量1次项A、D极显著(<0.01),表明模型具有统计学意义。各因素对综合评分的影响顺序为煎煮次数(D)>加水量(A)>煎煮时间(C)>浸泡时间(B)。失拟项值为0.223 5>0.05,对模型有利,说明无失拟因素存在。根据软件拟合得到2次回归方程等高线及响应面图,评价试验因素之间的交互强度,来确定最佳煎煮工艺参数。通过等高线的形状反映交互效应的强弱,椭圆表示交互作用强,圆形则交互作用较弱,结果见图4。根据模型拟合结果,加水量9.90倍、浸泡时间0.58 h、煎煮时间1.19 h、煎煮次数1.60次。结合研究过程中基于指纹图谱和化学模式识别得到的最佳工艺为加10倍量水、浸泡0.5 h、每次煎煮1 h,最终确定TSD煎煮工艺为加10倍量水、浸泡0.5 h、煎煮2次、每次1 h。
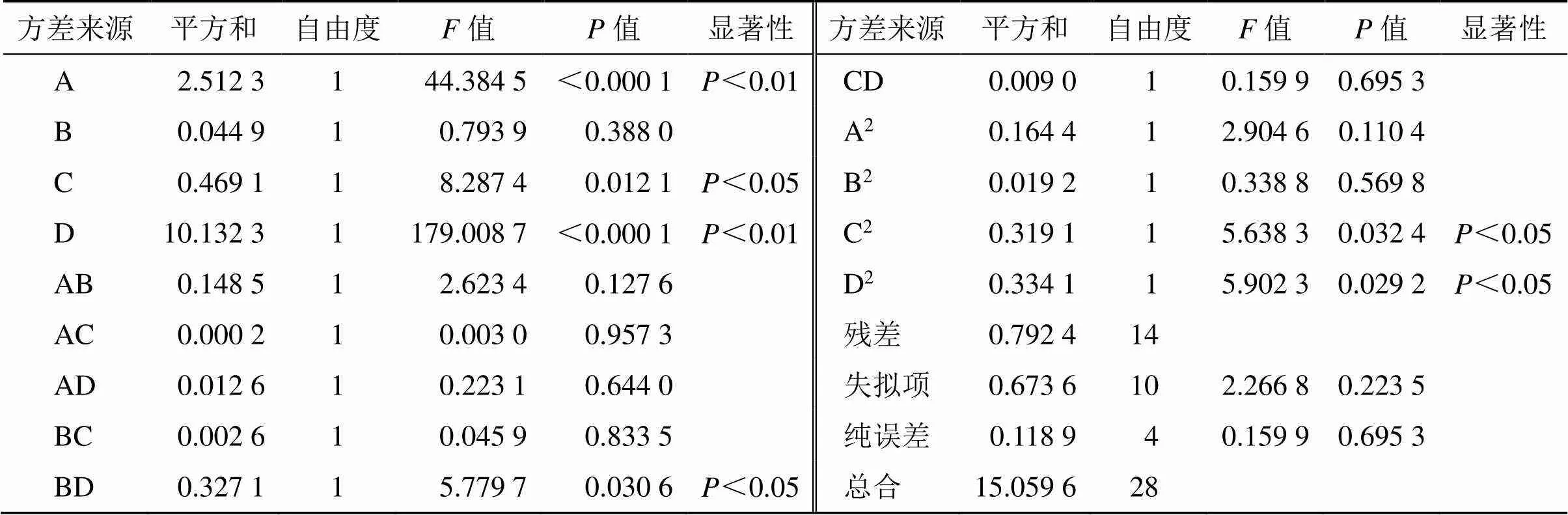
表7 方差分析结果
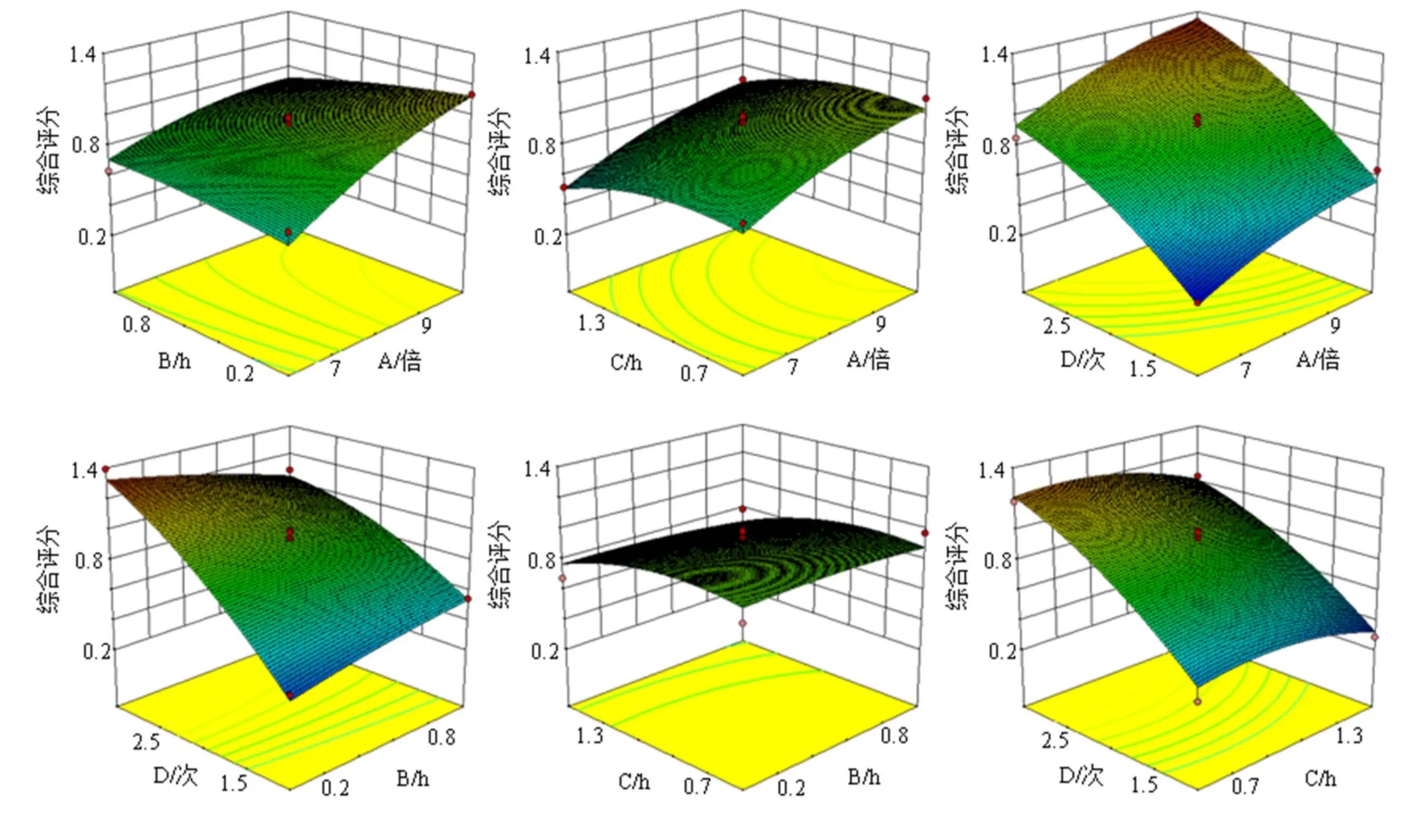
图4 4因素对综合评分的响应面图
2.6 工艺验证试验
选择最佳煎煮工艺条件(加10倍量水,浸泡0.5 h,煎煮2次,每次1 h)进行3批验证试验,按上述方法进行指纹图谱和含量测定,计算得到指纹图谱相似度分别为0.998、0.976、0.989,3批验证样品含量测定的综合得分如表8所示,分别为1.194、1.208、1.276,预测值为1.247,基本吻合,说明优化得到的提取工艺条件较为稳定,具备可行性。
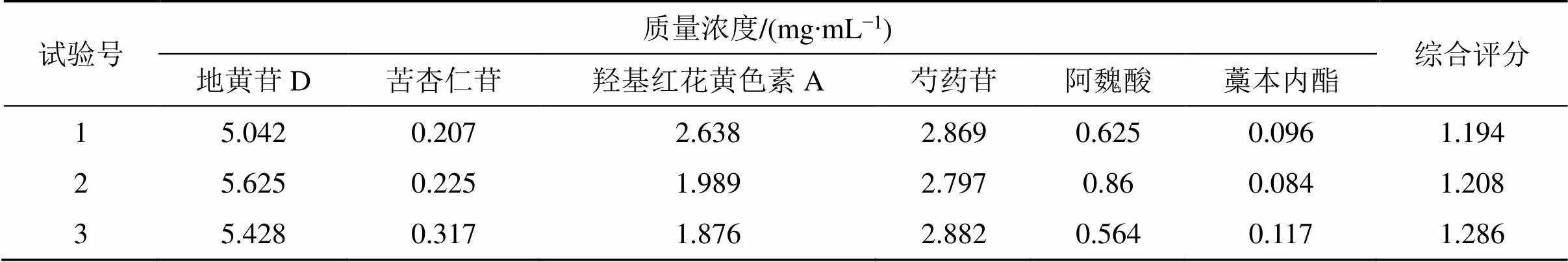
表8 验证实验结果
3 讨论
现代数理统计和计算机技术的发展,开辟了用数学方法研究中药复方成分变化规律的新领域,也为经典名方工艺研究提供了强有力的工具。本课题基于前期预实验和查阅文献发现,加水量、浸泡时间、提取时间、提取次数对TSD提取工艺有较大影响。已开展的TSD煎煮工艺研究,多以单因素为其评价指标,难以科学评价中药复方的提取工艺,且得到的工艺参数与古籍记载相去甚远,遵古煎煮与现代工艺参数研究是经典名方TSD复方制剂研发的首要关键环节。故本实验通过应用现代分析技术构建中药复方的指纹图谱和指标成分含量测定,从“定性和定量”2个角度综合优化中药复方工艺过程和关键参数。
《中国药典》2020年版中TSD中6味饮片明确规定了7个定量检测指标,羟基红花黄色素A、山奈酚、苦杏仁苷、阿魏酸、芍药苷、梓醇和地黄苷D[16]。本实验基于课题组前期制备过程质量标志物的筛选[15]确定地黄苷D、苦杏仁苷、羟基红花黄色素A、芍药苷、阿魏酸、藁本内酯6个成分作为指标成分对TSD提取工艺进行考察。地黄苷D为地黄中的主要活性成分,在《中国药典》2020年版中首次被收载为含测成分,其具有补血、降低血糖[17]等药理作用。苦杏仁苷为桃仁中的主要有效成分,现代研究发现其具有心血管保护、抗胃溃疡、抑制肝纤维化、免疫调节和抑制、抗肿瘤、止咳、平喘、抗炎、镇痛等多方面的药理活性[18]。羟基红花黄色素A为红花中的主要有效成分,且在红花中含量较高,其具有抗心血管疾病、调血脂、调节代谢等多种药理作用。芍药苷为白芍中的主要有效成分,其具有抗炎、抗肿瘤、保肝等多种药理作用。阿魏酸和藁本内酯为当归和川芎的主要活性成分,阿魏酸具有抗氧化、抗血栓、调血脂、降低心肌缺血和耗氧量、抗菌、抗病毒、抗癌等药理活性[19];藁本内酯为当归和川芎挥发油中的主要成分,具有抗炎、镇痛、抗氧化、神经保护等药理活性[20-21]。
本实验通过指纹图谱和6个指标成分综合评价分析得到的最佳工艺均为15号,表明6个指标成分可大致代表TSD中的化学成分进行工艺评价,也印证了课题组前期经过研究预测得到的关键质量质控指标科学合理,可以代表TSD的整体质量,则可以作为TSD制备过程的关键质量控制指标进行量质传递研究。通过指纹图谱和指标成分综合评价分析得到的最佳工艺均为15号(加10倍量水,浸泡0.5 h,煎煮时间1 h,煎煮3次),通过BBD-RSM对工艺进行进一步优化,得到的最佳煎煮工艺为加水量9.90倍、浸泡时间0.58 h、煎煮时间1.19 h、煎煮次数1.60次。其中,煎煮次数是对质量影响最大的因素,而在经典名方研究过程中,煎煮次数也一直是备受争议的问题,关键信息中公布TSD的服用方法为“水煎温服”,没有明确提及煎煮次数等参数,故课题组尊古宜今,综合古籍对经典名方的记载以及生产过程中对提取率的考虑,经过BBD-RSM分析后,得到最优工艺为煎煮1.60次,根据实际情况设定为2次。指纹图谱和指标成分含测筛选到的最佳煎煮工艺为3次,通过响应面优化明确2次可较大程度得将TSD中的有效成分进行提取,在保证有效成分转移率的同时还降低了成本。故基于可操作性选择最佳工艺条件为,加10倍量水,浸泡0.5 h,煎煮2次,每次1 h。同时通过验证说明该提取工艺条件较为稳定,具备可行性。
利益冲突 所有作者均声明不存在利益冲突
[1] 清·柴得华.妇科冰鉴 [M].于峥, 魏民, 杨威校注.北京: 人民军医出版社, 2012: 5.
[2] 国家中医药管理局.关于发布《古代经典名方目录(第一批) 》的通知[EB/OL].( 2018-04-13) [2018-12-10].http://kjs.satcm.gov.cn/zhengcewenjian/2018-0416/7107.html.
[3] 成颜芬, 江华娟, 王琳, 等.经典名方桃红四物汤化学指纹图谱及9种成分含量测定研究 [J].中草药, 2020, 51(3): 653-661.
[4] 王升菊, 刘倩倩, 江华娟, 等.基于网络药理学和分子对接技术探讨桃红四物汤治疗原发性痛经的有效成分及作用机制 [J].中国中药杂志, 2020, 45(22): 5373-5382.
[5] Zuo C, Zhang Y, Wang J,.Deciphering the intervention mechanism of Taohong Siwu Decoction following the abnormal uterine bleeding rats based on serum metabolic profiles [J]., 2019, 170: 204-214.
[6] Zhang Y Y, Wang J C, Zuo C J,.Protective effect of Taohong siwu decoction on abnormal uterine bleeding induced by incomplete medical abortion in rats during early pregnancy [J]., 2018, 66(7): 708-713.
[7] 白晶, 陈黎明, 郭盛君, 等.桃红四物汤+五苓散口服治疗踝关节骨折术后肿胀25例 [J].中国中医骨伤科杂志, 2021, 29(1): 59-61.
[8] 董少阳, 薛鹏宇, 张毅立, 等.桃红四物汤加减对组合式外固定架治疗股骨转子间骨折患者凝血功能的影响 [J].河北中医药学报, 2021, 36(1): 35-40.
[9] 谢夏阳.温经汤配合桃红四物汤对月经不调患者性激素水平的影响与安全性分析 [J].现代医学与健康研究电子杂志, 2021, 5(4): 122-124.
[10] 吴振起, 高畅, 杨璐, 等.基于层次分析法结合Box-Behnken设计-响应面法优选养阴清肺汤加味提取工艺 [J].中草药, 2019, 50(12): 2862-2867.
[11] 杨凯, 马子豪, 李源, 等.Box-Behnken响应面法优化白及多糖/聚乙烯醇湿法纺丝工艺及纤维性能评价 [J].中草药, 2020, 51(14): 3645-3654.
[12] 曾海蓉, 李婷娜, 冉倩, 等.基于熵权法结合Box-Behnken响应面法优化桂枝芍药知母颗粒复方提取工艺 [J].中草药, 2020, 51(1): 84-90.
[13] 张铁军, 刘昌孝.新形势下中药新药研发的思路与策略 [J].中草药, 2021, 52(1): 1-8.
[14] 聂欣, 成颜芬, 王琳, 等.桃红四物汤化学成分、药理作用、临床应用的研究进展及质量标志物的预测分析 [J].中国实验方剂学杂志, 2020, 26(4): 226-234.
[15] 江华娟, 李敏敏, 何瑶, 等.基于HPLC指纹图谱和化学模式识别的经典名方桃红四物汤制备过程质量评价研究 [J].中草药, 2021, 52(4): 1000-1010.
[16] 中国药典[S].一部.2020: 91-339.
[17] 谢彩侠, 李雅静, 张苗, 等.怀地黄中地黄苷A, 地黄苷D及益母草苷含量快速分析方法的建立 [J].中国实验方剂学杂志, 2018, 24(6): 47-54.
[18] 李露, 戴婷, 李小龙, 等.苦杏仁苷药理作用的研究进展 [J].吉林医药学院学报, 2016, 37(1): 63-66.
[19] 张欣, 高增平.阿魏酸的研究进展 [J].中国现代中药, 2020, 22(1): 138-147.
[20] Xie Q X, Zhang L L, Xie L,.-ligustilide: A review of its pharmacokinetics and pharmacology [J]., 2020, 34(8): 1966-1991.
[21] 何树苗, 陈元堃, 曾奥, 等.藁本内酯药理作用及机制研究进展 [J].广东药科大学学报, 2021, 37(2): 152-156.
Optimization of decocting process of Taohong Siwu Decoction based on Box- Behnken response surface methodology and comprehensive quality evaluation
HE Yao1, JIANG Hua-juan1, CHENG Yan-fen1, DU Ke-qun1, LI Min-min1, YANG Qing-bo2, WANG Zhen- zhong3, 4, FU Chao-mei1, DUAN Yi2
1.State Key Laboratory of Southwest Characteristic Traditional Chinese Medicine Resources,College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2.Guizhou Yibai Pharmaceutical Co., Ltd., Guiyang 550001, China 3.Jiangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China 4.State Key Laboratory of New-tech of Traditional Chinese Medicine Preparation Process, Lianyungang 222001, China
To optimize and scientifically evaluate of the decoction process of Taohong Siwu Decoction (桃红四物汤, TSD) according to ancient law, so as to lay a foundation for the study of traditional Chinese medicine compound preparation of classical prescription.Using fingerprint profiles combined with multi-index quantitative determination as a comprehensive evaluation, Box-Behnken response surface design was used to optimize water consumption, soaking time, time of decoction, and frequency of decoction.Fingerprinting was performed on the SunFire-C18column (150 mm × 3.0 mm, 3.5 μm)with acetonitrile-0.5% phosphoric acid aqueous solution as mobile phase, flow rate was 0.2 mL/min, column temperature was 25 ℃, and detection wavelength was 230 nm.The HPLC fingerprint was established, and the comprehensive score of each test sample was calculated by principal component analysis of the chromatographic peaks.Furthermore, the content of the six quality control components was detected by UPLC multiwavelength detection, each sample comprehensive score was calculated, and decoction process was optimized by response surface methodology.The HPLC fingerprint of 29 test samples of TSD was established.A total of 16 chromatographic peaks were selected as the common peaks of the fingerprint and six ingredients were identified including rehmannioside D, amygdalin, paeoniflorin, ferulic acid, hydroxysafflor yellow A, ligustilide with good linear relation.The result of comprehensive score showed that process number 15 was the best process.According to the regression model fitting, the optimal process was obtained as follows: adding 9.90 times of water, soaking time 0.58 h, decocting time 1.19 h and decocting times 1.60 times.Finally, the decocting process of TSD was determined as follows: adding 10 times of water, soaking for 0.5 h, decocting twice, 1 h for each time.Fingerprint quality profile combined with key quality control components can be used to evaluate the quality of the preparation process of TSD.The optimal decoction process is stable and feasible, which can be used for further research and development of the classical prescription TSD.
Taohong Siwu Decoction; classical prescription; decoction technology; fingerprints; Box-Behnken design-response surface methodology; comprehensive quality evaluation; principal component analysis; HPLC; UPLC;rehmannioside D; amygdalin; hydroxysafflor yellow A; paeoniflorin; ferulic acid; ligustilide
R283.6
A
0253 - 2670(2021)22 - 6845 - 11
10.7501/j.issn.0253-2670.2021.22.009
2021-06-16
四川省科技计划项目(2021YFS0256);四川省科技计划项目(2020YFS0567);中药制剂过程新技术国家重点实验室开放基金资助项目(SKL2020Z0305)
何 瑶,副教授,主要从事新制剂、新剂型和中药炮制工艺与机制研究。E-mail: 20660306@qq.com
通信作者:傅超美,教授,主要从事新制剂、新剂型和中药炮制工艺与机制研究。E-mail: chaomeifu@126.com
段 毅,主管中药师,主要从事药学质量标准研究。E-mail: 121928757@qq.com
[责任编辑 郑礼胜]

