小檗胺通过OTUB1和MDM2-p53通路调控肺癌A549细胞的增殖、凋亡和侵袭转移*
刘丽丽,徐志英,严佳栋,许晓东,张忠伟,余彬彬,曹 莺
(苏州大学附属张家港医院,江苏 苏州 215600)
肺癌是世界上最常见的恶性肿瘤[1]。目前,肺癌发病率在男性中居第一位,在女性中居第二位[2]。非小细胞肺癌(nonsmall-cell lung carcinoma,NSCLC)在所有肺癌类型中占85%[3]。很多患者在确诊时已是晚期,失去了手术的机会。传统的放化疗对已经进展的非小细胞肺癌患者效果甚微,毒副作用大,患者生存质量低[4],而且经常伴有复发。因此,迫切需要寻找疗效更好的药物来治疗非小细胞肺癌。
小檗胺是从小檗科植物小檗等中草药中提取的化合物。在亚洲国家,小檗胺片用于治疗各种原因引起的白细胞减少症,而且无明显不良反应[5]。小檗胺有抗肿瘤的作用[6-7],它能够明显抑制前列腺癌细胞侵袭[8],诱导肝癌细胞凋亡[9]。但是小檗胺对NSCLC的研究较少。去泛素化酶(DeUbiquitinating Enzymes,DUB)隶属于蛋白酶体超家族,它通过对蛋白降解反向调节,从而影响细胞的分化、增殖。卵巢肿瘤相关蛋白酶B1(OTU domain-containing ubiquitin aldehyde-binding protein Bl,OTUB1)是DUB家族的一员,它广泛表达于人类的肝、肾、脑等组织中。OTUB1在非小细胞肺癌中表达上调[10],能够抑制抗凋亡蛋白p53的表达[11]。鼠双微体2基因(Murine double minute 2,MDM2)是用小鼠的MDM2 cDNA探针,从人类基因库中筛选的一个同源基因。MDM2是p53的关键负调控因子,能与p53形成自调节反馈环[12]。MDM2-p53信号通路与胶质瘤等肿瘤的发展密切相关[13]。本研究拟探讨OTUB1与非小细胞肺癌细胞增殖、侵袭转移及凋亡的关系,以及小檗胺与MDM2-p53信号通路的关系。
1 材 料
1.1 细胞株 非小细胞肺癌细胞株A549购自中国科学院典型培养物保藏委员会细胞库。
1.2 试剂 小檗胺(纯度>98%,货号:B860680,麦克林生化科技有限公司);阿霉素盐酸盐(纯度>98%,货号:D1515,Sigma公司);胎牛血清(FBS,批号:1624016,Gibco公司);RPMI 1640培养基(批号:2141287,Corning公司);基质胶(货号:356234,BD生物公司);抗体p53(批号:GR136120-36)、MDM2(批号:GR3210619-1)(Abcam公司);OTUB1(批号:A1618)、Caspase-3(货号:sc-7272)、β-actin(货号:sc-8432)(Santa Cruz Biotechnology);二抗(货号:A00098,金斯瑞);台盼蓝染色细胞存活率检测试剂盒(货号:C0011)、裂解液(货号:P0013K)、蛋白酶抑制剂(PMSF,货号:ST506)、电泳液(货号:P1004D)、转膜液(货号:P0021B)、ECL化学发光试剂盒(货号:P1009SF)(碧云天公司)。
1.3 仪器 二氧化碳培养箱(货号:SHELLAB 3517/21,美国Thermo公司);超净工作台(货号:Airtech SW-CJ-2FD,苏州安泰空气公司);徕卡正置荧光显微镜(序列号:SN409,德国徕卡公司);Thermo全波长多功能酶标仪(序列号:3001-2228,美国Thermo公司);Bio-RadECL发光仪(序列号:7218R11306,美国Bio-Rad公司);Bio-Rad MP4电泳仪、Bio-Rad MP4转膜仪(美国Bio-Rad公司);细胞培养板(96孔:货号:3559;24孔板:货号:3524;6孔板:货号:3516)(Costar公司);冻存管(货号:430659)、15 mL离心管(货号:430791)(Corning公司)。
2 方 法
2.1 细胞培养A549细胞置于RPMI 1640培养基(含10%FBS,100 μg/mL青霉素和100 μg/mL链霉素)中,于37℃、5% CO2的培养箱中培养,每2 d传代换液1次,选用对数生长期细胞用于实验。
2.2 MTT试验 取对数期的A549细胞,接种于96孔板中(1×104个/孔)过夜,第2天,将培养液轻轻吸去,加入含不同浓度小檗胺(1.25、2.5、5、10、20、40、80 μmol/L)的培养液180 μL,每个浓度设置3个平行孔,将细胞置于37℃培养箱中,检测小檗胺作用于A549细胞24、48、72 h后,对A549细胞增殖的影响。在加入小檗胺24、48、72h时,每孔加入20μL MTT溶液(5mg/mL),37℃培养箱中孵育4 h,去上清,加入150 μL DMSO,用酶标仪在560 nm波长处检测OD值。
2.3 EdU实验EdU是胸腺嘧啶核苷类似物,可以取代胸腺嘧啶并插入到细胞周期中复制的DNA分子中。EdU被Alexa Fluor 647所标记,因此能够简单、快速、高灵敏地检测细胞增殖。将A549细胞分为溶剂对照组,阿霉素组(2 μmol/L)和小檗胺10、20、40 μmol/L组,每组设置3个平行孔。将A549细胞(8×103个/孔)接种于96孔板中,每孔加入200 μL含不同浓度小檗胺的培养液,置于37℃培养箱中过夜。第2天,按照试剂盒使用说明,每孔100 μL EdU(50 μmol/L),然后将细胞置于37℃培养箱中孵育2 h,将培养液弃去,细胞用4%多聚甲醛固定30 min,再用2 mg/mL的甘氨酸脱色,然后按照试剂盒说明,配置1×Apollo染色反应液,避光、室温摇床孵育30 min。接下来DNA用Hoechst 33342染色30 min,最后用荧光显微镜拍照,记录细胞染色情况。用EdU与Hoechst 33342共染的细胞率(EdU%=某个视野下EDU与Hoechst 33342共染细胞数/此视野下Hoechst 33342阳性细胞数)代表细胞的增殖能力,EdU%越高,说明细胞的增殖能力越强。
2.4 划痕试验 在细胞板背后画平行的直线,将A549细胞(1×105个/孔)接种于6孔板中。当细胞铺满孔板约80%时,垂直于细胞板背后的直线,用200 μL的枪头在单层细胞上划一条直线,用PBS轻轻地将漂浮的细胞洗去,加入含阿霉素(2μmol/L)和不同浓度小檗胺(10、20、40 μmol/L)的培养液,每个浓度设置3个平行孔。在划线后的0 h和24 h,用倒置显微镜拍照。用NIH Image J软件计算细胞迁移的面积。划痕愈合率=(0 h划痕-24 h划痕面积)/0 h划痕面积。为了排除细胞增殖对实验的影响,在加入小檗胺时每孔细胞加入丝裂霉素(1.0 μg/mL)。
2.5 Transwell试验 用Transwell试验来评价小檗胺对A549细胞侵袭转移能力的影响。将细胞(1×104个/孔)分别用100 μL含对照溶剂、阿霉素(2 μmol/L)或不同浓度小檗胺(10、20、40 μmol/L)的无血清培养基中混匀,每组设置3个平行孔,置于上室中,下室中加入600 μL的完全培养基(含10%FBS),置于37℃饱和湿度的培养箱中24 h,将24孔板取出,将小室用PBS清洗3次,再用4%多聚甲醛固定30 min,用结晶紫染色20 min,然后用流水轻轻地冲洗小室,用棉签轻轻擦去上室细胞,将小室倒置,于显微镜下观察拍照(×100)。评价小檗胺对A549细胞转移能力的影响用不加基质胶的小室;评价小檗胺对A549细胞侵袭能力的影响用加基质胶的小室,即在细胞混悬液加入到上室之前,将小室用50 μL Matrigel基质胶稀释液(1∶8)铺满,置于37℃培养箱中孵育30 min,使基质胶凝固。为了排除细胞增殖对实验的影响,在每组细胞混悬液中加入丝裂霉素(1.0 μg/mL)。
2.6 台盼蓝试验 取对数期的A549细胞接种于6孔板中(1×105个/孔)过夜。第2天,将培养液吸去,分别加入含溶剂对照、阿霉素(2 μmol/L)或不同浓度小檗胺(10、20、40 μmol/L)的培养液,每组设置3个平行孔。48 h后,按照台盼蓝染色细胞存活率检测试剂盒使用说明书收集细胞,用离心机1 000 g离心1 min,弃去上清,加入100 μL细胞重悬液,再加入100 μL台盼蓝染色液(2×),轻轻混匀,染色3 min。吸取少量经过染色的细胞,用血细胞计数板计数。
2.7 ELISA试验Cell Death ELISA Kit的实验原理是基于针对组蛋白和DNA的抗体的定量免疫分析。因此,检测细胞裂解液中单核小体和低核小体可以间接代表细胞的凋亡。将A549细胞接种于6孔板中,加入含溶剂对照、阿霉素(2 μmol/L)或不同浓度小檗胺(10、20、40 μmol/L)的培养液培养24 h,然后用冷的PBS洗涤细胞。加入RIPA裂解缓冲液(含1 mmol/L PMSF),收集裂解后的细胞液,离心,取上清。按照试剂盒操作说明书进行后续试验,最后用酶标仪测定OD值来反映单核和低核小体片段DNA含量。
2.8 Western blotting试验 将细胞用溶剂对照或含不同浓度的小檗胺(10、20、40 μmol/L)的培养液培养24 h,将培养液弃去,用PBS清洗两次,再用裂解液(含1 mmol/L PMSF)在4℃裂解30 min,收集裂解后的细胞液,离心,取上清。用BCA试剂盒检测收集到的蛋白浓度。将提取的蛋白(20 μg)在10%的SDS-PAGE胶上进行分离后转移到PVDF膜上,将PVDF膜用含5%脱脂牛奶的TBST溶液浸泡,振摇,室温封闭2 h。然后孵一抗OTUB1(1∶1 000稀释)、MDM2(1∶500稀释),p53(1∶1 000稀释)、Caspase-3(1∶1 000稀释)和β-actin(1∶2 000稀释)4℃过夜,用TBST洗涤3次,室温条件下孵二抗(1∶10 000稀释)2 h,再用TBST洗涤3次,用ECL发光试剂盒检测显影,Bio-RadECL发光仪采集图像,用NIH Image J软件计算灰度值。
2.9 统计学方法 所有的统计采用SPSS 21.0软件进行分析,计量资料以“均数±标准差”(±s)表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
3 结 果
3.1 小檗胺对A549细胞增殖能力的影响MTT试验的结果表明,小檗胺以浓度依赖和时间依赖的方式下调A549细胞的增殖率。用小檗胺处理A549细胞24、48和72 h后,使A549细胞的增殖率明显下调的最低浓度分别为10、5和2.5 μmol/L,同一小檗胺浓度处理A549细胞的时间越长,对A549细胞增殖抑的制越明显。小檗胺处理A549细胞72 h时,抑制细胞增殖的IC50为(22.7±2.3)μmol/L。因此,我们用10、20、40 μmol/L的小檗胺进行后续实验。(见图1)
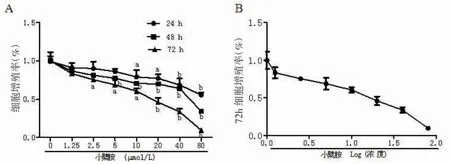
图1 小檗胺对A549细胞增殖能力的影响(±s,n=3)
3.2 小檗胺抑制A549细胞的增殖EdU实验结果表明,与对照组比较,2 μmol/L的阿霉素和10、20、40 μmol/L的小檗胺均能使EdU%明显下降。EdU与Hoechst 33342共染的细胞率代表增殖能力,结果均表明小檗胺能够抑制A549细胞增殖。(见图2)3.3小檗胺抑制A549细胞的迁移 与溶剂对照组比较,阿霉素能够明显降低A549细胞的划痕愈合率,10、20、40 μmol/L小檗胺组的划痕愈合率明显低于溶剂对照组,表明小檗胺能够抑制A549细胞的迁移。(见图3)
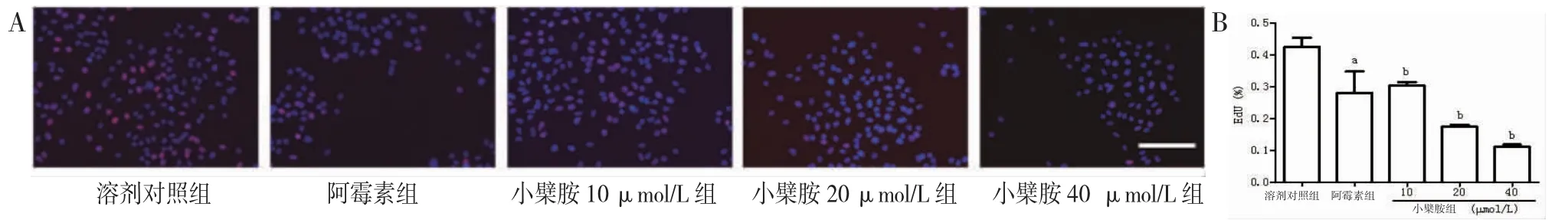
图2 EdU实验评价小檗胺对A549细胞增殖能力的影响

图3 划痕试验评价小檗胺对A549细胞迁移能力的影响
3.4 小檗胺抑制A549细胞的侵袭转移 在转移试验中,与溶剂对照组比较,阿霉素使A549细胞的细胞转移率明显下降,10、20和40 μmol/L的小檗胺明显抑制A549细胞的转移。侵袭试验的结果表明:与溶剂对照组比较,阿霉素使A549细胞的细胞侵袭率明显下降,10、20和40μmol/L的小檗胺能够明显抑制A549细胞的侵袭能力。(见图4)
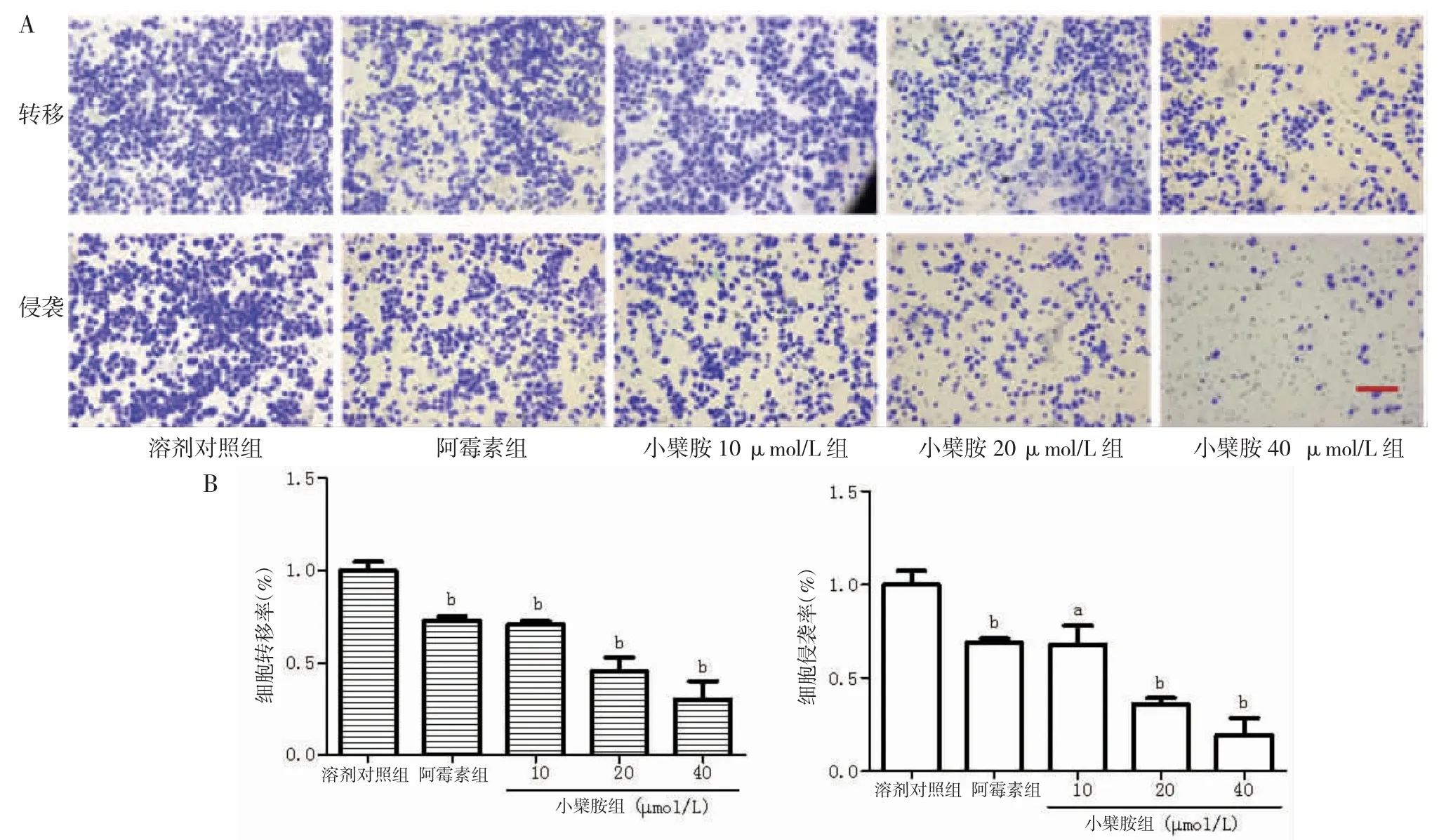
图4 Transwell试验评价小檗胺对A549细胞侵袭转移的影响
3.5 小檗胺诱导A549细胞凋亡 与溶剂对照组比较,阿霉素能够明显增加台盼蓝染色阳性细胞的比例,10、20和40 μmol/L的小檗胺也能显著增加台盼蓝染色阳性细胞的比例,而且台盼蓝染色阳性的比例随小檗胺浓度的升高而增大,说明小檗胺能够诱导A549细胞凋亡。(见图5)

图5 台盼蓝试验检测小檗胺对A549细胞凋亡的影响
3.6 小檗胺诱导A549细胞死亡 与溶剂对照组比较,阿霉素能够明显增加细胞提取液的OD值,10、20和40 μmol/L的小檗胺也能明显增加细胞提取液的OD值,表明小檗胺能够诱导A549细胞死亡。(见图6)
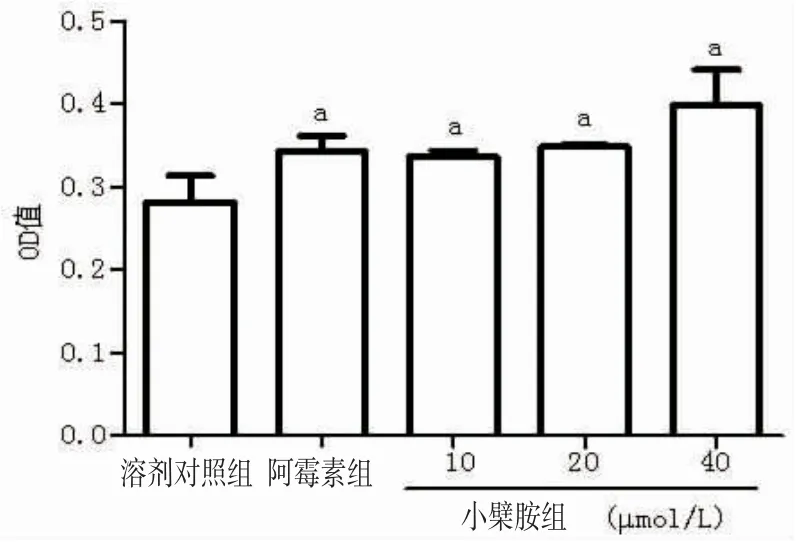
图6 ELISA试验检测小檗胺对A549细胞死亡的影响(±s,n=3)
3.7 小檗胺对A549细胞中MDM2-p53信号通路及OTUB1蛋白表达的影响 与溶剂对照组比较,10、20、40μmol/L的小檗胺能够明显下调MDM2的表达,20、40μmol/L的小檗胺能够明显下调OTUB1的表达。与溶剂对照组比较,10、20、40μmol/L的小檗胺能够上调p53的表达。40 μmol/L的小檗胺能够明显增加cleaved-Caspase-3/Caspase-3的表达。(见图7)
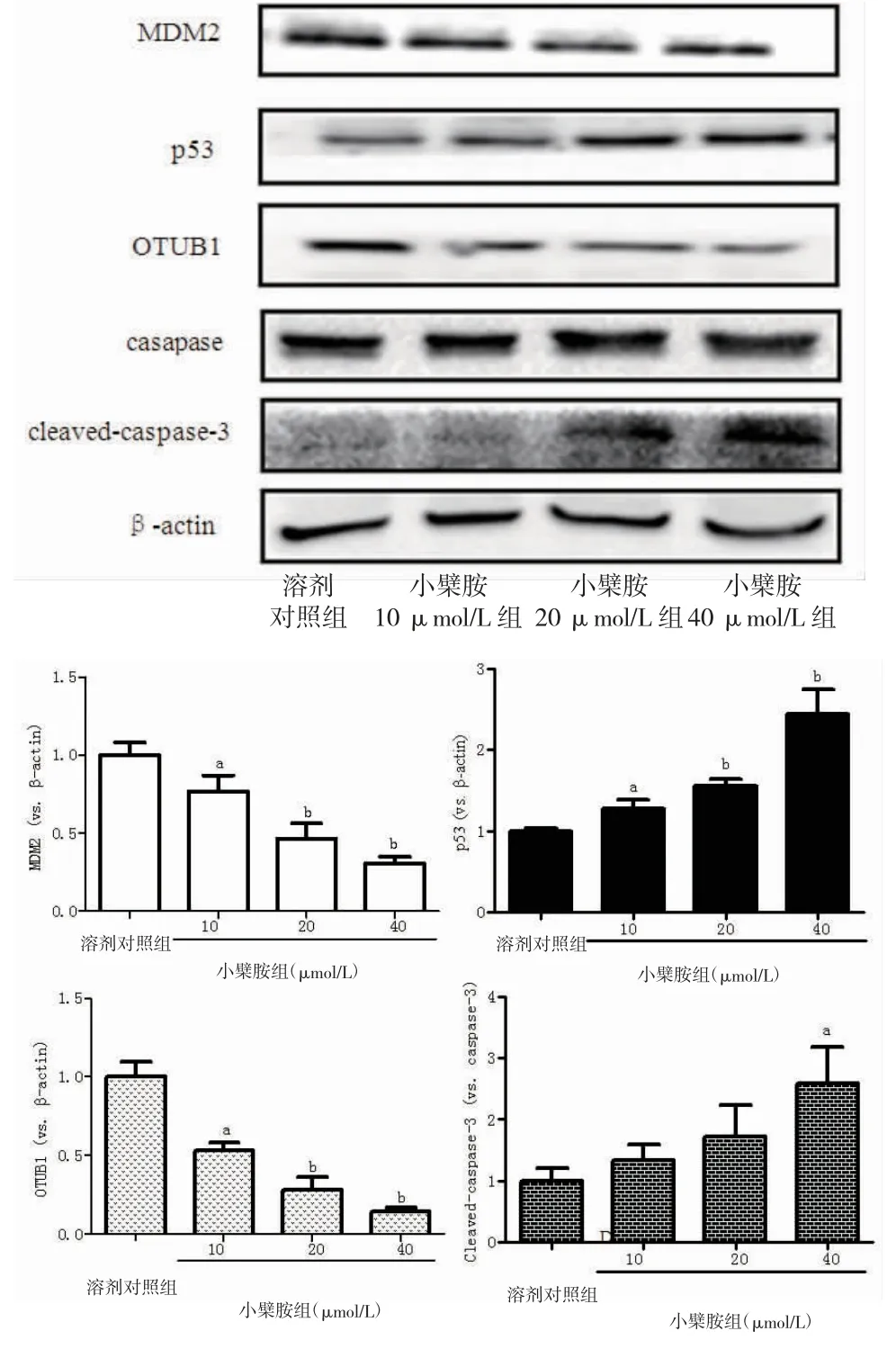
图7 Western blotting检测小檗胺对A549细胞OTUB1和MDM2-p53信号通路蛋白表达的影响
4 讨 论
肺癌是世界上最常见的恶性肿瘤。非小细胞肺癌(NSCLC)约占所有肺癌类型的85%[14],通常患者被诊断出来时已是晚期,且常伴有转移,预后较差。因此,阐明非小细胞肺癌的发生发展机制可能会为非小细胞肺癌提供新的治疗方法。
MDM2在许多癌症中表达上调,导致p53依赖的细胞活性丧失,如细胞凋亡和细胞周期阻滞。研究显示,MDM2表达降低,会导致胰腺导管癌细胞的凋亡率上升[15]。MDM2-p53信号通路与胰腺癌细胞的侵袭转移密切相关,抑制MDM2的活性,可使胰腺癌细胞的侵袭转移能力明显下降[16-17]。本研究结果显示小檗胺能够显著抑制A549细胞的增殖与侵袭转移,诱导A549细胞的凋亡,并且小檗胺能够剂量依赖性的抑制MDM2的表达,这与以上研究的结果相符,说明小檗胺可能是通过MDM2-p53的信号通路来抑制A549细胞的增殖、侵袭转移,诱导A549细胞的凋亡。CHEN S R等[13]研究显示MDM2能够负调控p53的表达,而p53是抑癌基因,在维持细胞完整性和防止细胞癌变中起到重要作用。本研究结果表明小檗胺能够剂量依赖性地上调p53的表达,说明小檗胺能抑制A549细胞增殖、侵袭转移,小檗胺诱导A549细胞凋亡的作用可能是通过抑制MDM2的表达,进一步上调p53的表达来实现的。转录因子OTUB1是去泛素化酶家族中一员,在肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)中高表达。研究显示OTUB1在非小细胞肺癌中高表达[18],当骨髓瘤细胞的凋亡增加时,OTUB1的表达下调[19]。而且,OTUB1能够调控卵巢癌细胞的侵袭转移。此外,OTUB1能够稳定MDM2的表达,进一步抑制p53的活性发挥抗凋亡作用[20]。本研究结果显示小檗胺处理A549细胞后,细胞的凋亡数明显增加,细胞的侵袭转移能力明显下降,Western blotting试验结果显示OTUB1和MDM2的表达明显下调,这与文献报道的结果相似,说明小檗胺抑制A549细胞侵袭转移,诱导A549细胞凋亡的作用可能是通过调控OTUB1的表达来实现的。综上,小檗胺可能是通过抑制OTUB1的表达,进一步抑制MDM2-p53信号通路来抑制A549细胞的增殖、侵袭转移,诱导A549细胞凋亡。

