银杏内酯注射液对大鼠脑中风恢复期的改善及对神经元自噬的影响*
李伟艺,刘红松,高山瑛,苏志强
(汉中市人民医院,陕西 汉中 723000)
脑中风是由脑部血液循环障碍导致局部神经功能缺失为主要特征的疾病,具有致残率高、致死率高和患病率高的特点[1]。随着国家经济的发展,人民生活水平显著提高,饮食结构发生了很大变化,致使糖尿病、高血压、冠心病等人群增加,从而使中风发病率大幅增加[2]。银杏内酯注射液主要成分为白果内酯、银杏内酯A、银杏内酯B和银杏内酯C等,有活血化瘀,通经活络的功能,主要用于急性期和恢复期脑卒中[3]。近年来,临床研究发现银杏内酯对急性脑梗死及动脉粥样硬化脑梗死患者神经功能均有改善的作用,但其对神经元自噬的影响研究尚少[4]。本研究通过建立脑中风大鼠模型,观察银杏内酯注射液对脑中风大鼠恢复期的改善作用,并探究其对神经元自噬的影响,以期为临床治疗脑中风提供新的方法和理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物SD雄性大鼠100只,体质量180~200 g,8周龄,清洁级,由上海斯莱克实验动物有限责任公司提供,动物生产许可证号:SCXK(沪)2018-0003。所有大鼠实验前于室温23~25℃,湿度60%~65%,人工12 h昼/夜循环照明,常规饲养。实验操作均通过医院伦理委员会审查。
1.1.2 主要试剂与仪器 银杏内酯注射液(成都百裕制药股份有限公司,批号:08150802,规格:每盒5支,每支2 mL,含萜类内酯10 mg),奥拉西坦注射液(哈尔滨三联药业股份有限公司,批号:160518B,规格:每盒6支,每支5mL:1.0g),鼠抗神经元特异性核蛋白(neuronal nuclei,NeuN)单克隆抗体(美国Chemicon公司),免疫荧光标记的羊抗鼠IgG抗体(北京中杉金桥生物技术有限公司),兔抗大鼠Beclin-1、P62、微管相关蛋白1轻链3(Microtubule-associated protein 1 light chain 3-Ⅱ,LC3-Ⅱ)单克隆抗体(美国Chemicon公司),辣根过氧化物酶标记的山羊抗兔IgG(美国Thermo Fisher公司),TYU-20C正置型荧光显微镜(上海豫光仪器有限公司)。
1.2 方法
1.2.1 造模及分组100只大鼠随机取80只,采用大脑中动脉栓塞法[5]建立脑中风大鼠模型:术前大鼠禁食不禁水12 h,用3%戊巴比妥钠按30 mg/kg腹腔注射进行麻醉,仰卧固定后,左侧颈部备皮正中切口,分离左侧颈总动脉、颈外动脉及颈内动脉。夹闭颈内动脉及颈总动脉,结扎颈外动脉近心端,在颈外动脉上切一小口自颈内动脉向颅内插入线栓,深度18~20 mm出现阻力时停止插入,固定线栓,结扎切口,松开颈总动脉,逐层缝合皮肤。大鼠清醒后,采用Longa评分法[6]对其进行神经功能缺损评分,评分2~3分为造模成功。评分标准:无神经功能缺损为0分;轻度神经功能缺损(右前肢无法完全伸展)为1分;中度神经功能缺损(行走时向右侧旋转)为2分;重度神经功能缺损(行走时向右侧倾斜)为3分;不能自发行走,有意识障碍为4分。将造模成功的73只大鼠随机分为模型组18只、低剂量组18只、高剂量组18只、阳性对照组19只,其余20只为假手术组,手术方法同上,但不插线栓。
1.2.2 干预方法 造模2 h后进行干预,银杏内酯注射液和奥拉西坦注射液使用前在250 mL无菌生理盐水中稀释,低剂量组腹腔注射1.25 mg/kg银杏内酯注射液,高剂量组腹腔注射2.5 mg/kg银杏内酯注射液,阳性对照组腹腔注射50 mg/kg奥拉西坦注射液,假手术组和模型组腹腔注射无菌生理盐水,共干预14 d。
1.2.3 神经功能评估 各组大鼠干预结束2 d后进行神经功能评估,评分方法同“1.2.1”。
1.2.4 爬杆实验进行运动功能评估 神经功能评估结束后进行爬杆实验,正式测试前2 d,进行预实验,3次/d。将大鼠放在光滑金属管顶部,头向下,使其爬向管底。整个过程用摄像机记录,全部拍摄完,回放录像,按照评分标准计分,每只大鼠爬杆2次,最终计算平均分。爬杆实验评分标准:四肢并用,一次顺利从杆上爬下为0分;一步一步螺旋向下爬行但兼有后肢滑行行为为0.5分;上杆后间歇停顿数次后爬下,但可抱紧金属杆为1分;滑行后掉落为1.5分;不能抓杆,直接掉落为2分。
1.2.5 脑梗死体积评估 爬杆实验结束后,各组随机处死4只大鼠,断头取脑,取出小脑和嗅球,用滤纸擦干表面血迹,置于-20℃冰箱10 min后取出,连续切6个冠状切片,厚度约2 mm,将切片浸入1% TTC染色液中,37℃恒温避光孵育15 min,使脑片均匀着色。经TTC染色后,正常脑组织显示红色,梗死区域显示白色,每一脑片梗死面积乘以2 mm厚度得到一片脑片梗死体积,再将各脑片数值相加后得到梗死总体积,梗死体积百分比=(梗死总体积/脑部总体积)×100%。
1.2.6 NeuN免疫荧光法检测大脑皮层神经元缺失情况 各组随机处死5只大鼠,取出大脑,在10%甲醛溶液浸泡12 h后,20%和30%蔗糖梯度脱水,直至大脑沉底,放4℃保存备用。取出4℃保存的大脑,在大脑皮质顶叶区域进行冠状切片,切片厚度25 μm,将脑切片均匀铺在载玻片上后,-20℃保存备用。对脑切片进行免疫荧光实验,滴加山羊血清封闭液孵育10 min,加入鼠抗NeuN单克隆抗体(1∶1 000)于4℃孵育过夜,0.01 mmol/L PBS冲洗3次,5 min/次,加入羊抗鼠IgG抗体(1∶4000),室温避光孵育1h,0.01mmol/L PBS冲洗3次,5 min/次,中性树胶封片,荧光显微镜观察。每张切片选取4个视野,采用Image-Pro Plus 6.0图像分析系统对NeuN阳性细胞进行计数。
1.2.7 TUNEL染色观察神经细胞凋亡 剩余大鼠全部处死,取脑,分离大脑皮层(各4只)进行切片脱蜡,其余大鼠大脑皮层-80℃保存。0.3% H2O2浸泡5 min,PBS清洗2次,5 min/次;蛋白酶K 37℃,30 min,PBS清洗3次,5 min/次;TUNEL反应液37℃,60 min,PBS清洗3次,5 min/次;3% BSA,20 min,PBS清洗3次,5 min/次;POD转换液37℃湿盒,30 min,PBS清洗5 min;DAB显色5 min,苏木素复染,脱水、透明、封片,置于显微镜下观察大脑皮层神经细胞凋亡情况。每张切片选取4个视野,计算凋亡率,凋亡率=(凋亡细胞数/细胞总数)×100%。
1.2.8 Western Blotting检测大脑皮层Beclin-1、P62和LC3-Ⅱ蛋白相对表达水平 取出-80℃保存的大脑皮层,置于液氮中,加入蛋白提取裂解液,冰上裂解,离心取上清用BCA蛋白定量试剂盒进行定量,95℃水浴使蛋白变性,进行SDS-PAGE凝胶电泳,转膜,5%脱脂牛奶室温封闭2 h,TBST洗膜后分别加入1∶1 000稀释的Beclin-1、P62、LC3单克隆抗体,4℃孵育过夜,TBST洗膜后加入1∶4 000辣根过氧化物酶标记的山羊抗兔IgG,室温孵育1 h,TBST洗膜后加入ECL发光液显影,采用ImageJ软件分析图像,以β-actin为内参,Beclin-1、P62和LC3-Ⅱ蛋白条带灰度值/β-actin蛋白条带灰度值表示蛋白相对表达量。
1.3 统计学方法 采用SPSS 25.0统计学软件分析数据,计量资料以“均数±标准差”(±s)表示,多样本计量资料比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠神经功能缺损评分比较 模型组、低剂量组、高剂量组、阳性对照组大鼠神经功能缺损评分分别为(2.96±0.29)分、(1.77±0.21)分、(1.52±0.17)分、(1.31±0.16)分,神经功能缺损评分组间比较,差异有统计学意义(F=56.534,P<0.001)。与模型组比较,低剂量组、高剂量组和阳性对照组大鼠神经功能缺损评分下降(t=14.101,18.174,21.584,P<0.05);与低剂量组比较,高剂量组和阳性对照组大鼠神经功能缺损评分下降(t=3.926,7.520,P<0.05);与高剂量组比较,阳性对照组大鼠神经功能缺损评分下降(t=3.871,P<0.05)。
2.2 各组大鼠运动功能评分比较 模型组、低剂量组、高剂量组和阳性对照组大鼠运动功能评分分别为(1.56±0.17)分、(1.23±0.13)分、(0.84±0.09)分、(0.51±0.06)分,运动功能评分组间比较,差异有统计学意义(F=45.451,P<0.001)。与模型组比较,低剂量组、高剂量组和阳性对照组大鼠运动功能评分下降(t=6.542,15.881,25.326,P<0.05);与低剂量组比较,高剂量组和阳性对照组大鼠运动功能评分下降(t=10.465,21.825,P<0.05);与高剂量组比较,阳性对照组大鼠运动功能评分下降(t=13.190,P<0.05)。
2.3 各组大鼠脑梗死体积百分比比较 模型组、低剂量组、高剂量组和阳性对照组大鼠脑梗死体积百分比分别为(28.73±2.92)%、(21.13±2.23)%、(16.14±1.65)%、(10.94±1.12)%,脑梗死体积百分比组间比较,差异有统计学意义(F=87.845,P<0.001)。与模型组比较,低剂量组、高剂量组和阳性对照组大鼠脑梗死体积百分比下降(t=4.137,7.508,11.377,P<0.05);与低剂量组比较,高剂量组和阳性对照组大鼠脑梗死体积百分比下降(t=3.598,8.167,P<0.05);与高剂量组比较,阳性对照组大鼠脑梗死体积百分比下降(t=5.215,P<0.05)。(见图1)
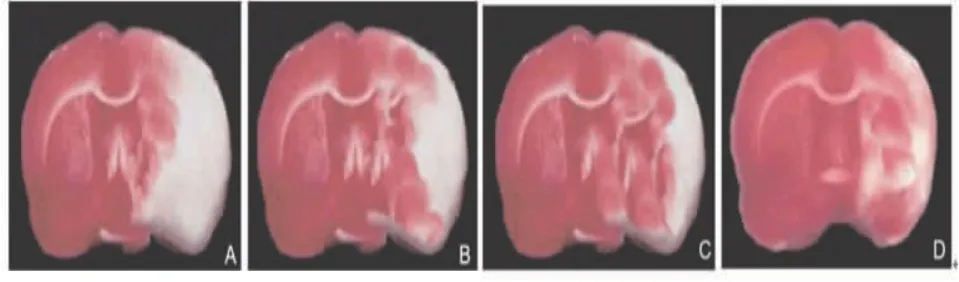
图1 各组大鼠脑梗死体积
2.4 各组大鼠NeuN阳性细胞数量比较NeuN阳性细胞数量组间比较,差异有统计学意义(P<0.05)。与假手术组比较,模型组、低剂量组、高剂量组和阳性对照组大鼠NeuN阳性细胞数量减少(P<0.05);与模型组比较,低剂量组、高剂量组和阳性对照组大鼠NeuN阳性细胞数量增多(P<0.05);与低剂量组比较,高剂量组和阳性对照组大鼠NeuN阳性细胞数量增多(P<0.05);与高剂量组比较,阳性对照组大鼠NeuN阳性细胞数量增多(P<0.05)。(见表1、图2)

图2 各组大鼠NeuN阳性细胞数量比较(×400)
表1 各组大鼠NeuN阳性细胞数量(±s)

表1 各组大鼠NeuN阳性细胞数量(±s)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与低剂量组比较,cP<0.05;与高剂量组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)NeuN阳性细胞数量(个)假手术组 5 - 274.57±19.54模型组 5 - 61.73±7.56a低剂量组 5 1.25 87.72±9.43ab高剂量组 5 2.50 128.86±13.58abc阳性对照组 5 50.00 198.76±20.23abcd F 25.768 P<0.001
2.5 各组大鼠大脑皮层神经细胞凋亡情况 神经细胞凋亡率组间比较,差异有统计学意义(P<0.05)。与假手术组比较,模型组,低剂量组、高剂量组和阳性对照组大鼠神经细胞凋亡率升高(P<0.05);与模型组比较,低剂量组、高剂量组和阳性对照组大鼠神经细胞凋亡率降低(P<0.05);与低剂量组比较,高剂量组和阳性对照组大鼠神经细胞凋亡率降低(P<0.05);与高剂量组比较,阳性对照组大鼠神经细胞凋亡率降低(P<0.05)。(见表2、图3)

图3 各组大鼠大脑皮层神经细胞凋亡情况(×400)
表2 各组大鼠大脑皮层神经细胞凋亡情况(±s)

表2 各组大鼠大脑皮层神经细胞凋亡情况(±s)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与低剂量组比较,cP<0.05;与高剂量组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)神经细胞凋亡率(%)假手术组 4 - 1.46±0.21模型组 4 - 78.45±8.31a低剂量组 4 1.25 43.62±5.38ab高剂量组 4 2.50 24.36±3.24abc阳性对照组 4 50.00 11.53±2.58abcd F 142.632 P<0.001
2.6 各组大鼠大脑皮层Beclin-1、P62和LC3-Ⅱ蛋白相对表达水平比较 大脑皮层Beclin-1、P62和LC3-Ⅱ蛋白相对表达水平组间比较,差异有统计学意义(P<0.05)。与假手术组比较,模型组、低剂量组、高剂量组和阳性对照组大鼠大脑皮层Beclin-1和LC3-Ⅱ蛋白相对表达水平升高,P62蛋白相对表达水平降低(P<0.05);与模型组比较,低剂量组、高剂量组和阳性对照组大鼠大脑皮层Beclin-1和LC3-Ⅱ蛋白相对表达水平降低,P62蛋白相对表达水平升高(P<0.05);与低剂量组比较,高剂量组和阳性对照组大鼠大脑皮层Beclin-1和LC3-Ⅱ蛋白相对表达水平降低,P62蛋白相对表达水平升高(P<0.05);阳性对照组和高剂量组大鼠大脑皮层Beclin-1、P62和LC3-Ⅱ蛋白相对表达水平比较,差异无统计学意义(P>0.05)。(见表3、图4)
表3 各组大鼠大脑皮层Beclin-1、P62和LC3-Ⅱ蛋白相对表达水平(±s)

表3 各组大鼠大脑皮层Beclin-1、P62和LC3-Ⅱ蛋白相对表达水平(±s)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与低剂量组比较,cP<0.05
组别 动物数只 给药剂量()(mg/kg)Beclin-1 P62 LC3-Ⅱ假手术组 5 -模型组 5 -低剂量组 5 1.25高剂量组 5 2.50阳性对照组5 50.00 F 25.744 20.346 18.736 P<0.001 <0.001 <0.001 0.43±0.05 1.46±0.16a 1.20±0.13ab 0.99±0.11abc 0.97±0.09abc 1.01±0.13 0.21±0.02a 0.49±0.05ab 0.75±0.08abc 0.78±0.08abc 0.81±0.09 1.47±0.15a 1.25±0.13ab 0.97±0.10abc 0.99±0.11abc
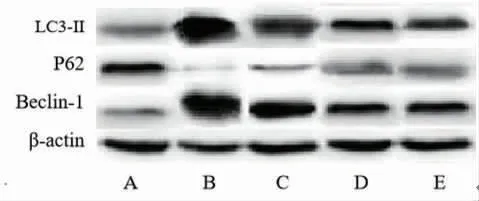
图4 各组Beclin-1、P62和LC3-Ⅱ蛋白相对表达水平
3 讨 论
脑中风是一种突发性脑血管疾病,发病时,脑动脉阻塞,导致大脑局部供血不足,从而使该区域脑组织受损,引起神经功能障碍[7-8]。目前,由于各种条件限制,多数患者不能在中风后关键3 h内接受治疗,而是在急性期进行非手术治疗,在损伤后期依靠神经营养和神经修复。因此,找到理想的恢复期治疗药物成为脑中风研究的关键。银杏是一种具有药用价值的植物。研究表明,银杏内酯注射液及其有效组分可以改善大脑中动脉阻塞模型大鼠急性缺血性脑损伤[9]。奥拉西坦是新型吡咯烷酮类药物,可以促进脑代谢,提高大脑对葡萄糖、氧的利用能力,从而促进神经细胞功能恢复,改善机体和精神行为有关的脑整合机制,在脑中风的治疗中已较为成熟[10]。因此,本研究以奥拉西坦为阳性对照,给予脑中风模型大鼠银杏内酯注射液,观察银杏内酯注射液对脑中风大鼠恢复期的改善作用,旨在为中风恢复期治疗提供新的思路。
银杏内酯注射液主要成分为白果内酯、银杏内酯A、银杏内酯B和银杏内酯C等,白果内酯能维持血管内皮完整性,促进血管内皮增生;银杏内酯A可缓解焦虑、改善心肌缺血、恢复胆碱能损伤记忆功能;银杏内酯B是血小板活化因子拮抗剂,具有抗氧化、延缓衰老、保护受损伤神经元的功能;银杏内酯C可以辅助治疗心、脑血管疾病[11]。研究表明,银杏内酯可以通过降低血脑屏障渗透性、改善脑代谢紊乱、促进良性自噬、抑制神经元凋亡等方面发挥神经保护作用[12]。张佳洁等[13]研究发现银杏内酯注射液治疗急性脑梗死有利于改善血液流变学指标、有效调节血清血管内皮生长因子、血管生成素-Ⅱ和胶质纤维酸性蛋白含量,改善神经功能,效果显著。吴勇等[14]研究发现银杏内酯注射液辅助治疗老年缺血性脑卒中能有效减轻患者神经功能缺损程度,提高患者生活能力。本研究中银杏内酯注射液治疗脑中风大鼠后,大鼠神经功能缺损评分、运动功能评分、脑梗死体积百分比和神经细胞凋亡率明显降低,NeuN阳性细胞增多,对脑中风大鼠恢复期的改善作用明显。
自噬是真核细胞中广泛存在的溶酶体依赖降解途径,是细胞自我保护的重要机制,在维持细胞存活、更新、胞内组分再利用和内部环境稳定方面发挥重要作用[15-16]。Beclin-1是哺乳动物细胞酵母自噬相关基因Atg6的同源基因,其上调提示自噬被激活;LC3是Atg8的同源基因,LC3-Ⅱ表达水平及LC3-Ⅱ/Ⅰ比值大小可反映自噬水平的高低;P62是特异性自噬途径降解蛋白,其表达水平与自噬激活程度成反比[17-18]。本研究中模型组Beclin-1和LC3-Ⅱ蛋白表达水平明显增强,P62蛋白表达水平显著降低,表明脑中风后神经元自噬被过度激活。潘思敏等[19]研究发现缺血性脑卒中再灌注后神经细胞损伤严重,药物治疗后自噬相关蛋白Beclin-1、LC3-Ⅱ下调,提示缺血性脑卒中再灌注的神经细胞损伤与过度自噬有关。研究发现,银杏内酯注射液能抑制大脑中动脉阻塞大鼠缺血复灌后LC3-Ⅰ向LC3-Ⅱ转化,以及自噬底物P62水平降低,阻止自噬水平过度升高,提示银杏内酯注射液具有治疗缺血性脑卒中急性期神经损伤的作用,是通过抑制缺血再灌后内质网应激和过度自噬发挥作用的[20]。本研究得到类似结果,腹腔注射银杏内酯注射液后,低剂量组与高剂量组Beclin-1和LC3-Ⅱ下调,P62上调,提示银杏内酯注射液可能通过抑制神经元过度自噬从而发挥对神经细胞的保护作用。
综上所述,银杏内酯注射液对大鼠脑中风恢复期具有改善作用,而且可能通过抑制神经元过度自噬发挥对神经细胞的保护作用,为临床治疗提供了一定的理论依据。

