创新考查视角 提升思维能力
——分压平衡常数相关试题分析及备考建议
>>>李 倩
分压平衡常数是近几年高考化学试题中的高频考点,它是浓度平衡常数的延伸。 该类试题通过气相反应的分压平衡常数考查考生灵活运用已有知识解决陌生问题的能力。 由于考查的情境真实复杂、信息陌生新颖、计算量大,导致大部分考生用时较长、计算出错,因此具有较好的效度和区分度,有利于实现高考服务选材、引导教学的功能。 2021 年的高考试题,更加大了分压平衡常数的考查力度,尤其是在考查角度的创新方面,比以往有了很大的提升, 实现了对考生关键能力的多角度考查。本文以2021 年高考分压平衡常数试题为例,从考点内容、呈现形式和思维方式三个方面对其创新性进行分析研究,寻找解题策略,并提出相应的备考建议。
一、认识分压平衡常数(Kp)
1.分压平衡常数(Kp)的含义
人教版化学选修教材《化学反应原理》中关于化学平衡常数的定义为:“在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,简称平衡常数。 ”由于平衡常数是用平衡时各物质的物质的量浓度来计算的,因此又被称为浓度平衡常数,用符号Kc或K 表示。对于气相反应,若将上述定义中各气体的平衡浓度用平衡时各气体的分压来代替进行计算, 也可得到一个常数——分压平衡常数,用符号Kp表示。
(1)气体的分压p(B)
混合气体中气体b 的分压:p(b)=p·x(b),其中x(b)为气体b 的体积分数或物质的量分数,p 为混合气体在相同温度下平衡时刻的总压强。
(2)分压定律
混合气体的总压等于相同温度下各组分气体的分压之和p(A)+p((b)+p(C)+p(D)+…=p。
2.分压平衡常数(Kp)与浓度平衡常数(Kc)的关系

二、分压平衡常数(Kp)的考查视角
下表是近三年高考试题中关于分压平衡常数题的考查方式统计:

?
通过对近三年高考试卷的统计发现,从2019 年至2021 年, 分压平衡常数的考查比重逐年增加,在知识内容、考查形式、试题呈现方式等方面都有不同程度的创新,能力要求不断提升,可以说是“常考常新”。
1.考查知识点创新

(1)列出分压平衡常数(Kp)表达式
【典例1】(2021 年全国甲卷,28 题节选)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。 回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
该反应一般认为通过如下步骤来实现:
①CO(g)+H2(g)=CO(g)+H2O(g)
△H2=+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g)
△H2=-90kJ·mol-1
(2) ①用各物质的平衡分压表示总反应的平衡常数,表达式Kp= ;



(3)计算标准平衡常数(kθ)
【典例3】氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法Ⅰ:氨热分解法制氢气
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下, 将0.1molNH3通入3 L 的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
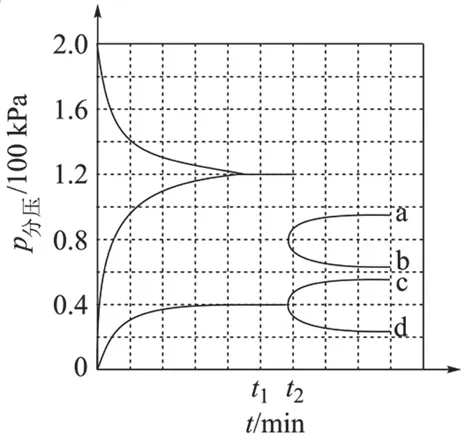


【解题策略】无论是对哪种形式的分压平衡常数的考查,只要按照题中的要求,将分压代入计算公式即可。 在解题过程中注意看清题目的书写要求,同时还要认真观察图像的坐标,看清单位和数据。
2.试题呈现形式创新
关于分压平衡常数的考查形式, 以往主要通过文本和信息化方程式的形式呈现。在2021年的高考试卷中,还增加了坐标曲线和函数图象,更加注重各种信息的综合使用,考查考生从不同角度提取、分析、处理信息的能力。 这一创新突出体现在湖南卷和广东卷上。
(1)分压——时间图象
【典例4】试题见典例3。
【解题思路】 通过观察横纵坐标的含义发现,随着时间的变化,各组分的分压在不断变化,在t1时刻达到平衡状态。 直接从图像上读取分压数据,注意单位,可以进行快速计算。

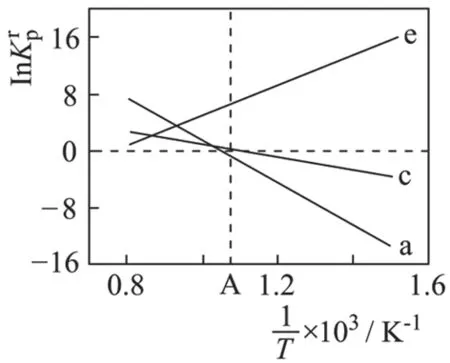
①反应a、c、e 中,属于吸热反应的有_____(填字母)。


【解题策略】明确坐标含义,关注曲线走势及特殊点,对获取的数据信息进行加工运用。
3.解题思维方向创新
关于分压平衡常数的考查方向, 以往只是通过表达式进行数据计算,考生难以体会其在工业生产方面的实际应用价值。2021 年的高考试题考查要求更高,由计算分压平衡常数升级为应用分压平衡常数探寻生产条件。 从正向思维转变为逆向思维,从依据公式计算转变为解决实际问题,对考生综合能力、创新能力的要求更高。 这种创新在全国乙卷、河北卷、广东卷中体现明显。
(1)应用分压平衡常数(Kp)求气体分压
【典例6】(2021 年全国乙卷,28 题节选)一氯化碘(ICl) 是一种卤素互化物, 具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。 回答下列问题:
(2)氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt 和Cl2,376.8℃时平衡常数K'p=1.0×104Pa2。 在一硬质玻璃烧瓶中加入过量BaPtCl6,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。 在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5KPa,则pICl=________kPa。

则376.8℃平衡时, 测得烧瓶中压强为32.5kPa,则0.1+20.0+p=32.5,解得p=12.4,则平 衡 时pICl=2×12.4kPa=24.8kPa。 故 答 案 为24.8kPa。
【典例7】当今,世界多国相继规划了碳达峰、碳中和的时间节点。 因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(3)105℃时, 将 足 量 的 某 碳 酸 氢 盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s)M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。保持温度不变, 开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于 ____ kPa。

(2)应用相对压力平衡常数(krp)求转化率
【典例8】试题部分内容见典例2。
③在图中A 点对应温度下、 原料组成为n(CO2):n(CH4)=1:1、初始 总压 为100kPa 的恒容密闭容器中进行反应, 体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程 。

(3)应用Kc与Kp的关系求K
【典例9】(2021 年全国乙卷,28 题节选)(2)氯铂酸钡 (BaPtCl6) 固体加热时部分分解为BaCl2、Pt 和Cl2,376.8℃时平衡常数k'p=1.0×104Pa2,在一硬质玻璃烧瓶中加入过量BaPtCl6,抽真空后,通过一支管通入碘蒸气(然后将支管封闭), 在376.8℃, 碘蒸气初始压强为20kPa。376.8 ℃平衡时,测得烧瓶中压强为32.5kPa,则pICl=24.8kPa,反应2ICl(g)Cl2(g)+I2(g)的 平 衡常数K=_______(列出计算式即可)。
(3)McMorris 测定和计算了在136~180℃范围内下列反应的平衡常数Kp。

【解题策略】应用分压平衡常数解题的关键:温度不变,分压平衡常数不变。 因此,压力平衡常数就可作为解题的关键桥梁, 再结合分压定律、 阿伏伽德罗定律推论进行综合处理。
三、复习备考建议
1.注重知识理解,把握概念本质
分压平衡常数表述抽象但内涵丰富, 只有掌握了概念的本质, 才能深刻领悟概念内涵,寻找概念之间的关联,建立知识网络,为灵活应用分压平衡常数解决实际工业生产问题建立基础。
2.建立思维模型,提高解题能力
分压平衡常数也是化学平衡常数的一种,同样具有特定的解题模式。 大多数解题过程都离不开三段式的计算方法。 主要有以下几个思维过程:获取信息→寻找反应→列出三段式→列式计算。
3.关注题目信息,寻找解题技巧
限定条件为恒温恒容时可以运用物质的量列三段式,再代入Kp表达式进行计算。 也可以直接运用分压带入三段式进行计算,后者过程简捷,出错率低,更为快速。 而在恒温恒压条件下,只能运用物质的量列三段式,再运用分压公式进行计算。
4.设置专项练习,重视新颖试题
在复习分压平衡常数专题时, 要重视试题的创新性, 将不同的表示形式进行汇总, 比如还可以加入物质的量分数平衡常数(Kx)的训练。 降低学生对陌生概念的恐惧感。
5.加强学科融合,准确获取信息
化学试题中的图像多与数学学科的知识有关,要注意将其中的简化定量思想引入化学学科,提升学生读图获取信息的能力。
6.实行问题导学,转变教学模式
在复习课上, 要转变枯燥的学习方式,设置真实的问题情境,将具体的知识和方法转化为精准的问题, 让学生在解决问题的过程中,达到对知识的灵活运用,并逐渐提升解决问题的能力,提升思维的品质。

