谷物中具有抑制霉菌活性乳酸菌的分离筛选及鉴定
丁宁,陆兆新,别小妹,吕凤霞,赵海珍
(南京农业大学食品科学技术学院,江苏 南京 210095)
霉菌是真菌的一类,具有菌丝体发达、分布范围广和可产毒素等特点。最新研究表明,60%~80%的农产品中均可检测到霉菌毒素[1]。谷物是农产品中最常见的易被污染产品,引起霉菌污染的途径包括从生长、收获、储存到加工的全过程[2]。被霉菌污染后农产品的质地、颜色和营养价值损失,霉菌产生的霉菌毒素更会导致急性和慢性中毒[3]。近年来,国内外关于霉菌及霉菌毒素污染谷物造成重大损失的相关报道也在逐年增加[4]。我国是农业生产大国,谷物产量位于世界前列,因此明确霉菌污染谷物的特征及寻找科学有效的霉菌污染防治方法对推动我国农产品质量安全与农业产业高质量发展具有重要意义。
关于抑制霉菌生长和毒素降解的方法有很多,主要可分为物理方法、化学方法、生物方法及组合方法[5]。其中,生物方法指微生物及其代谢产物、植物提取物的使用,具有环境友好、高效率和可以运用于食品的优点。近年来,关于乳酸菌抑制霉菌及降解霉菌毒素的研究逐渐增多,展现了乳酸菌对霉菌抑制的巨大潜力。在抑制霉菌方面,Cizeikiene等[6]研究表明乳酸菌在生长过程中可产生具有抑制霉菌活性的物质;Franco等[7]从小麦中分离出可抑制禾谷镰刀菌的乳酸菌。此外,Zhao等[8]筛选出1株通过拮抗作用抑制黄曲霉的植物乳杆菌,转录组学研究发现植物乳杆菌通过抑制黄曲霉细胞壁多糖的合成从而抑制黄曲霉。抑制霉菌毒素最有效的方法是抑制产毒素霉菌的生长从而防止毒素污染,此外还有些乳酸菌可以结合毒素从而去除毒素。Peltonen等[9]研究发现多株乳酸菌菌株可与黄曲霉毒素B1结合。
乳酸菌作为一种安全的生物防腐剂已获得美国食品药品监督管理安全认定(Generally Recognized as Safe,GRAS)认证以及欧盟食品安全资格认定(Qualified Presumption of Safety,QPS)认证,并被应用于多种食品中[10]。关于乳酸菌应用于谷物的研究也不断增加[11-12],这些乳酸菌的来源通常为泡菜[13]、发酵乳制品和酸面团[14],很少有从谷物中筛选具有抑制霉菌活性的乳酸菌。因此本文以谷物为原料筛选具有抑制霉菌活性的乳酸菌,分析发酵液中的抑制霉菌物质,为乳酸菌作为谷物生物防腐剂运用提供基础。
1 材料与方法
1.1 试验材料
1.1.1 样品与菌种谷物样品:小麦麸皮来自不同产地,包括江苏(J、Jm,其中Jm为第2批筛选菌株,下同)、甘肃(G、Gm)、山西(S、Sm)、河南(H、Hm)和内蒙古(N、Nm);南京市售其他谷物,包括玉米颗粒(A)、面粉(F)、糯米粉(M)、荞麦粉(Q)、黄豆粉(D)、青稞(K)和燕麦(Y)。菌种:黄曲霉(A.flavusCICC2062)、禾谷镰刀菌(F.graminearum2021)由南京农业大学食品科学技术学院酶工程实验室保存。
1.1.2 培养基MRS液体培养基:蛋白胨10.0 g,牛肉膏10.0 g,酵母粉5.0 g,柠檬酸氢二胺2.0 g,葡萄糖20.0 g,吐温80 1.0 mL,三水合乙酸钠5.0 g,三水合磷酸氢二钾2.0 g,七水合硫酸镁0.58 g,一水合硫酸锰 0.25 g,蒸馏水1 000 mL,调节pH值至6.0~6.2。MRS固体培养基:在MRS液体培养基中加入琼脂18.0 g,蒸馏水1 000 mL。PDA培养基:土豆200.0 g,葡萄糖20.0 g,琼脂10.0 g,蒸馏水1 000 mL。
1.2 试验方法
1.2.1 谷物中乳酸菌的分离与纯化使用富集法分离谷物中的乳酸菌[15]。将0.5 g谷物样品加入5 mL MRS液体培养基中,30 ℃静置培养72 h。培养后使用无菌蛋白胨水(2 g·L-1)将悬浮液梯度稀释至10-5、10-6和10-7倍,并吸取50 μL至MRS固体平板涂布,30 ℃培养48 h,从每个平板中随机取出10%不同形态的菌落。在MRS固体平板上反复划线筛选,选取单一菌落,进一步划线分离纯化。分离菌株在20%(体积分数)甘油中保存。
1.2.2 筛选乳酸菌的初步鉴定通过溶钙圈、革兰氏染色以及过氧化氢酶对分离纯化后的菌株进行初步鉴定。菌液接种至含有10 g·L-1CaCO3的MRS固体培养基,30 ℃培养72 h,观察是否产生溶钙圈;吸取菌液进行革兰氏染色、镜检,红色为革兰氏阴性,紫色为革兰氏阳性;挑取菌落,滴加3%(体积分数)过氧化氢溶液,有气泡产生为阳性,无气泡产生为阴性。产生溶钙圈、革兰氏阳性和过氧化氢酶阴性的菌株初步定为乳酸菌。
1.2.3 抑制霉菌活性乳酸菌的初步筛选1)霉菌孢子液的制备[16]。选择在谷物污染中最常见的禾谷镰刀菌和黄曲霉作为乳酸菌抑制霉菌活性检测的指示菌。将待试的禾谷镰刀菌和黄曲霉分别接种在PDA平板上,30 ℃恒温培养7 d至产生大量孢子。加入5 mL含 0.08%(体积分数)吐温80的无菌水并用接种环轻轻刮取,收集孢子液,充分振荡后使用无菌脱脂棉过滤去除菌丝。去除菌丝的孢子悬液使用血球计数板测定浓度,调整浓度至106mL-1,4 ℃保存备用。
2)具有抑制霉菌活性乳酸菌的筛选。使用双层平板法筛选对霉菌具有抑制活性乳酸菌的测定[17],并稍作修改。将2 μL乳酸菌接种在MRS固体平板上,30 ℃培养48 h。培养期结束后,在平板上覆盖PDA培养基,涂布20 μL已制备的霉菌孢子液,并在30 ℃进一步培养72 h。游标卡尺测量乳酸菌菌落周围的生长抑制区。
1.2.4 乳酸菌发酵液对霉菌孢子抑制活性的测定1)乳酸菌发酵液(CFS)的制备。乳酸菌活化后培养20 h(菌浓度约为2×109CFU·mL-1),再以2%接种量接种至MRS液体培养基,在30 ℃静置培养48 h,培养期结束后将发酵液以8 000 r·min-1离心10 min,取上清液,用0.22 μm微孔滤膜过滤除去菌体。
2)96孔板法测定乳酸菌发酵液对2种霉菌孢子的抑制率[18]。取10 μL霉菌孢子悬浮液(106mL-1)加入不同体积的发酵液中,用MRS培养基将最终体积调整为200 μL。以接种霉菌孢子悬液于MRS培养基作为对照。将96孔板在30 ℃培养72 h后用酶标仪测定617 nm处的吸光度。乳酸菌发酵液的孢子抑制率计算公式为:
抑制率=100-(DLAB×100/Dc)×100%。
式中:DLAB表示2种霉菌在乳酸菌发酵液中培养72 h的吸光度值;Dc表示2种霉菌在MRS培养基中培养72 h后的吸光度值。
1.2.5 乳酸菌菌株鉴定利用DNA抽提试剂盒提取乳酸菌的基因组DNA,并进行PCR扩增。扩增引物为细菌16S rDNA通用引物27f和1495r,琼脂糖凝胶电泳检测PCR产物,然后使用Sanger法测定16S rDNA序列(金唯智生物技术有限公司)。将测序结果与美国国立生物技术信息中心(NCBI)GenBank数据库进行比对,找出同源性最高菌株,并使用MEGA 7软件进行序列对比、绘制系统发育树。
1.2.6 乳酸菌抑制霉菌有效物质分析1)调节pH值对发酵液抑制霉菌活性的影响。用2 mol·L-1NaOH溶液分别调节发酵液pH值至4.0、5.0和6.0,采用96孔板法测定处理后的发酵液对霉菌孢子的抑制率,以未调整pH值的发酵液作为对照。
2)蛋白酶处理对发酵液抑制霉菌活性的影响。采用萨如拉[19]的方法并稍作修改。取等量乳酸菌发酵液3份,调节pH值分别至3种酶的最适pH值(胰蛋白酶为7.4,木瓜蛋白酶为6.0,胃蛋白酶为2.0),再分别加入胰蛋白酶、木瓜蛋白酶和胃蛋白酶在30 ℃处理1 h(蛋白酶终质量浓度为 1.0 mg·mL-1),再 65 ℃加热5 min使蛋白酶失活。调节pH值至初始值,采用96孔板法测定处理后的发酵液对霉菌孢子的抑制率,以未添加蛋白酶的发酵液作为对照。
3)高温处理对发酵液抑制霉菌活性的影响。为测定热稳定性,将发酵液放置沸水中加热10、20、30和40 min,然后冷却至室温,采用96孔板法测定处理后的发酵液对霉菌孢子的抑制率,以未加热的发酵液作为对照。
1.2.7 HPLC法测定发酵液中有机酸含量1)有机酸标准溶液配制及标准曲线绘制。使用柠檬酸、酒石酸、苹果酸、琥珀酸、富马酸、乙酸、乳酸和苯乳酸标准品分别配制0.002~10 mg·mL-1不同浓度的有机酸标准品,HPLC检测其峰面积。以有机酸浓度为横坐标,峰面积为纵坐标,绘制有机酸的标准曲线。
2)HPLC检测条件。苯乳酸色谱条件[20]:梯度洗脱高效液相色谱分析。检测器:紫外检测器;检测波长:210 nm;色谱柱:Agilent ZORBAX SB-C18柱(25 cm×4.6 mm,5 μm);柱温:25 ℃;进样量:20.0 μL;流速:1.0 mL·min-1;流动相:A相为0.05%(体积分数)三氟乙酸甲醇溶液,B相为0.05%三氟乙酸溶液。洗脱程序:0~20 min为A相与B相的体积比由10%线性变化为100%,20~23 min为100% A相,23~25 min保持A相与B相的体积比为10%。其他酸的色谱条件:等比例高效液相色谱分析,采用Bukhari等[21]的方法并稍作修改。检测器:紫外检测器;检测波长:215 nm;色谱柱:Agilent ZORBAX SB-C18柱(25 cm×4.6 mm,5 μm);柱温:25 ℃;进样量:20.0 μL;流速:0.6 mL·min-1;流动相:0.1%(体积分数)磷酸与甲醇混合液(体积比为97∶3);洗脱时间:20 min。
3)戊糖片球菌Y5发酵液中有机酸的抑制霉菌作用。向MRS培养基中添加不同质量浓度的乳酸(0.5~4.0 mg·mL-1)、乙酸(0.5~4.0 mg·mL-1)、柠檬酸(0.5~4.0 mg·mL-1)、琥珀酸(0.5~4.0 mg·mL-1)和苯乳酸(0.05~4.00 mg·mL-1),96板法测定其对黄曲霉孢子的抑制率。配制与戊糖片球菌Y5发酵液中各种有机酸浓度相同的混合溶液,调节pH值至与发酵液相同(pH值3.7),测定其对黄曲霉孢子的抑制率。
1.2.8 戊糖片球菌Y5发酵液中蛋白类抑制霉菌物质的分析1)戊糖片球菌Y5发酵液中抑制霉菌物质的粗提及其对黄曲霉孢子的抑制活性。采用酸沉法分离提取戊糖片球菌Y5发酵液中的抑制霉菌物质[22]。调节发酵液pH值至2.0,4 ℃下静置过夜。静置后,发酵液在4 ℃下8 000 r·min-1离心15 min,取沉淀,用蒸馏水复溶。抑制霉菌物质粗提液用木瓜蛋白酶、胰蛋白酶处理后,再用96孔板法测定其对黄曲霉孢子的抑制率。2)戊糖片球菌Y5发酵液中粗提抑制霉菌物质的傅里叶红外光谱。将抑制霉菌粗提物冻干样品与KBr按质量比 1∶100混合研磨,使用傅里叶红外光谱仪测定。测定条件:分辨率为4 cm-1,扫描波数为4 000~400 cm-1。3)戊糖片球菌Y5发酵液中粗提抑制霉菌物质的SDS-PAGE凝胶电泳。电泳条件为浓缩胶5%,分离胶12%;浓缩胶工作电压80 V,分离胶工作电压140 V。糖蛋白染色采用高碘酸-硝酸银染色法[23]。糖化酶作为阳性对照,乳清蛋白作为阴性对照,样品为抑制霉菌粗提物以及胰蛋白酶处理后的抑制霉菌粗提物。电泳结束后,凝胶用10%(体积分数)乙酸和25%(体积分数)异丙醇溶液固定30 min,加入10 g·L-1高碘酸溶液4 ℃反应1 h,反应完毕后使用蒸馏水反复冲洗(约3 h),使用250 mL 2.5 g·L-1硝酸银溶液银染10 min(使用前加入100 μL 37%甲醛),蒸馏水水洗3次,再用250 mL 25 g·L-1无水碳酸钠溶液显色(使用前加入50 μL 37%甲醛),在乳清蛋白变色前使用14.6 g·L-1EDTA二钠溶液浸泡10 min终止反应。蛋白或多肽使用考马斯亮蓝R250染色,样品为抑制霉菌粗提物以及胰蛋白酶处理后的抑制霉菌粗提物。电泳结束后,凝胶使用1 g·L-1考马斯亮蓝染色液染色2 h,再脱色过夜。
1.3 数据处理
采用SPSS 21.0软件的单因素方差分析(ANOVA)对数据进行分析。
2 结果与分析
2.1 乳酸菌的分离纯化
从5种产地的小麦麸皮以及玉米颗粒、面粉、糯米粉、荞麦粉、黄豆粉、青稞、燕麦样品中共分离得到纯培养物178株。乳酸菌菌株菌落直径较小,形态呈规则圆形,表面光滑湿润;大多数为白色或乳白色,少量为半透明;挑取时具有一定黏性。
2.2 乳酸菌的生理生化鉴定
乳酸菌发酵产生的酸可与MRS固体培养基中CaCO3反应,在乳酸菌菌落周围形成透明圈,10株菌落周围无透明圈,不具备产酸能力。革兰氏染色镜检中,27株菌为革兰氏阴性;革兰氏阳性菌的细胞形态大多数为球状,少量为杆状。过氧化氢酶试验中仅有3株为过氧化氢酶阳性。综上,在分离出的178株菌株生理生化鉴定中有139株初步被判定为乳酸菌。
2.3 具有抑制霉菌活性乳酸菌的初步筛选
由表1可见:在139株菌株中,12株菌对黄曲霉的抑制透明圈半径大于3 mm,分别为Jm6、Nm11、Sm8、Q7、Y9、Y5、Q4、K1、H7、Q5-1、S2、S9;14株菌对禾谷镰刀菌的抑制透明圈半径大于3 mm,分别为Jm11、Hm1、Hm9、Nm4、Sm1、Sm7、S1、N6、H9、D1、Y2、Q6-2、S6、Sm12。共筛选出26株可对霉菌有高抑制作用的乳酸菌。图1-a为菌株Q7对黄曲霉的抑制透明圈,半径大于3 mm;图1-b为菌株Hm9对禾谷镰刀菌的抑制透明圈,半径大于3 mm。

表1 双层平板法筛选乳酸菌对黄曲霉和禾谷镰刀菌的抑制透明圈Table 1 Inhibition zone of lactic acid bacteria against Aspergillus flavus and Fusarium graminearum by dual culture overlay technique

图1 乳酸菌对2种霉菌的抑制透明圈Fig.1 Clear zone of inhibition of lactic acid bacteria against two kinds of moulda.Q7对黄曲霉的抑制透明圈Clear zone of inhibition of Q7 against A.flavus;b.Hm9对禾谷镰刀菌的抑制透明圈Clear zone of inhibition of Hm9 against F.graminearum.
2.4 乳酸菌发酵液对霉菌孢子的抑制活性分析
由表2和表3可见:随乳酸菌发酵液比例上升,其对黄曲霉孢子萌发的抑制率逐渐上升,其中S2、S9、Y5和Y9在发酵液比例为50%时,抑制率达99%以上;随乳酸菌发酵液比例上升,其对禾谷镰刀菌孢子的抑制率上升,其中Sm1、Sm12、S6和N6在发酵液体积比为50%时,抑制率达99%以上。从26株乳酸菌共筛选出8株对霉菌孢子抑制效果较好的菌株。
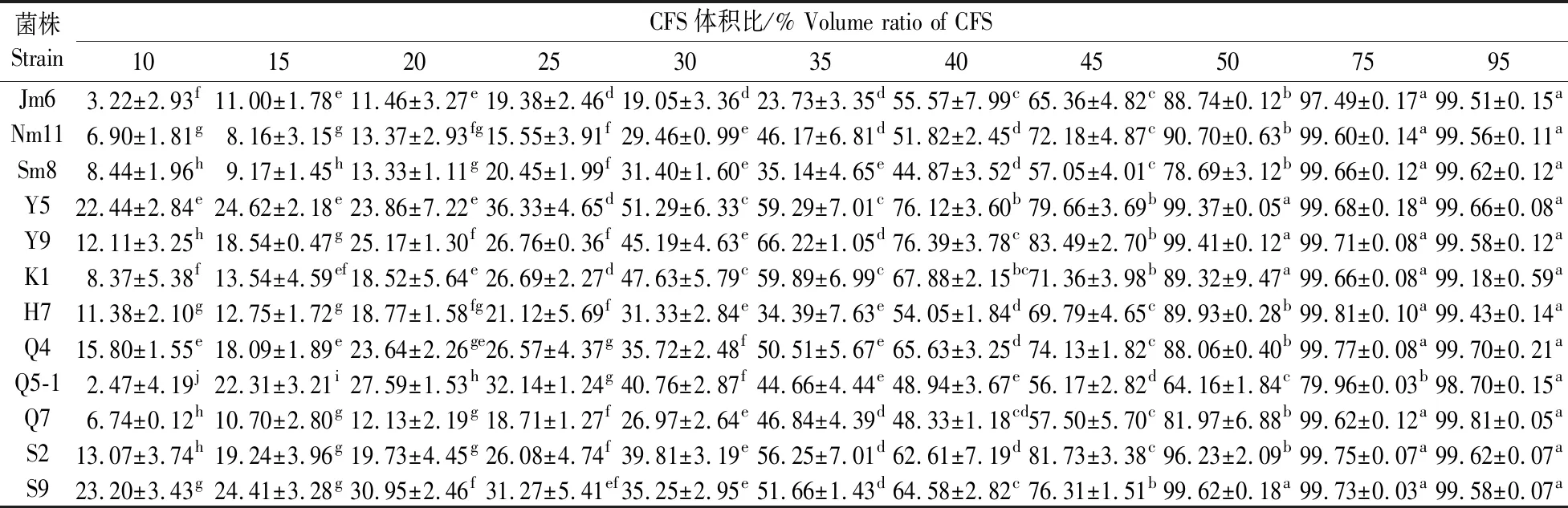
表2 96孔板法测定乳酸菌发酵液对黄曲霉孢子的抑制率Table 2 Inhibition ratio of lactic acid bacteria in the cell free supernatant(CFS)against A. flavus spores germination on 96-well plate %

表3 96孔板法测定乳酸菌发酵液对禾谷镰刀菌孢子的抑制率Table 3 Inhibition ratio of lactic acid bacteria in the cell free supernatant(CFS)against F.graminearum spores germination on 96-well plate %
2.5 筛选乳酸菌的鉴定
将测得的序列在NCBI GenBank数据库中进行比对,测序结果显示从谷物中筛选的8株抑制霉菌活性较好的菌株均属于片球菌属,与镜检结果一致,系统发育树见图2。其中N6、S2和Y9属于乳酸片球菌,分别与乳酸片球菌(Pediococcusacidilactici)菌株5560、JY1R1和 8275基因序列相似度均在99%以上;而Y5、Sm12、Sm1、S6和S9为戊糖片球菌,与戊糖片球菌(Pediococcuspentosaceusstrain)菌株opq3和6108基因序列相似度均在99%以上。

图2 8株乳酸菌的系统发育树Fig.2 Phylogenetic tree of 8 strains of lactic acid bacteria
2.6 乳酸菌发酵液中抑制霉菌有效物质分析
由表4可知:与未处理发酵液相比,在调节发酵液pH值至4时,抑制率下降但不显著(P>0.05);而发酵液pH值调节至5和6时,发酵液的抑制率均显著下降(P<0.05)。因此,乳酸菌发酵液对霉菌孢子的抑制活性受pH值的影响大。8株乳酸菌发酵液经蛋白酶处理后,7株乳酸菌发酵液对霉菌孢子的抑制率没有显著改变,而戊糖片球菌Y5发酵液在木瓜蛋白酶、胰蛋白酶处理后对黄曲霉孢子的抑制率显著下降。因此推测戊糖片球菌Y5发酵液中可能存在对胰蛋白酶、木瓜蛋白酶敏感的多肽类物质,而其他7株乳酸菌发酵液中不存在。高温处理中,发酵液在沸水浴中处理10、20、30和40 min后,对霉菌孢子的抑制率无显著改变,因此发酵液中抑制霉菌有效物质的热稳定性较高。

表4 不同处理方式对乳酸菌发酵液抑制霉菌孢子活性的影响Table 4 Effects of different treatments on the antifungal activities of lactic acid bacteria in the cell free supernatant(CFS)
2.7 乳酸菌发酵液中有机酸含量测定
2.7.1 乳酸菌发酵液中有机酸含量发酵液的高效液相色谱分析结果(表5)显示,8株乳酸菌发酵液中均可检测到多种有机酸,但有机酸种类和含量存在差异。发酵液中均存在的有机酸有乳酸、乙酸、柠檬酸和琥珀酸,其中含量超过1 mg·mL-1的为乳酸、乙酸和柠檬酸,乳酸最高含量为(5.61±0.49)mg·mL-1,乙酸最高含量为(3.29±0.27)mg·mL-1,柠檬酸最高含量为(1.68±0.29)mg·mL-1。其他有机酸含量较低或检测不到,例如在S2、S9、Sm1和Sm12发酵液中检测到了苹果酸,而其他发酵液中没有。

表5 8株乳酸菌发酵液中各种有机酸的含量Table 5 Contents of organic acids in the cell free supernatant(CFS)of 8 strains of lactic acid bacteria mg·mL-1
2.7.2 戊糖片球菌Y5发酵液中有机酸的抑制霉菌活性分析由图3可见:有机酸质量浓度低于1.5 mg·mL-1时,5种有机酸中琥珀酸对黄曲霉孢子的抑制率最高,质量浓度高于1.5 mg·mL-1时,乙酸的抑制作用最佳。以戊糖片球菌Y5发酵液为标准配制的有机酸混合溶液对黄曲霉孢子的抑制率为(76.77±0.58)%,高于对应相同浓度单一有机酸的抑制率,因此戊糖片球菌Y5发酵液中有机酸对黄曲霉孢子的抑制作用是多种有机酸共同作用的结果。有机酸混合溶液的抑制率低于发酵液的抑制率(86.80±0.30)%,推测这是由于戊糖片球菌Y5发酵液中存在对蛋白酶敏感的其他抑制霉菌物质。

图3 不同质量浓度有机酸对黄曲霉孢子的抑制率Fig.3 Inhibition rate of organic acids in different concentrations against A. flavus spores
2.8 戊糖片球菌Y5发酵液中蛋白类抑制霉菌物质的分析
调节戊糖片球菌Y5发酵液pH值至2.0,分离蛋白类物质,结果表明复溶后含蛋白质粗提物的溶液具有抑制霉菌活性,抑制率为(77.71±5.31)%。而复溶溶液经木瓜蛋白酶和胰蛋白酶处理后,抑制率均有所下降,尤其在胰蛋白酶处理后,抑制率下降至(14.83±2.72)%。因此,戊糖片球菌Y5发酵液粗提物中主要的抑制霉菌物质为蛋白类物质。


图4 戊糖片球菌Y5抑制霉菌粗提物的傅里叶红外光谱Fig.4 FTIR spectrum of antifungal substances crude extract of Pediococcus pentosaceus Y5
使用SDS-PAGE凝胶电泳以及高碘酸-硝酸银染色确认粗提物中的抑制霉菌物质,结果见图5-a。戊糖片球菌Y5的抑制霉菌粗提物在丙烯酰胺凝胶上出现条带,且位置高于糖化酶,而在胰蛋白酶处理后条带明显下移。由于糖化酶的相对分子质量为(60~100)×103[26],因此戊糖片球菌Y5发酵液中的抑制霉菌物质为相对分子质量大于60×103。考马斯亮蓝染色结果见图5-b,抑制霉菌粗提物在胰蛋白酶处理后出现相对分子质量小于25×103和18×103的条带,胰蛋白酶水解抑制霉菌粗提物后可产生低分子量的蛋白或多肽。因此,戊糖片球菌Y5发酵液中对蛋白酶敏感的抑制霉菌物质为糖蛋白。

图5 戊糖片球菌Y5抑制霉菌粗提物的SDS-PAGE凝胶电泳Fig.5 SDS-PAGE gel electrophoresis of P.pentosaceus Y5 antifungal substances crude extracta.抑制霉菌粗提物SDS-PAGE凝胶电泳的高碘酸-硝酸银染色(1.乳清蛋白,2.糖化酶,3.粗提物,4.胰蛋白酶处理物);b.抑制霉菌粗提物SDS-PAGE凝胶电泳的考马斯亮蓝染色(1.胰蛋白酶处理物,2.粗提物,M.蛋白分子量标准)。a. The crude extract with periodic acid-silver nitrate staining after SDS-PAGE gel electrophoresis(1.Whey protein,2. Glycosylase,3. Crude extract,4. Trypsin treatment);b. The crude extract with coomassie blue staining after SDS-PAGE gel electrophoresis(1.Trypsin treatment,2. Crude extract,3. Marker).
3 讨论
本研究从谷物中共筛选出26株对霉菌菌丝抑制透明圈半径达3 mm以上的乳酸菌,其中8株乳酸菌发酵液对霉菌孢子的抑制率在体积比50%时达99%以上。这不仅比本研究中其他乳酸菌表现出的抑制霉菌活性更强,而且强于其他一些研究中的乳酸菌菌株,例如马欢欢等[27]筛选出1株可抑制黑曲霉的植物乳杆菌,在发酵液体积比95%时抑制率为92.5%。经16S rDNA鉴定,筛选出的8株菌为乳酸片球菌(N6、S2和Y9)和戊糖片球菌(Y5、S9、Sm1、Sm12和S6)。
乳酸菌已被证明可通过产生有机酸[21]、脂肪酸和环二肽[28]等具有抗真菌活性的化合物而起到抑制霉菌的作用。本试验使用不同pH值、蛋白酶和高温处理分析筛选乳酸菌发酵液中有效抑制霉菌物质的种类,结果显示8株乳酸菌发酵液对霉菌孢子的抑制率在调节pH值调高后显著下降,这表明酸碱度能显著影响发酵液的抑制霉菌活性。Ndagano等[16]研究了1株植物乳杆菌发酵浓缩液对黑曲霉的抑制活性,发现调高pH值后抑制霉菌活性下降显著,并确定了抑制霉菌活性是不同有机酸共同作用的结果。Sheng等[29]研究表明抗菌肽LAH4在不同pH值下与生物膜结合亲和力和结合速率不同,从而影响抗菌活性。因此推测筛选出的8株乳酸菌发酵液的有效抑制霉菌物质为对酸碱度敏感物质,如有机酸和多肽。发酵液的蛋白酶处理试验中,戊糖片球菌Y5发酵液在经木瓜蛋白酶和胰蛋白处理后,抑制率显著下降,而胃蛋白酶处理不改变其抑制率。不同蛋白水解酶对蛋白或多肽的作用位点不同,其中木瓜蛋白酶具有广泛特异型,对多种动植物蛋白、多肽、酯具有较强的水解能力;而胰蛋白酶虽然特异性强,但分解特定多肽的能力强。因此推测戊糖片球菌Y5发酵液中可能存在对木瓜蛋白酶和胰蛋白酶敏感的有效物质。此前也有研究发现乳酸菌可产生对蛋白酶敏感的抑制霉菌物质,如Muhialdin等[12]就从植物乳杆菌TE10中分离出37种抗菌肽。此外,8株乳酸菌发酵液在热处理后抑制率均未下降,因此抑制霉菌的有效物质为热稳定物质。综上,8株乳酸菌发酵液中主要抑制霉菌有效物质为有机酸,且戊糖片球菌Y5发酵液中可能存在对蛋白酶敏感的其他物质。
已有研究证明有机酸如乙酸、乳酸和苯乳酸具有抗真菌活性[30-31]。本研究使用HPLC法测定8株乳酸菌发酵液中有机酸的种类及含量,结果显示乳酸菌发酵液中存在多种有机酸。发酵液中浓度较高的有机酸为乳酸、乙酸和柠檬酸,可达1 mg·mL-1以上。柠檬酸和乳酸可以通过破坏膜结构、降低细胞内pH值、抑制主动运输和阻碍几种代谢功能来发挥抗真菌活性[32]。乙酸抑制霉菌活性体现在具有较高的pKa(酸度系数)值(pKa=4.75),高pKa值使其存在更多的未解离形式,这种形式能够在穿过细胞膜后解离引起细胞的酸性应激[33]。因此,发酵液中高浓度有机酸是抑制霉菌孢子生长的原因之一。抑制霉菌活性的表现除单一物质浓度作用外,也可能有多种酸之间的联合作用。Dagnas等[34]的研究发现,乳酸本身由于pKa值较低而抗真菌活性较低,但其在与乙酸结合的情况下,两者的抑制霉菌活性均提高;Valerio等[35]也解释了两者的协同作用有助于降低pH值从而抑制细菌和真菌的生长。以戊糖片球菌Y5为例的各种有机酸抑制作用分析中混合酸抑制率高于单一有机酸,因此8株乳酸菌发酵液对霉菌孢子的高抑制活性是所有有机酸共同作用的结果。
本研究中戊糖片球菌Y5产生的蛋白类抑制霉菌物质在酸性条件下沉淀,且在胰蛋白酶处理后抑制率显著下降。龚庆伟[36]使用酸沉法从莫海威芽胞杆菌发酵液中提取出抑制霉菌粗提液,分离纯化后获得5种抗菌肽。傅里叶红外光谱推测戊糖片球菌Y5的抑制霉菌物质由多糖和蛋白质组成,经SDS-PAGE凝胶电泳再用硝酸银-高碘酸染色和考马斯亮蓝染色确定其中抑制霉菌物质为糖蛋白。在de Azevedo等[20]的研究中,戊糖片球菌LBM18发酵液经胃蛋白酶、胰蛋白酶和木瓜蛋白酶处理后抑制霉菌活性完全消失,使用傅里叶红外、核磁共振和扫描电镜判定其为1种糖蛋白。
本研究从谷物中筛选出多株具有良好抑制霉菌活性的乳酸菌,这对谷物防霉有重要意义。其中戊糖片球菌Y5可产蛋白类抑制霉菌物质,在接下来的研究中可进一步提取纯化,确定其结构并在谷物中应用。

