高蛋白日粮诱发雏鹅高尿酸血症的血清代谢组学研究
王志,胡仲皓,李思婷,桂雪儿,冯士彬,李玉,王希春,李锦春,吴金节
(安徽农业大学动物科技学院,安徽 合肥 230036)
近年来,我国有些养鹅户为使鹅快速生长选用粗蛋白含量相对较高的鸡鸭饲料饲喂鹅,导致鹅蛋白质代谢异常,引发雏鹅高尿酸血症和痛风[1]。高尿酸血症和痛风是嘌呤代谢紊乱和尿酸排泄减少所引起的一组异质性疾病[2]。高尿酸血症是痛风发生的最主要生化基础[3],因此识别高尿酸血症的特异性生物标志物对高尿酸血症及痛风的诊断和治疗具有重要意义。
代谢组学主要运用核磁共振(NMR)光谱分析[4]、高效液相色谱/质谱(HPLC/MS、LC/MS/MS)[5]和气相色谱/质谱(GC/MS)[6]等检测技术,对有机物或生物样品中的所有低分子量代谢物进行定量分析。已有研究者通过代谢组学研究氧嗪酸钾、酵母粉、高嘌呤饮食诱导大鼠高尿酸血症模型[7-9],也有对高尿酸血症患者和健康对照者开展的代谢组学研究[10],并确定出模型组生物标志物。但目前尚缺乏用于禽类早期诊断、预测高尿酸血症及痛风进展的生物标志物,导致临床上不能及时制定延缓和治疗禽高尿酸血症和痛风进展的干预措施。
因此,本试验通过超高效液相色谱四极杆飞行时间/质谱法(LC-TOF/MS)和气相色谱飞行时间/质谱法(GC-TOF/MS)联用的代谢组学技术,以及血清生化指标,分析高蛋白日粮对雏鹅血清内外源性代谢产物和代谢通路的影响,揭示试验鹅所处的生理和病理状态,为筛选及鉴定高尿酸血症和痛风生物标志物提供试验参考。
1 材料与方法
1.1 试验动物分组及日粮
试验选用体重相近的1日龄雁鹅48只,随机分成对照组(CP)和高蛋白组(HP),每组24只鹅。基础日粮参照鹅的营养需求制备,对照组饲喂粗蛋白含量为18%(质量分数)的基础日粮,高蛋白组饲喂粗蛋白含量为23%(质量分数)的日粮。日粮的能量水平一致,日粮组成见表1。试验期为14 d。雏鹅自由采食,充足饮水,按正常免疫程序进行免疫接种。

表1 基础日粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diets(air-dry basis) g·kg-1
1.2 血清样本采集及测定
每组选取10只鹅,分别于试验第7和14 天08:00开始颈静脉采血2~3 mL。以血尿酸浓度高于476.57 mol·L-1作为高尿酸血症判断标准[11]。血液静置20 min,离心抽取血清后将血清样本分别保存于 -20 ℃冰箱及液氮罐里,用于后续的生化指标及代谢组学检测。血液生化指标用全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司)测定,参照试剂盒使用说明检测血液中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)活性以及总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、尿酸(UA)、尿素(UREA)、肌酐(CREA-S)含量。
1.3 非靶向代谢组学分析
1.3.1 样品制备LC-TOF/MS样品:取100 μL样品至EP管中,加入300 μL甲醇(含内标1 μg·mL-1),涡旋混匀30 s,超声10 min(冰水浴),-20 ℃静置1 h;将样品于4 ℃、12 000 r·min-1离心15 min;取上清液于进样瓶中上机检测。所有样品另取等量上清液混合成质量控制(QC)样品上机检测。GC-TOF/MS样品:取100 μL样品至EP管中,加入300 μL甲醇(含内标1 μg·mL-1),涡旋混匀30 s,超声10 min(冰水浴);将样本于4 ℃、12 000 r·min-1离心15 min,移取180 μL上清液于1.5 mL EP管中。每个样本各取 30 μL 混合成QC样本,在真空浓缩器中干燥提取物;向干燥后的代谢物加入30 μL甲氧胺盐试剂(溶于吡啶,20 mg·mL-1),轻轻混匀后,放入烘箱中80 ℃孵育30 min;向每个样品中加入40 μL 双(三甲基硅烷基)三氟乙酰胺(BSTFA,含体积分数1% 硅烷化试剂),将混合物70 ℃孵育1.5 h;冷却至室温后,向混合样本中加入5 μL 溶于氯仿的脂肪酸甲酯(FAME),随机上机检测。
1.3.2 色谱和质谱分析LC-MS/MS分析使用UHPLC系统(1290,Agilent),该系统带有UPLC HSS T3柱(2.1 mm×100 mm,1.8 μm),与Q Exactive(Orbitrap MS,Thermo)耦合。流动相A为 0.1%甲酸(阳性)+5 mmol·L-1醋酸铵(阴性),流动相B为乙腈。洗脱梯度设置如下:0 min,1%B;1 min,1%B;8 min,99%B;10 min,99%B;10.1 min,1%B;12 min,1%B(%,体积分数)。流速0.5 mL·min-1,进样体积3 μL。在 LC/MS 试验中,QE质谱仪用于获取基于信息依赖基础(IDA)的MS/MS光谱。在此模式下,用采集软件(Xcalibur 4.0.27,Thermo)采集全扫描测量MS数据时,根据预先选择的标准连续评估并触发MS/MS光谱的采集。
采用Agilent 7890气相色谱-飞行时间质谱仪进行GC-TOF/MS分析。系统采用DB-5MS毛细管柱。以无分流模式注入1 μL样品。氦气作为载气,前入口吹扫流量为3 mL·min-1,通过塔的气体流量为1 mL·min-1。初始温度50 ℃,保持1 min,然后以20 ℃·min-1的速率升高到310 ℃,保持6 min。注入、传输线和离子源温度分别为280、280和250 ℃。在电子碰撞模式下能量为-70 eV。在溶剂延迟4.83 min后,以每秒12.5光谱的速率在50~500m/z以全扫描模式获得质谱数据。
1.4 数据处理

2 结果与分析
2.1 血清生化指标
如表2所示:与对照组(CP)相比,雏鹅7日龄和14日龄时,高蛋白组(HP)鹅血清中丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、乳酸脱氢酶活性和总蛋白、尿酸含量极显著升高(P<0.01),球蛋白含量显著升高(P<0.05);雏鹅14日龄时,高蛋白组鹅血清中总胆红素、间接胆红素、尿素、肌酐含量极显著升高(P<0.01),高蛋白组血清尿酸平均水平为738 mmol·L-1,表明用高蛋白日粮成功构建高尿酸血症模型。

表2 高蛋白饲粮对雏鹅血清生化指标的影响Table 2 Effects of high protein diet on serum biochemical indexes in goslings
2.2 14日龄鹅血清代谢组学数据分析
从2组雏鹅主成分分析(PCA)得分图(图1)可见:样本全部处于95%置信区间内,2组样本分离成 2个不同的簇。为了鉴别HP组与CP组血清代谢物的差异,采用正交偏最小二乘-判别分析法(DPLS-DA)对结果进行分析,得出OPLS-DA评分散点图。从OPLS-DA散点图观察到样本全部处于95%置信区间内,2组间有明显的分离趋势,提示HP组与CP组血清代谢谱有差异。对于LC-TOF/MS试验,根据投影中的可变重要度(VIP)值大于1,P<0.01,差异倍数≤0.833 3或≥1,共选择27种代谢物(表3)。对于 GC-TOF/MS试验,同上条件下共鉴定出13种代谢物(表4)。然后,基于pathway数据库和代谢分析系统,通过代谢富集和途径分析,将这些不同的代谢产物映射到它们的生化途径中。如图2所示:基于LC-TOF/MS和GC-TOF/MS分析结果,显著改变的途径有氨酰tRNA生物合成、嘌呤代谢、嘧啶代谢、β-丙氨酸代谢、赖氨酸降解、磷酸肌醇代谢、泛酸和辅酶A生物合成。
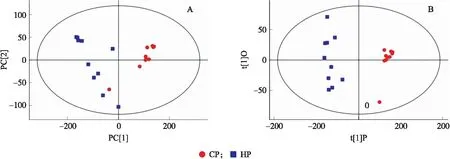
图1 HP组与CP组代谢谱的PCA模型得分散点图(A)和OPLS-DA模型得分散点图(B)Fig.1 Score scatter plot of PCA model(A)and OPLS-DA model(B)for HP and CP groups

表3 LC-TOF/MS分析HP组与CP组雏鹅代谢产物的差异Table 3 Discrepant serum metabolites identified by LC-TOF/MS analysis between HP and CP groups in goslings

续表3 Table 3 continued

图2 HP与CP组代谢通路分析Fig.2 Analysis of metabolic pathways in HP and CP groupsA.氨酰tRNA生物合成 Aminoacyl-tRNA biosynthesis;B. 赖氨酸降解 Lysine degradation;C. 嘌呤代谢 Purine metabolism;D. 嘧啶代谢 Pyrimidine metabolism;E. 磷酸肌醇代谢 Inositol phosphate metabolism;F. β-丙氨酸代谢Beta-alanine metabolism;G. 泛酸和辅酶A生物合成 Pantothenate and CoA biosynthesis.

表4 GC-TOF/MS分析HP组与CP组雏鹅代谢产物的差异Table 4 Discrepant serum metabolites identified by GC-TOF/MS analysis between HP and CP groups in goslings
利用热图形象化显示了鉴别到的41个差异代谢物在对照组与高蛋白组中相对含量及变化趋势(图3)。由图3可见:与对照组相比,高蛋白组差异代谢物颜色显著不同,说明高蛋白组和对照组差异代谢物含量不同。

图3 HP与CP组鹅血清中差异代谢物相对含量的热图分析Fig.3 Heatmap based on the relative levels of different metabolites in serum samples of goslings in the HP and CP groupsD.1-D.10:CP group 1-10 samples;S.1-S.10:HP group 1-10 samples.
3 讨论
禽类由于肝脏缺乏精氨酸酶,所以从饲料中摄入的蛋白质分解产生的核酸及嘌呤类物质最终代谢产物是尿酸。长期高蛋白摄入会导致蛋白质代谢异常,尿酸生成增多,当机体无法及时排除尿酸,体内积聚的高浓度尿酸可引起肾损伤,肾小管过滤尿酸的能力下降,导致高尿酸血症的发生[12]。血清生化检测结果表明高蛋白组总蛋白、尿酸含量极显著升高,证实高蛋白日粮的摄入已导致本试验雏鹅血液中蛋白含量升高,尿酸生成增多,且尿酸的平均浓度达到高尿酸水平,使摄食高蛋白雏鹅患上高尿酸血症。家禽肾脏中含有少量的精氨酸酶,能从血浆中获取精氨酸,通过精氨酸酶催化产生尿素[13]。在正常情况下,禽类的尿素几乎能全部被肾脏滤过。本试验中高蛋白组雏鹅尿素含量显著升高,原因可能是高蛋白日粮为尿酸的合成提供了更多尿素合成的原料,尿素不能及时排出体外;也可能是高浓度尿酸引起肾损伤,导致尿素在体内滞留。血清总胆红素包括直接胆红素和间接胆红素,它是肝功能的重要指标[14],引起总胆红素升高的原因主要有胆道梗阻、肝细胞受损等。ALT、AST、LDH活性反映肝细胞的完整性,常被视为肝损伤的敏感指标[15-16]。血清生化检测结果显示,试验第14天,高蛋白组的血清总胆红素浓度显著升高,而ALT、AST活性上升,说明高蛋白组雏鹅存在肝脏损伤,应是肝细胞受损导致肝脏处理胆红素的能力下降。
本试验中精氨酸、肌酸、尿囊素、瓜氨酸、尿素、肌酐含量均有上升趋势,而家禽精氨酸及肌酸代谢会产生尿素和肌酐[17],表明摄入高蛋白导致精氨酸及肌酸代谢增强,产生过多的尿素和肌酐,肌酐含量增加原因可能与尿素相似。因此,对于构建高蛋白日粮雏鹅高尿酸模型时,不能简单认为尿素和肌酐含量的增加意味着肾功能的损伤。尿囊素和瓜氨酸被认为是氧化应激和肾脏代谢标志物[18-19],其水平增加表明氧化应激的增加,肾脏代谢异常。虽然尿囊素和瓜氨酸增加的原因可能与尿素相似,但是有研究证实高尿酸可诱导氧化应激致肾脏损伤[20],肾脏作为尿酸排泄主要的器官[21],随着高蛋白的持续摄入,尿酸代谢平衡会随着饲喂时间的增加而越来越紊乱,因此高蛋白日粮诱导的雏鹅高尿酸血症很有可能是由于肾脏尿酸排泄障碍所引发的[18]。
尿酸是嘌呤核苷酸代谢产生的,黄嘌呤核苷酸和黄嘌呤是嘌呤代谢中尿酸的前体,而R-核糖可以加快机体嘌呤核苷酸的合成[22]。本试验中,R-核糖、黄嘌呤核苷酸和黄嘌呤含量有上升趋势,尿酸前体水平升高及血清尿酸含量增多提示在高蛋白组雏鹅中嘌呤代谢过度激活,嘌呤代谢异常。有研究证实,嘌呤降解增加与高尿酸血症密切相关,尿酸在高尿酸血症发病机制中起着重要作用[23]。由此我们推测R-核糖、黄嘌呤核苷酸、黄嘌呤及尿酸极有可能是高尿酸血症的潜在标志物。研究发现高尿酸血症与氨酰tRNA生物合成代谢的紊乱密切相关[24-25]。本试验高尿酸血症雏鹅血清中缬氨酸、赖氨酸、L-天冬酰胺、L(+)-精氨酸等氨基酸及氨酰tRNA生物合成也有上调趋势,可能与饲喂的高蛋白日粮有关,也有可能与高尿酸的形成有关,还需要进一步研究证实。
综上所述,本试验通过饲喂高蛋白日粮成功建立雏鹅高尿酸模型,采用LC-TOF/MS和GC-TOF/MS研究患高尿酸血症雏鹅和健康对照组雏鹅血清样品的非靶向代谢组学,发现高蛋白组雏鹅血清中黄嘌呤、1-甲基鸟苷、5,6-二氢尿嘧啶、瓜氨酸、尿酸等41种代谢物含量较对照组均发生明显改变,提示上述代谢物与高蛋白日粮诱导雏鹅高尿酸血症发生相关,为其潜在标志物。

