芦丁对热应激奶牛生产性能的影响
唐宇杰,卢浩诚,韩兆玉,李惠侠
(南京农业大学动物科技学院/草食动物研究所,江苏 南京 210095)
早期研究中,用于描述人在温热环境下舒适程度的温热指数(temperature-humidity index,THI)逐渐应用到家畜生产中,用以评定家畜所处的温热环境以及家畜的耐热性能[1]。南方夏季高温高湿,奶牛长期处于不利于生理活动的环境下。处于热应激状态下的奶牛生产性能与繁殖性能水平急剧下滑,严重影响经济效益[2]。目前国内外研究人员都在寻求减缓热应激的方法以解除奶牛业发展的掣肘,除常见的物理降温措施外,选择安全高效的饲料添加剂也许是一条更为广阔的途径。
芦丁(rutin)是一种从植物中提取的黄酮类化合物,并且结构上与内源性雌激素具有相似的特性[3],通常认为这样的结构可以通过结合于雌激素所占据的雌激素受体的位点而发挥类雌激素样作用。已有研究表明,大豆黄酮可以提高蛋鸡产蛋性能[4],改善妊娠母猪的繁殖性能与免疫机能的作用[5],据此推测芦丁能够提高奶牛生产性能与抗逆能力。此外芦丁还被证明具有抗癌[6]、抗心脑血管疾病、抗氧化[7]、减轻阵痛、抗炎症[8]、抗血小板聚集以及舒张血管[9]等作用。
在受到应激刺激后,细胞内脂质、蛋白、糖类的合成代谢均会发生相应的改变,与之相关的关键基因表达量会发生变化,细胞合成脂质、蛋白质与糖的能力也随之改变。故本试验以荷斯坦奶牛为试验对象,在日粮中添加芦丁研究对夏季奶牛抗热能力、生产性能的影响,并初步探究芦丁影响奶牛乳腺上皮细胞内与脂质合成、蛋白质合成、乳糖合成变化的潜在机制,为芦丁在畜禽生产上的应用提供理论依据。
1 材料与方法
1.1 试验动物、材料及试验药品
试验荷斯坦奶牛由安徽省宿州市草源牧业股份有限公司提供;饲养试验所用芦丁(95%,20200116)购自巨邦植物原料(什邡)有限公司。奶牛乳腺上皮细胞系(bovine mammary epithelial cells,MAC-T)为哈佛大学孙友平博士赠送;体外试验所用芦丁(95%,S13033)购自源叶生物科技(上海)有限公司。奶样采集后于南京卫岗乳业有限公司检测中心进行奶牛生产性能(DHI)检测。
1.2 主要试剂及仪器
DMEM/F12培养基、磷酸盐缓冲盐溶液(PBS)购自HyClone公司;胎牛血清(FBS)、胰蛋白酶(Trypsin-EDTA)购自Gibco公司;细胞增殖-毒性检测试剂盒(CCK-8)购自东仁化学科技(上海)有限公司;RNA isolater(Trizol)、HiScript®Ⅲ RT SuperMix、AceQTMUniversal SYBR®qPCR Master Mix购自诺唯赞生物科技(南京)有限公司;凋亡检测试剂盒(Annexin V-Alexa Fluor 647/PI)购自福麦斯生物技术(南京)有限公司;焦碳酸二乙酯(DEPC)水购自奥青生物科技有限公司。所用仪器:美国ABI公司的荧光定量PCR仪(Quant-Studio7 Flex),美国Thermo公司全波长酶标仪(Multiskan Go)和微量分光光度计(ND-1000),丹麦FOSS公司的多功能乳品质分析仪(MilkoScanTMFT+)和体细胞分析仪(FossomaticTMFC)。
1.3 试验设计与饲养管理
本试验采用单因素试验设计,选择体重600 kg左右、生理情况与生产性能基本一致的健康围产期荷斯坦牛30头(5胎牛,泌乳期150 d左右),随机分为3组,对照组饲喂基础日粮,试验1、2组于日粮中分别添加2和3 g芦丁,每日1次加入TMR机搅拌混匀饲喂,试验期为60 d。试验期内自由饮水、采食。基础日粮配方及营养水平见表1。

表1 基础日粮组成及营养组成水平Table 1 Composition and nutrient content of basal diet %
1.4 数据收集和指标测定
1.4.1 温热指数于牛舍中部距离地面1.5 m处挂干湿度温度计,试验期内每10 d记录牛舍内温度(T)与相对湿度(RH),计算温热指数(THI)。计算公式:THI=(1.8×T+32)-(0.55-0.55×RH×0.01)×(1.8×T-26)。当THI为68~71时,动物处于热应激状态,72~79为轻度热应激状态,80~89为中度热应激状态,大于90时,为重度热应激状态。
1.4.2 呼吸频率试验期内每10 d记录各组奶牛每分钟的呼吸频率。每次重复测定3次取平均值,测定时在牛安静状态下,站在牛腹部后侧方观察,胸腹部一起一伏记为呼吸1次。
1.4.3 直肠温度试验期内每15 d测量各组奶牛的直肠温度。检查体温计完好后将体温计的水银柱甩至35 ℃以下,用酒精棉球擦拭体温计进行消毒,缓缓旋动体温计插入牛的肛门内并固定,停留3~5 min后取出读数。
1.4.4 奶样采集试验期内每10 d记录各组奶牛产奶量数据并采集奶样。采集日当天收集奶牛早、中、晚3次奶样50 mL,按早、中、晚4∶3∶3(体积比)比例混合,取50 mL移入新采奶管,滴入2滴防腐剂后保存,用于统计奶牛DHI数据。
1.4.5 4%乳脂矫正乳与能量矫正乳计算为分析各组奶牛之间生产性能及饲喂效率的差异,对采集到的奶样DHI数据与产奶量进行标准化计算,将不同乳脂含量的乳矫正为含4%乳脂的标准状态,即乳脂矫正乳(fat corrected milk,FCM)。计算公式:FCM=0.4M+15F。式中:FCM为乳脂矫正乳质量,M为非标准乳质量,F为非标准乳含脂量,单位均为kg。将乳蛋白率与乳脂率经过矫正,计算能量矫正乳(energy corrected milk,ECM)。计算公式:ECM=12.28F+7.13P+0.323M。式中:ECM为能量矫正乳质量,F为非标准乳含脂量,P为非标准乳含蛋白量,M为非标准乳质量,单位均为kg。
1.5 细胞培养及处理
1.5.1 芦丁毒性检测芦丁溶于二甲基亚砜(DMSO),DMSO占培养基体积分数的0.4%,奶牛乳腺上皮细胞系接种于细胞专用T25培养瓶,用含10%(体积分数)胎牛血清的DMEM/F12液体培养基培养,传至第3代。当细胞处于对数生长期时,用胰蛋白酶消化,调整细胞浓度为105mL-1,接种于96孔细胞培养板,每孔培养基为100 μL。培养至孔底部细胞融合度为70%时更换培养基。对照组添加基础培养基,试验1组添加0.4% DMSO,试验2、3、4和5组分别添加10、20、40和 80 μg·mL-1芦丁。均于37 ℃、5% CO2细胞培养箱内培养24 h后每孔加入10 μL CCK-8试剂,培养3 h后用酶标仪测定450 nm处吸光值(D450),计算细胞存活率,分析芦丁对细胞是否存在毒性。计算公式:细胞存活率=(试验孔吸光值-空白孔吸光值)/(对照孔吸光值-空白孔吸光值)×100%。
1.5.2 热应激处理与细胞活力检测将奶牛乳腺上皮细胞按105mL-1接种于96孔细胞培养板,每孔培养基为100 μL,培养至孔底部细胞融合度为70%时更换培养基,分为对照组、试验1、2、3和4组,培养24 h后将细胞转移入42 ℃、5% CO2的细胞培养箱内培养2 h进行热应激处理,然后放入37 ℃、5% CO2的细胞培养箱内恢复培养12 h,再于每孔加入10 μL CCK-8试剂,培养3 h后用酶标仪测定450 nm处吸光值(D450),计算细胞存活率,分析芦丁对热应激处理下细胞活力的影响。根据毒性检测与细胞活力检测结果,确定测定mRNA表达量时所添加的芦丁剂量。
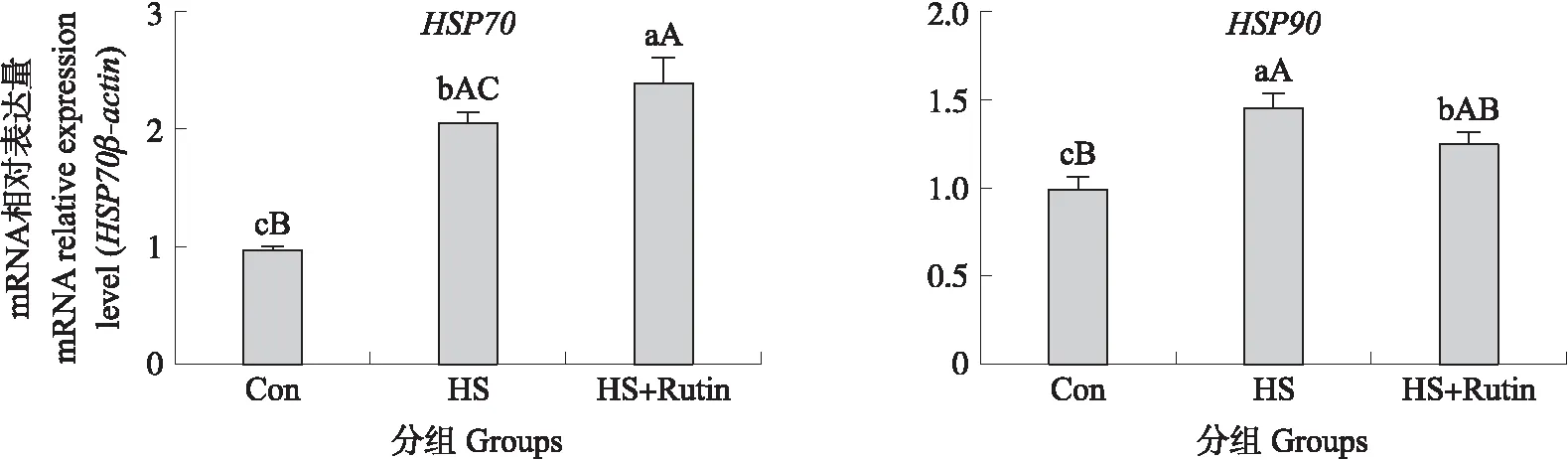
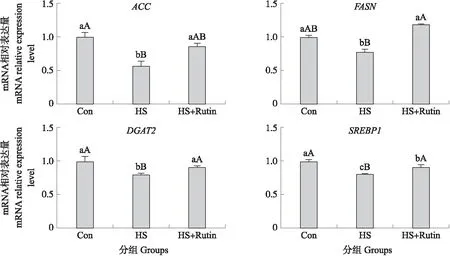
1.5.3 总RNA提取与RT-qPCR分析将细胞接种于6孔细胞培养板中,热应激处理并恢复培养步骤同1.5.2节,使用RNA提取试剂提取奶牛乳腺上皮细胞总RNA,微量分光光度计检测RNA纯度与浓度(1.8 表2 本试验RT-qPCR所用引物序列Table 2 The primer sequence used for RT-qPCR in this experiment 由图1可见,在试验期60 d内,奶牛均处于热应激的状态,试验10 d时温热指数大于90,此时奶牛处于高度热应激状态,试验20~40 d THI为78~89,此时奶牛处于中度热应激状态,试验50~60 d THI均大于73,此时奶牛处于轻度热应激状态。 图1 试验期(60 d)内奶牛温热指数变化Fig.1 Dynamic of temperature and heat index change of dariy cow in 60 days during the test period 由图2可见:与对照组相比,在试验45 d时,试验1组与试验2组奶牛直肠温度显著降低(P<0.05);在试验60 d时,试验1组奶牛直肠温度极显著降低(P<0.01),试验2组奶牛直肠温度显著降低(P<0.05);呼吸频率均无显著差异(P>0.05)。 图2 日粮添加芦丁对热应激奶牛直肠温度与呼吸频率的影响Fig.2 Effects of dietary rutin on rectal temperature and respiratory rate in heat stressed dairy cows与对照组相比较*和**分别表示差异显著(P<0.05)和差异极显著(P<0.01)。下同。Compared with the control group,* and ** showed significant difference(P<0.05)and extremely significant difference(P<0.01). The same below. 由图3可见:与对照组相比,在试验40和50 d时,试验1组与试验2组产奶量显著提高(P<0.05);试验60 d时试验1组与试验2组产奶量极显著提高(P<0.01)。 图3 日粮添加芦丁对热应激奶牛产奶量的影响Fig.3 Effect of dietary rutin on milk yield of heat stressed dairy cows 由图4可见:与对照组相比,试验20和30 d试验2组FCM产量显著提高(P<0.05);试验40 d试验1组产量显著提高(P<0.05),试验2组产量极显著提高(P<0.01);试验50 d试验1组与试验2组产量均显著提高(P<0.05);试验60 d试验1组与试验2组产量均极显著提高(P<0.01)。 图4 日粮添加芦丁对热应激奶牛乳脂矫正乳(FCM)与能量矫正乳(ECM)产量的影响Fig.4 Effect of dietary rutin on daily fat corrected milk(FCM)and energy corrected milk(ECM) yield of heat stressed dairy cows 与对照组相比,试验40 d试验1组ECM产量显著提高(P<0.05),试验2组产量极显著提高(P<0.01);试验50 d试验1组与试验2组产量均显著提高(P<0.05);试验60 d试验1组与试验2组产量均极显著提高(P<0.01)。 由表3可见:与对照组相比,乳脂率无显著差异(P>0.05);试验40 d试验1组乳蛋白率显著升高(P<0.05),50和60 d试验1组与试验2组乳蛋白率均显著升高(P<0.05);试验50和60 d试验1组与试验2组乳糖率均显著升高(P<0.05);试验40、50和60 d试验1组与试验2组乳中体细胞数均显著降低(P<0.05)。 表3 日粮添加芦丁对热应激奶牛乳品质的影响Table 3 Effects of dietary rutin on milk quality of heat stressed dairy cows 续表3 Table 3 continued 由图5可见:与对照组相比,试验40 d试验1组乳脂含量显著提高(P<0.05),试验2组乳脂含量极显著提高(P<0.01);试验50 d试验1组与试验2组乳脂含量均显著提高(P<0.05);试验60 d试验1组与试验2组乳脂含量均极显著提高(P<0.01)。与对照组相比,试验40、50和60 d试验1组与试验2组乳蛋白含量均极显著提高(P<0.01)。与对照组相比,试验10 d试验1组乳糖含量显著提高(P<0.05),试验30 d试验1组与试验2组乳糖含量均显著提高(P<0.05);试验40 d试验1组乳糖含量显著提高(P<0.05),试验2组乳糖含量极显著提高(P<0.01);试验50 d试验1组与试验2组乳糖含量均显著提高(P<0.05);试验60 d试验1组与试验2组乳糖含量均极显著提高(P<0.01)。 图5 日粮添加芦丁对热应激奶牛乳成分含量的影响Fig.5 Effects of dietary rutin on milk composition of heat stressed dairy cows 由表4可见:芦丁以DMSO作溶剂,在培养基中占体积分数的0.4%。与对照组相比,DMSO组及10、20、40 μg·mL-1芦丁组对细胞均无毒性作用(P>0.05);80 μg·mL-1芦丁组D450值极显著降低(P<0.01),故后续试验芦丁添加量控制在40 μg·mL-1及以下。 表4 不同芦丁添加量对BMEC的毒性作用Table 4 Toxic effect of different addition of rutin on BMEC 由表5可见:与对照组相比,热应激处理下0、10和20 μg·mL-1芦丁组细胞活力均极显著下降(P<0.01),40 μg·mL-1芦丁组细胞活力显著下降(P<0.05);对细胞进行热应激处理后,与未添加芦丁组相比,10和 20 μg·mL-1芦丁组细胞活力无显著差异(P>0.05),40 μg·mL-1芦丁组细胞活力均极显著提高(P<0.01);40 μg·mL-1芦丁组细胞活力显著高于10 μg·mL-1芦丁组;20 μg·mL-1芦丁组与40 μg·mL-1芦丁组细胞活力无显著差异(P>0.05),故后续试验芦丁添加量确定为40 μg·mL-1。 表5 不同芦丁添加量对热应激下BMEC活力的影响Table 5 Effects of different addition of rutin on the viability of BMEC under heat stress 由图6可见:对BMEC进行热应激处理后,HSP70与HSP90基因均过表达;与热应激处理组相比,40 μg·mL-1芦丁组HSP70mRNA表达量显著升高(P<0.05),HSP90mRNA表达量显著降低(P<0.05)。 图6 热应激处理后芦丁对BMEC HSP70、HSP90基因表达的影响Fig.6 Effect of rutin on the expression of HSP70 and HSP90 mRNA in BMEC under heat stressCon:对照Control;HS:热应激Heat stress;HS+Rutin:热应激+芦丁Heat stress+Rutin. 下同。The same below. 由图7可见:与对照组相比,对BMEC进行热应激处理后,热应激处理组ACC、DGAT2、SREBP1表达量极显著降低(P<0.01),FASN表达量显著降低(P<0.05);与热应激组相比,40 μg·mL-1芦丁组ACC、DGAT2、SREBP1表达量显著升高(P<0.05),FASN表达量极显著升高(P<0.01)。 图7 芦丁对BMEC乳脂合成相关基因表达的影响Fig.7 Effects of rutin on the expression of lipid synthesis related genes in BMEC 由图8可见:与对照组相比,对BMEC进行热应激处理后,热应激组CSN1S1、CSN2表达量极显著降低(P<0.01);与热应激组相比,40 μg·mL-1芦丁组CSN1S1表达量极显著升高(P<0.01),CSN2表达量显著升高(P<0.05)。 图8 芦丁对BMEC乳蛋白合成相关基因表达的影响Fig.8 Effects of rutin on the expression of milk protein synthesis related genes in BMEC 由图9可见:与对照组相比,对BMEC进行热应激处理后,热应激处理组GLUT1mRNA表达量极显著降低(P<0.01);与热应激组相比,40 μg·mL-1芦丁添加组GLUT1表达量显著升高(P<0.05)。 图9 芦丁对BMEC乳糖合成相关基因GLUT1表达的影响Fig.9 Effect of rutin on the expression of lactose synthesis related genes GLUT1 in BMEC 环境温热指数与奶牛的呼吸频率、直肠温度是最常用的用来判断奶牛是否处于热应激状态的指标[10],在试验期60 d内,环境温热指数均高于72,表明奶牛长期处于热应激状态[11],为后续研究提供了良好模型。在本试验中,日粮中添加芦丁并饲喂超过30 d,能有效降低奶牛的直肠温度,但对呼吸频率无显著影响,结合试验期温热指数变化,可能是由于气温对于奶牛呼吸频率的影响作用大于芦丁对奶牛热应激的效应所致。 产奶性能直接决定了奶牛的经济效益。日粮中添加芦丁有效延缓了高温天气产奶量急剧下滑的情况,并且在饲喂超过30 d后,试验组产奶量均显著高于对照组。芦丁是一种从植物中提取的黄酮类化合物,郝振荣等[12]报道大豆黄酮能够缓解泌乳后期奶牛产奶量下降的趋势,并在一定程度上提高产奶量;朱河水等[13]研究也发现大豆黄酮能够通过促进乳腺腺泡细胞代谢提高奶牛泌乳量,本试验结果与之一致。为比较不同组之间奶牛的产奶性能,以能量为标准,将不同乳脂率的乳统一矫正为含4%乳脂的标准乳,本试验中芦丁添加组矫正乳产量均显著高于对照组,证明芦丁具有提高奶牛生产性能的作用。能量矫正乳是计算饲喂效率的标准参数,饲喂效率(feed efficiency,FE)也称产奶效率,指单位质量的干物质采食量所生产的牛奶质量,可以综合反映奶牛饲养水平与饲料质量。本试验在日粮中添加芦丁,显著提高了奶牛能量矫正乳产量,表明芦丁在有效提高奶牛生产能力的同时还可以提高饲喂效率,改善饲料质量。 本试验中饲喂芦丁超过30 d后,乳蛋白率和乳糖率均有显著上升的趋势,乳中乳蛋白和乳糖含量同样显著增加,这与李琮等[14]报道的饲喂大豆黄酮能提高奶牛乳蛋白率和乳糖率的结果一致。本试验中发现芦丁对奶牛乳脂率无显著影响,但显著提高了乳中脂质质量,反映了芦丁具有促进乳脂合成分泌的能力,此外芦丁能够显著降低乳中体细胞数。芦丁被证实具有多种抗炎活性,如Choi等[15]研究发现芦丁可以通过抑制炎性因子的表达来调节过敏性接触性皮炎等炎症,达到治疗炎症的目的,这种抗炎活性可能也是本试验中芦丁添加组乳中体细胞数显著降低的原因。根据各项试验结果与成本综合考虑,每天芦丁添加量应以每头2 g为宜,且饲喂时长应大于30 d。 热休克蛋白(heat shock proteins,HSP)是一类细胞在应激原特别是环境高温下诱导过量表达的一组蛋白,其相对表达量是判断细胞应激状态最有力的指标[16]。HSP70参与多肽的折叠与前体蛋白形成,并通过及时降解异常蛋白来维系细胞应激后的存活,HSP70基因过表达可以增强细胞耐热性。HSP90参与促进信号肽成熟,具备遗传变异的调节功能,当细胞受到环境胁迫时,HSP90会发挥缓冲作用,其表达程度与细胞被胁迫程度呈正相关,以此使细胞有效适应不利环境[17]。在本试验中,热应激处理奶牛乳腺上皮细胞后,HSP70、HSP90均呈现过表达,芦丁添加组HSP70表达量显著高于热应激组,这表明芦丁能够进一步保护细胞以缓解热应激带来的不利影响,且芦丁组HSP90表达量显著低于热应激组,也证实了添加芦丁后,细胞受热刺激胁迫程度降低,表明芦丁具有一定的保护作用,这也进一步佐证了本试验中添加芦丁后,乳中体细胞数降低且受到热应激的细胞存活率显著提高的结果。 在奶牛生成乳汁的过程中,乳腺上皮细胞执行泌乳功能并决定了奶牛生产性能[18],通过对奶牛乳腺上皮细胞相关关键基因的研究,能够在一定程度上反映奶牛泌乳能力与乳品质[19],反映乳品质的指标主要包括乳脂、乳蛋白与乳糖,这三者也是牛乳中的主要营养物质,具有较大的研究意义。 在脂质合成代谢的过程中,FASN、ACC参与合成长链脂肪酸的限速步骤[20-21],二酯酰甘油酰基转移酶(DGAT)与脂肪沉积、产奶性能及泌乳质量等性状具有密切的关联性[22-23],DGAT2通常可视为奶牛、奶山羊产奶性状的重要候选基因。DGAT2是ACC/FAS信号通路下游蛋白,在白色脂肪、骨骼肌、肝中表达最多[24],SREBP1通过参与脂肪酸和甘油三酯合成相关基因的活化来调节脂肪生成的过程[25]。这些基因在细胞脂质合成过程中均发挥重要作用,它们的相对表达量反映了细胞成酯能力的变化。在本试验中,对细胞进行热应激处理后,芦丁添加组脂质合成相关基因的表达量均显著提高,反映芦丁对调控奶牛乳腺上皮细胞乳脂合成与分泌具有一定的影响作用。乳蛋白的80%为酪蛋白,是乳中特有的蛋白,牛乳中主要含有αs1-酪蛋白(CSN1S1)、αs2-酪蛋白、β-酪蛋白(CSN2)、γ-酪蛋白及κ-酪蛋白[26]。本试验中,对细胞进行热应激处理后,乳蛋白合成关键基因表达量均显著提高,反映芦丁对奶牛乳蛋白合成具有积极作用。葡萄糖转运蛋白(GLUT)是人体内最重要的跨膜蛋白之一,其中GLUT1是分布最广泛的葡萄糖转运蛋白,在乳腺上皮细胞中,GLUT1是重要的葡萄糖转运载体,能够介导葡萄糖的摄取,参与哺乳动物乳腺泌乳期乳糖合成的调控[27]。本试验中,对细胞进行热应激处理后,芦丁添加组GLUT1基因表达显著提高,表明芦丁能够一定程度提高细胞乳糖合成能力。本试验中的体外试验,同样佐证了体内试验中乳中脂质、蛋白及乳糖含量提高的结果。 综上所述,日粮中添加芦丁能够通过调控热休克蛋白及乳脂、乳蛋白及乳糖合成相关基因的表达量,增强奶牛抗应激能力,提高生产性能。
1.6 数据处理与统计分析

2 结果与分析
2.1 试验期60 d内温热指数

2.2 芦丁对奶牛呼吸频率与直肠温度的影响

2.3 芦丁对热应激奶牛产奶量的影响

2.4 芦丁对热应激奶牛FCM与ECM产量的影响

2.5 芦丁对热应激奶牛乳品质的影响


2.6 芦丁对热应激奶牛乳成分含量的影响

2.7 芦丁对BMEC的毒性作用

2.8 芦丁对热应激处理BMEC活力的影响

2.9 芦丁对热应激处理BMEC HSP70、HSP90基因表达的影响
2.10 芦丁对BMEC乳脂合成相关基因表达的影响
2.11 芦丁对BMEC乳蛋白合成相关基因表达的影响

2.12 芦丁对BMEC乳糖合成相关基因表达的影响

3 讨论
3.1 芦丁对热应激奶牛热应激指标的影响
3.2 芦丁对热应激奶牛生产性能的影响
3.3 芦丁对热应激BMEC抗逆能力的影响
3.4 芦丁对热应激BMEC乳脂、乳蛋白及乳糖合成关键基因的影响

