UA、NT⁃proBNP、PLR在脑梗死静脉溶栓中动态变化及意义
孙维明 王桂华 张颖 齐霄茹 冯晨芳
急性脑梗死(Acute ischemic stroke,AIS)为临床最常见脑血管疾病,是由脑部主要供血动脉发生严重狭窄或者闭塞导致脑部血流供应不足引发[1]。目前,国内外脑卒中诊治指南[2⁃3]均推荐早期采用静脉溶栓治疗AIS,可获得良好疗效。但在临床工作中,多数患者在静脉溶栓24 h 内出现症状波动,部分患者症状甚至加重,如何让患者在最有效时间窗内得到更大获益性治疗显得尤为重要。相关研究[4]指出,血清尿酸(Uric acid,UA)水平与AIS 患者颅内动脉狭窄程度呈正相关,且是影响AIS 患者病情恢复的因素。N 末端B 型利钠肽原(N⁃terminal pro⁃brain natriuretic peptide,NT⁃proBNP)是敏感的心功能标志物,其水平变化与AIS 神经功能缺损严重度及预后有良好的相关性[5]。此外,新近研究指出血小板与淋巴细胞比值(Platelet to lymphocyteratio,PLR)升高将增加AIS 患者的脑梗死面积,并使预后不良发生率增加[6]。本研究尝试探讨UA、NT⁃proBNP、PLR在AIS静脉溶栓中动态变化及意义。
1 资料与方法
1.1 一般资料
选取2018年10月至2019年12月沧州市人民医院105 例AIS 患者,均行阿替普酶静脉溶栓治疗,根据发病90 d 改良Rankin 量表评分(modified Rankin scale,mRS)[7]分为预后不良组(mRS 评分>3 分,n=26)、良好组(mRS 评分≤3 分,n=79)。对比两组性别、年龄、体质量指数、合并症、吸烟及饮酒情况,差异无统计学意义(P>0.05)。见表1。
表1 两组一般资料比较[(±s),n(%)]Table 1 Comparison of general data between the two groups[(±s),n(%)]
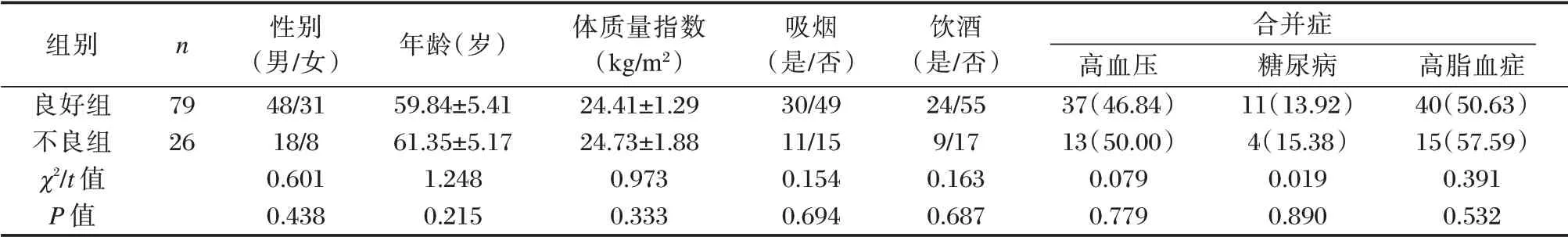
表1 两组一般资料比较[(±s),n(%)]Table 1 Comparison of general data between the two groups[(±s),n(%)]
组别良好组不良组χ2/t 值P 值n 合并症79 26性别(男/女)48/31 18/8 0.601 0.438年龄(岁)59.84±5.41 61.35±5.17 1.248 0.215体质量指数(kg/m2)24.41±1.29 24.73±1.88 0.973 0.333吸烟(是/否)30/49 11/15 0.154 0.694饮酒(是/否)24/55 9/17 0.163 0.687高血压37(46.84)13(50.00)0.079 0.779糖尿病11(13.92)4(15.38)0.019 0.890高脂血症40(50.63)15(57.59)0.391 0.532
纳入标准:①参照《中国急性缺血性脑卒中诊治指南2018》[8]诊断为AIS;②发病至治疗时间≤4.5 h;③首次患病;④对本研究药物无禁忌;⑤患者及家属知晓本研究,已签署同意书。排除标准:①有出血倾向者;②头部严重创伤史或手术史者;③血液系统疾病者;④恶性肿瘤患者;⑤严重心血管疾病、肝肾功能不全者;⑥合并其他可能影响本研究指标检测疾病者,如感染、自身免疫疾病。本研究经医院伦理委员会批准。
1.2 方法
指标检测方法:患者入院后均常规行静脉溶栓治疗分别于溶栓前、溶栓后24 h、溶栓后7 d 采集患者外周静脉血5 mL,取3 mL 血液标本以3 500 r/min 转速离心(离心半径5 cm)处理5 min,取血清,采用尿酸酶法测定血清UA 水平,试剂盒购自浙江东方基因生物制品有限公司;采用时间分辨荧光免疫层析法检测血清NT⁃proBNP 水平,试剂盒购自苏州光景生物科技有限公司;取2 mL 血液标本,采用OTA⁃400 型全自动生化分析仪(购自沈阳万泰医疗设备有限责任公司)检测血小板、淋巴细胞水平,并计算PLR。
1.3 统计学方法
数据处理采用SPSS 22.0软件,计数资料以n(%)描述,采用χ2检验,等级间用u检验。计量资料采取Bartlett 方差齐性检验与Kolmogorov⁃Smirnov 正态性检验,均确认具备方差齐性且服从正态分布,以(±s)描述,采用独立样本t检验;相关性分析采用Pearson 相关系数模型;影响因素分析采用Cox回归模型;预测效能分析采用受试者工作特征(ROC)曲线;P<0.05 为差异有统计学意义。
2 结果
2.1 两组UA、NT⁃proBNP、PLR 动态变化
不良组溶栓后24 h、溶栓后7 d UA、NT⁃proB⁃NP、PLR 均较良好组高,差异有统计学意义(P<0.05)。见表2。
表2 两组UA、NT⁃proBNP、PLR 动态变化(±s)Table 2 The dynamic changes of the two groups of UA,NT⁃proBNP and PLR(±s)

表2 两组UA、NT⁃proBNP、PLR 动态变化(±s)Table 2 The dynamic changes of the two groups of UA,NT⁃proBNP and PLR(±s)
指标UA(μmol/L)组别不良组良好组例数26 79 t 值P 值NT⁃proBNP(pg/ml)不良组良好组26 79 t 值P 值PLR 不良组良好组26 79 t 值P 值溶栓前428.66±67.29 419.57±64.03 0.620 0.537 305.29±59.34 310.49±55.28 0.409 0.684 142.06±19.78 146.53±21.67 0.931 0.354溶栓后24 h 357.86±59.44 319.07±48.76 3.328 0.001 257.34±36.84 219.56±33.92 4.822<0.001 121.39±17.26 106.88±14.75 4.168<0.001溶栓后7 d 349.23±31.88 322.67±35.57 3.384 0.001 249.18±37.43 208.23±40.55 4.549<0.001 103.55±13.50 90.27±10.81 5.098<0.001
2.2 两组发病后90 d mRS 评分比较
不良组与良好组发病后90 d mRS 评分比较,差异有统计学意义(P<0.05)。见表3。
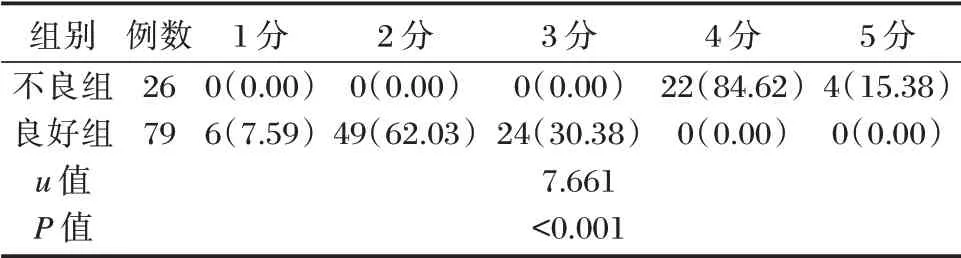
表3 两组发病后90 d mRS 评分比较[n(%)]Table 3 Comparison of mRS scores between the two groups at 90 d after the onset of disease[n(%)]
2.3 UA、NT⁃proBNP、PLR 与mRS 评分关系
Pearson 分析显示,溶栓后24 h、溶栓后7 d UA、NT⁃proBNP、PLR 与发病后90 d mRS 评分呈正相关(P<0.05)。见表4。
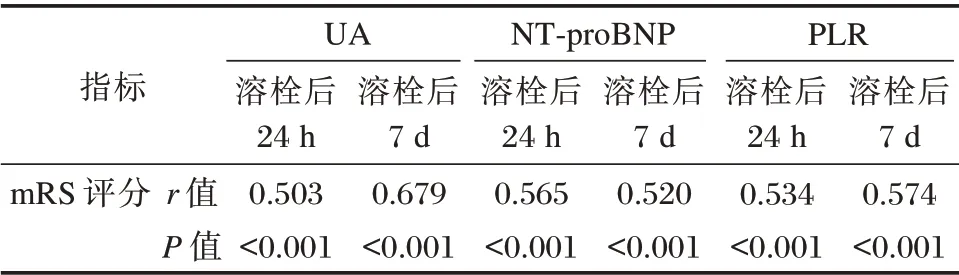
表4 UA、NT⁃proBNP、PLR 与mRS 评分关系Table 4 Relationship between UA,NT⁃proBNP,PLR and mRS score
2.4 预后影响因素的Cox 分析
因变量:预后良好=0,预后不良=1;自变量:溶栓后24 h、溶栓后7 d UA、NT⁃proBNP、PLR;应用Cox回归分析显示,溶栓后24 h、溶栓后7 d UA、NT⁃proB⁃NP、PLR 是预后相关影响因素(P<0.05)。见表5。

表5 预后影响因素的Cox 回归分析Table 5 Cox regression analysis of prognostic factors
2.5 UA、NT⁃proBNP、PLR 预测预后的ROC 曲线
阳性样本:不良组溶栓后24 h、溶栓后7 dUA、NT⁃proBNP、PLR;阴性样本:良好组溶栓后24 h、溶栓后7 d UA、NT⁃proBNP、PLR;绘制ROC曲线显示,溶栓后7 d 各指标及联合的曲线下面积(Area under the curve,AUC)大于溶栓后24 h 对应单一指标及联合的AUC。见表6、图1。

图1 UA、NT⁃proBNP、PLR 预测预后的ROC 曲线Figure 1 ROC curve of UA,NT⁃proBNP,PLR predicting prognosis

表6 ROC 分析结果Table 6 ROC analysis results
3 讨论
AIS 的治疗关键在于第一时间开通梗死血管,尽早恢复缺血脑组织的血流灌注[9]。国内外已有大量研究证实阿替普酶静脉溶栓是治疗AIS 有效方法[10⁃11]。
本研究以AIS 静脉溶栓的不同预后为切入点,通过对比分析发现预后不良患者的溶栓后24 h、溶栓后7 d 血清UA 水平均明显高于预后良好患者,提示溶栓治疗过程中血清UA 水平的动态变化可能与AIS 患者的预后有关。UA 是人体嘌呤代谢的最终产物,高UA 水平可引起体内脂类代谢异常,导致血液黏稠度增高,加重动脉粥样硬化,同时能促进血小板黏附、增加脑白质病变,从而加重脑梗死病情[12⁃13]。本研究还发现,预后不良患者溶栓后24 h、溶栓后7 d 血清NT⁃proBNP 水平均高于预后良好患者。NT⁃proBNP 属利钠肽家族成员,是脑钠肽激素原分裂后的N 端片段,多见于心血管疾病的研究中[14]。近年来研究发现,非心力衰竭患者也可因炎症因子增加等产生心肌抑制因子,导致血清NT⁃proBNP 水平上升[15]。而炎症反应是AIS 发生发展过程中的关键环节之一,大量研究证实AIS 发生可引起多种炎症因子水平升高[16⁃17]。因此AIS 患者血清NT⁃proBNP 水平处于高表达状态,溶栓治疗后,随着患者病情改善炎症反应逐渐消减,血清NT⁃proBNP 水平随之降低。此外,淋巴细胞是反映炎症状态的指标之一,有报道指出淋巴细胞下降是脑梗死发生后的早期特征,且是脑损伤和感染的高危标志物[18]。而血小板是一种特殊的炎症指标,其受到刺激时会释放炎症分子,且血小板活化参与了动脉粥样硬化和AIS 的病理过程,PLR 作为血小板与淋巴细胞的比值,可反映AIS 患者炎症状态,且PLR 相对于单个血液参数而言更为稳定[19]。本研究亦发现PLR 在AIS 患者溶栓治疗后随病情好转逐渐降低,说明PLR 水平变化与AIS 患者预后有关。本研究进一步通过相关性分析,发现溶栓后24 h、溶栓后7 d UA、NT⁃proBNP、PLR 水平与发病后90 d mRS 评分间存在正相关关系,且多因素分析发现各指标均与AIS 患者预后显著相关,这说明UA、NT⁃proBNP、PLR 升高水平均与溶栓治疗后AIS 患者预后有关。
基于上述结果,笔者推测溶栓后24 h、溶栓后7 d UA、NT⁃proBNP、PLR 可应用于预测AIS 患者溶栓治疗的预后转归方向,通过绘制ROC 曲线对上述推测进行验证,发现溶栓后24 h、溶栓后7 d UA、NT⁃proBNP、PLR 预测AIS 患者预后不良的AUC 均在0.7 以上,均具有一定预测价值,特别是溶栓后7 d 各指标联合预测的AUC 达到0.953,最佳预测敏感度、特异度分别为88.46%、89.87%,具有较高预测效能,可为临床早期预测患者预后转归方向提供一定参考,从而指导医生合理制定后续治疗、干预措施。
综上可知,AIS患者溶栓治疗后UA、NT⁃proBNP、PLR 水平随着病情改善逐渐降低,各指标水平变化与患者预后显著相关,可作为预测患者预后转归方向的参考指标。

