FOXA2过表达对卵巢癌OVCAR3细胞上皮-间充质转化的抑制作用及机制研究
王凯 郭盼盼 管陈安 孙依娜 王俊强 余军辉
卵巢癌是女性生殖系统三大恶性肿瘤之一,其发病率居妇科恶性肿瘤的第二位,死亡率高居首位,是最致命的妇科恶性肿瘤[1]。由于缺乏有效的筛查和早期诊断方法,大多患者确诊时已处于晚期阶段,虽然可进行肿瘤细胞减灭术辅以顺铂和紫杉醇为主的化疗,但临床缓解的平均时间为2年,5年生存率仅为45%[2]。卵巢癌的发生、发展与各种癌基因或抑癌基因异常表达密切相关。
上皮-间充质转化(epithelial-mesenchymal transition,EMT)是指在某些生理或病理状态下出现的上皮细胞向间质细胞表型转变的过程。多项研究表明,EMT在肿瘤进展、癌细胞侵袭、胚胎的发育和器官的形成、伤口愈合及纤维化等一系列生理病理过程中起关键作用[3-5]。在肿瘤的发展及癌细胞的侵袭过程中,EMT降低了细胞之间的黏附性,增强了细胞的侵袭、迁移、抵抗化疗药物的能力[6]。这一过程中上皮性细胞标志物E-钙黏蛋白(E-cadherin)表达下调,间质标志物波形蛋白(Vimentin)表达上调。参与介导EMT的分子机制及信号通路多种多样,其中Wnt/β-catenin的激活能明显增强EMT相关转录因子Snail超家族锌指转录因子(Snail family zinc finger,SNAI)、Twist家族 BHLH 转录因子 (Twist family BHLH transcription factor,Twist)和锌指E盒同源结合蛋白(zinc finger E-box binding homeobox,ZEB)表达,进而增强肿瘤细胞的侵袭转移能力[7]。
叉头框蛋白 A2(Forkhead-box protein A2,FOXA2)又称为肝细胞核因子3β,为DNA结合蛋白,其在胚胎发育的多个环节发挥重要作用。同时研究也表明,FOXA2是一个潜在的EMT调控靶点,FOXA2与多种恶性肿瘤如肺癌、乳腺癌、前列腺癌、肝癌、胰腺癌、食管癌等的发生、发展密切相关[8-10]。另外,也有研究发现FOXA2在卵巢癌组织中较癌旁正常组织中明显下调,且阴性表达者5年病死率较高,说明FOXA2可能作为卵巢癌诊断以及预后的生物标志物[11],但其对卵巢癌及EMT的具体作用及相关分子机制仍不清楚。本研究通过检测过表达FOXA2的卵巢癌细胞的增殖、侵袭能力和EMT发生相关蛋白 E-cadherin和 Vimentin及 Wnt/β-catenin信号通路相关蛋白β-catenin的表达情况,探讨FOXA2过表达对卵巢癌细胞EMT的抑制及可能的作用机制,以期为卵巢癌的早期诊断和治疗以及生物标志物的临床应用提供参考。
1 材料和方法
1.1 材料 人卵巢癌细胞系OVCAR3和正常卵巢上皮细胞IOSE80购买于中国科学院上海细胞库。FOXA2基因序列(基因序列号:NM_021784.5)由生工生物工程(上海)股份有限公司进行全基因合成。FOXA2 pcDNA3.1质粒载体购自美国Invitrogen公司。RIPA buffer(含蛋白酶和磷酸酶抑制剂)购自美国Thermo Fisher公司。PVDF膜购自美国GE Healthcare公司。EndoFree Plasmid Maxi Kit购自德国Qiagen公司。一抗rabbit anti-E-cadherin和rabbit anti-Vimentin均购自美国CST公司。二抗Alexa Fluor594 Affinipure Donkey Anti-Rabbit IgG均购自美国Jackson ImmunoResearch公司。一抗rabbit anti-FOXA2、rabbit anti-β-catenin、rabbit anti-H3 Histone(细胞核内参)以及细胞质内参GAPDH rabbit anti-GAPDH(内参)购自美国Abcam公司。二抗山羊抗兔IgG-HRP及持久性化学发光底物SuperSignal West Dura Extended Duration Substrate购自美国Thermo Fisher公司。
1.2 方法
1.2.1 正常卵巢上皮细胞IOSE80和卵巢癌细胞系OVCAR3的培养和传代 人卵巢癌细胞系OVCAR3和正常卵巢上皮细胞IOSE80分别采用RPMI 1640培养液以及DMEM高糖培养液(含10% FBS以及双抗)进行复苏,在37℃、5% CO2条件下进行培养至融合度90%左右,用胰酶消化,按1∶3传代,置于37℃、5% CO2培养箱内继续培养,取对数生长期细胞用于实验。
1.2.2 IOSE80、OVCAR3细胞FOXA2 mRNA表达水平检测 采用real-time PCR法。收集两种细胞,采用TRIzol试剂提取总RNA,然后按QuantiTectReverse Transcription Kit说明书合成cDNA。以GAPDH为内参,采用PowerUp SYBRTMGreen Master Mix试剂盒进行real-time PCR扩增。具体引物序列见表1。PCR反应体系:10 μl PowerUp SYBRTMGreen Master Mix,4 μl cDNA(cDNA原液按照1:10稀释),0.5 μl正向引物(10 μmol/L),0.5 μl反向引物(10 μmol/L),补加 H2O 至 20 μl。反应条件:95 ℃,1 min;95 ℃,15 s;60 ℃,25 s;共40个循环。每个实验重复3次,每个样品设置3个复孔,其相对表达量采用 2-ΔΔCt法进行计算。

表1 引物序列
1.2.3 FOXA2-pcDNA3.1过表达载体的构建及转染 按照FOXA2基因序列(基因序列号:NM_021784.5),由生工生物工程公司进行全基因合成,同时基因两端引入BamHⅠ和EcoRⅠ酶切位点。将FOXA2合成产物和 pcDNA3.1质粒分别用BamHⅠ和EcoRⅠ进行双酶切、纯化、连接,并转化大肠杆菌DH5α感受态细胞,37℃培养过夜;提取FOXA2-pcDNA3.1重组质粒后进行测序鉴定。鉴定无误后,采用无内毒素质粒大提试剂盒EndoFree Plasmid Maxi Kit进行 FOXA2-pcDNA3.1过表达质粒以及pcDNA3.1对照质粒的提取用于后续的转染实验。细胞转染按照LipofectamineTM3000说明书分别转染FOXA2-pcDNA3.1过表达质粒和pcDNA3.1对照质粒,并设未转染质粒的空白对照组,8 h后换成新鲜完全培养液,48 h后提取总RNA用于后续分析过表达效率,72 h后提取蛋白用于后续Western blot检测。
1.2.4 OVCAR3转染细胞中FOXA2过表达效率检测采用real-time PCR法。收集对照质粒pcDNA3.1以及重组质粒FOXA2-pcDNA3.1转染后的细胞,总RNA提取、逆转录以及定量PCR检测同方法1.2.2。
1.2.5 细胞增殖能力检测 采用CCK-8法。将转染pcDNA3.1对照质粒以及FOXA2-pcDNA3.1过表达质粒24 h后的OVCAR3细胞进行消化收集,细胞计数并调整细胞密度。按每孔2×103/100 μl细胞密度接种96孔板,待细胞贴壁后记为0 h,分别在0、24、48和72 h后加入10 μl CCK-8,在37℃、5% CO2条件下孵育2 h后用酶标仪检测450 nm处的吸光度值以反映细胞增殖能力。每组均作6个复孔,取平均值。
1.2.6 细胞侵袭能力检测 采用Transwell实验。取出Matrigel Invasion Chamber 24 Well恢复到室温,随后加入500 μl无血清培养基,37℃孵育2 h,水化基底膜,吸去多余液体备用。将转染pcDNA3.1对照质粒以及FOXA2-pcDNA3.1过表达质粒24 h后的OVCAR3细胞进行消化收集,采用无血清培养基重悬细胞,调整细胞浓度至 2×105/ml,上室加入 200 μl细胞悬液,下室加入 600 μl含 15% FBS细胞培养液,37 ℃、5% CO2培养箱中孵育48 h后4%多聚甲醛固定30 min,0.1%结晶紫染色30 min,PBS清洗后,倒置显微镜拍照计数。每个组设置3个复孔,每个复孔200倍随机选取5个视野,统计侵袭细胞的平均数。
1.2.7 E-cadherin和Vimentin定位与表达检测 采用细胞免疫荧光实验。将无菌细胞爬片置于12孔板中,取对数生长期的OVCAR3细胞接种于爬片上,当细胞汇合度为50%时,4%多聚甲醛固定爬片,经0.5% Triton X-100/PBS作用5 min,PBS漂洗后加入10%正常驴血清封闭30 min,然后滴加稀释的一抗rabbit anti-E-cadherin(1∶200)和 rabbit anti-Vimentin(1∶200),4 ℃湿盒孵育过夜,阴性对照以PBS代替一抗;PBS漂洗后,滴加稀释的荧光二抗。二抗信息:Alexa Fluor594 Affinipure Donkey Anti-Rabbit IgG(1∶200),4 ℃湿盒暗处孵育 1 h,PBS漂洗后4'6-二脒基-2-苯基吲哚(4'6-diamidino-2-phenylindole,DAPI) 染色 5 min,PBS 再次漂洗后,抗荧光淬灭剂封片。使用激光共聚焦观察594 nm(红色激发波长)显示的荧光并拍照。
1.2.8 EMT相关蛋白表达水平检测 采用Western blot法。上述细胞收集后,加入150 μl RIPA buffer(含蛋白酶和磷酸酶抑制剂)提取总蛋白,BCA法测定蛋白浓度。取每个样品约50 μg蛋白置于10%SDS-PAGE电泳分离,100 V恒压电转至PVDF膜,然后加入5%脱脂奶粉室温封闭1 h。分别加入相应一抗∶rabbit anti-E-cadherin(1∶2 000)、rabbit anti-FOXA2(1∶2 000)、rabbit anti-Vimentin(1∶2 000)以及 rabbit anti-GAPDH(内参,1∶1 000,4 ℃孵育过夜。用 TTBS洗膜 3次(每次5 min),加入山羊抗兔 IgG-HRP二抗(1∶5 000),室温反应 1 h。用TTBS洗膜4次(每次5 min),滴加SuperSignal West Dura Extended Duration Substrate后暗室曝光X-film进行显影,图像采用Image Pro Plus 6.0软件分析条带的光密度,并以GAPDH为内参进行结果分析。每个实验重复3次。
采用NE-PERTMNuclear and Cytoplasmic Extraction Reagents分离细胞质和细胞核蛋白,然后进行BCA定量。Western blot检测方法同上。一抗信息:rabbit anti-βcatenin(1∶4 000)、rabbit anti-H3 Histone(1∶5 000)(细胞核内参)以及细胞质内参GAPDH。
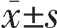
2 结果
2.1 OVCAR3细胞与IOSE80细胞FOXA2 mRNA表达水平比较 与IOSE80细胞相比,OVCAR3细胞FOXA2 mRNA表达水平下调了5.023倍(P<0.05),见图1。因此,后续实验采用OVCAR3细胞过表达FOXA2,探究FOXA2过表达对该细胞的EMT发生的影响。
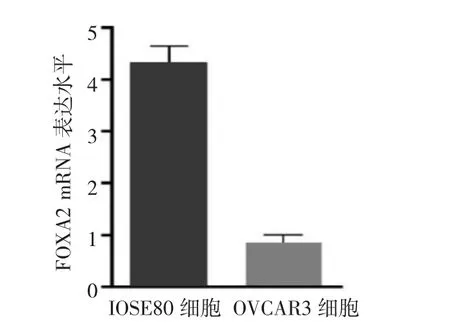
图1 OVCAR3细胞与 IOSE80细胞叉头框蛋白 A2(FOXA2)mRNA表达水平比较
2.2 FOXA2-pcDNA3.1重组载体鉴定、OVCAR3细胞FOXA2过表达效率 通过对全基因合成的FOXA2-pcDNA3.1重组质粒进行测序,测序结果与NCBI数据库的序列比对完全一致,表明成功构建了FOXA2-pcDNA3.1过表达载体。与转染pcDNA3.1对照质粒组及未转染质粒的空白对照组相比,转染FOXA2-pcDNA3.1重组质粒组OVCAR3细胞FOXA2表达水平上调了18.84倍(P<0.05),见图 2。
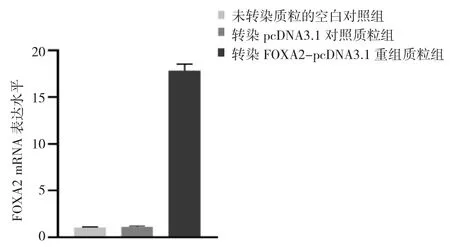
图2 转染FOXA2-pcDNA3.1重组质粒组、转染pcDNA3.1对照质粒组及未转染质粒的空白对照组OVCAR3细胞叉头框蛋白A2(FOXA2)mRNA表达水平比较
2.3 转染FOXA2-pcDNA3.1重组质粒组、转染pcDNA3.1对照质粒组及未转染质粒的空白对照组的OVCAR3细胞增殖能力比较 细胞培养48 h后,与转染pcDNA3.1对照质粒组和未转染质粒的空白对照组相比,转染FOXA2-pcDNA3.1重组质粒组OVCAR3细胞增殖能力明显下降(P<0.05),见图3。
图3 转染FOXA2-pcDNA3.1重组质粒组、转染pcDNA3.1对照质粒组及未转染质粒的空白对照组OVCAR3细胞增殖能力比较
2.4 转染FOXA2-pcDNA3.1重组质粒组、转染pcDNA3.1对照质粒组及未转染质粒的空白对照组的OVCAR3细胞侵袭能力比较 与转染pcDNA3.1对照质粒组和未转染质粒的空白对照组相比,转染FOXA2-pcDNA3.1重组质粒组OVCAR3细胞穿过基底膜的细胞数量明显下调(P<0.05),表明过表达FOXA2使OVCAR3细胞的侵袭能力明显减弱,见图4。
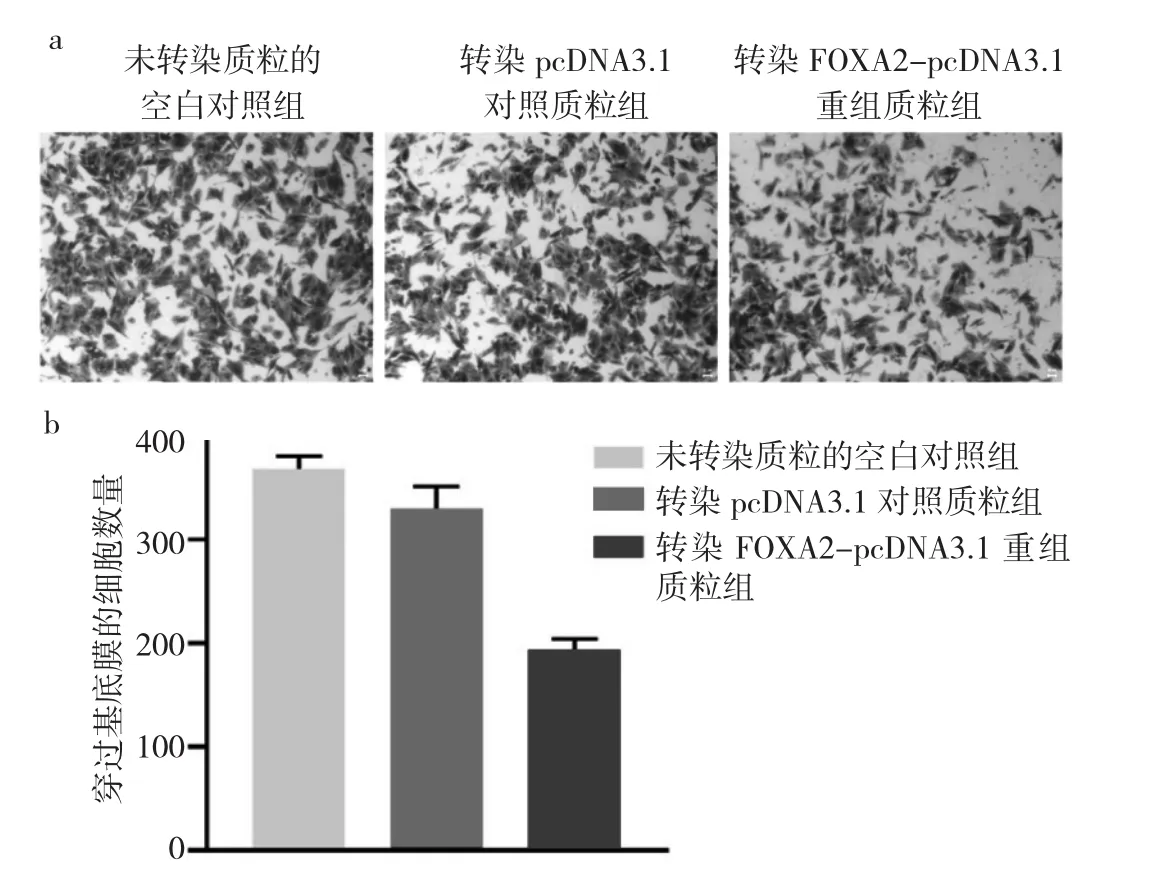
图4 转染FOXA2-pcDNA3.1重组质粒组、转染pcDNA3.1对照质粒组及未转染质粒的空白对照组OVCAR3细胞侵袭能力比较[a:Transwell实验显微镜下所见(×100);b:穿过基底膜的细胞数量比较]
2.5 转染FOXA2-pcDNA3.1重组质粒组、转染pcDNA3.1对照质粒组及未转染质粒的空白对照组OVCAR3细胞 FOXA2、E-cadherin、Vimentin蛋白表达水平比较 与转染pcDNA3.1对照质粒组和未转染质粒的空白对照组相比,转染FOXA2-pcDNA3.1重组质粒组OVCAR3细胞FOXA2、E-cadherin蛋白表达水平均明显上调(均 P<0.05),而 Vimentin表达水平下调(P<0.05),见图5。细胞免疫荧光检测E-cadherin和Vimentin定位及表达,结果显示两种蛋白(红色荧光)主要定位在细胞质,DAPI(蓝色荧光)定位在细胞核。与转染pcDNA3.1对照质粒组和未转染质粒的空白对照组相比,转染FOXA2-pcDNA3.1重组质粒组OVCAR3细胞E-cadherin阳性信号明显增强,而Vimentin阳性信号明显减弱,见图6(插页)。即OVCAR3细胞中,过表达FOXA2明显抑制EMT发生、发展。
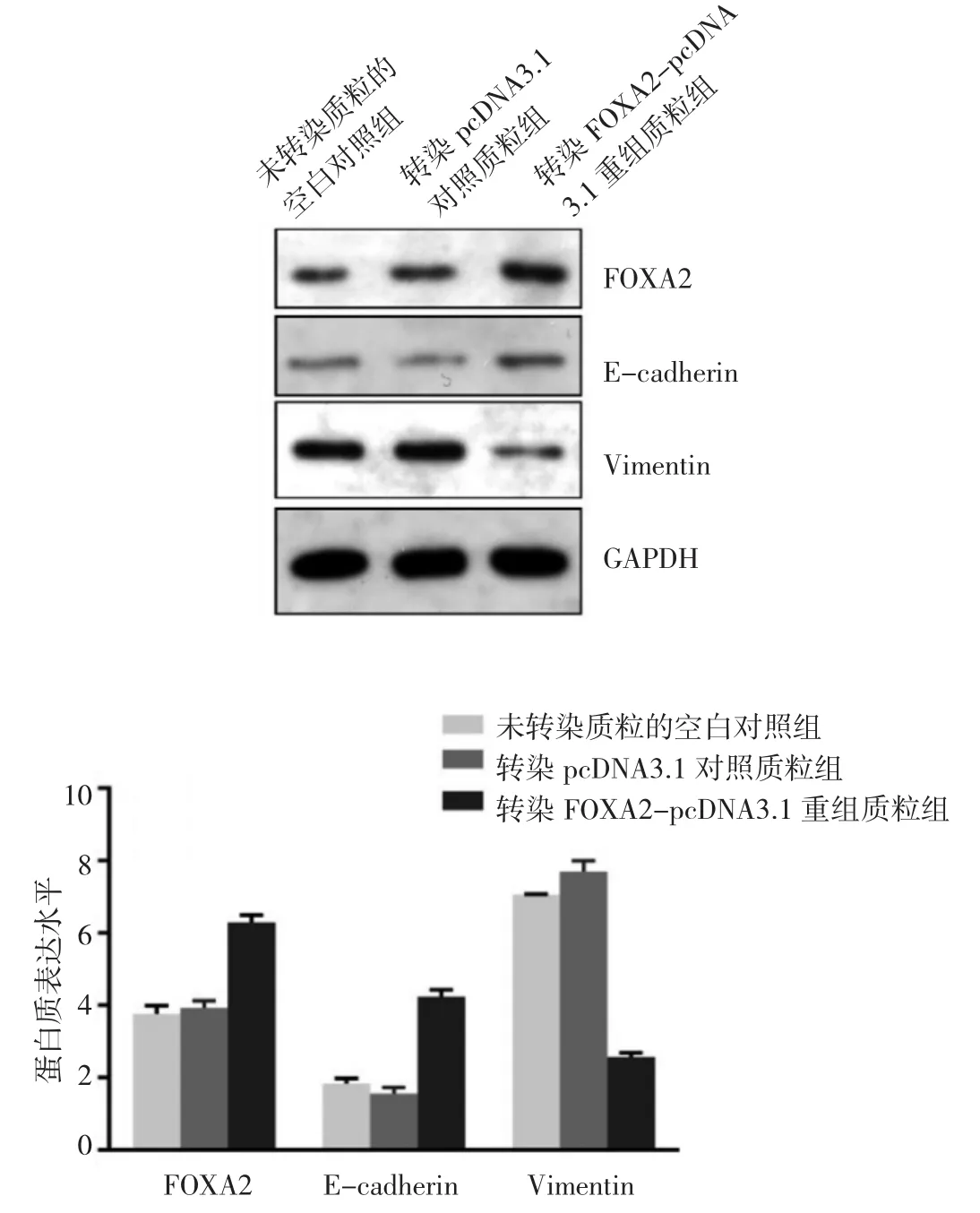
图5 转染FOXA2-pcDNA3.1重组质粒组与转染pcDNA3.1对照质粒组及未转染质粒的空白对照组的OVCAR3细胞叉头框蛋白A2(FOXA2)、E- 钙黏蛋白(E-cadherin)和波形蛋白(Vimentin)表达水平比较
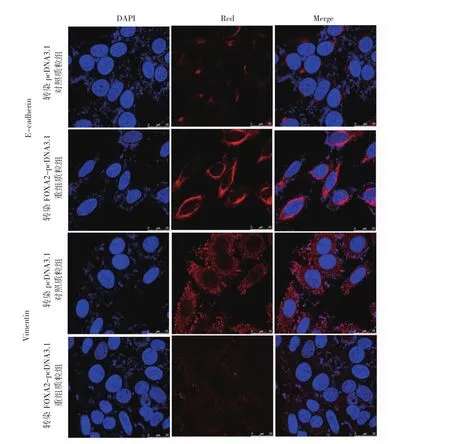
图6 E-钙黏蛋白(E-cadherin)和波形蛋白(Vimentin)在OVCAR3细胞中的定位和表达(蓝色代表DAPI细胞核染色;红色代表E-cadherin和Vimentin细胞质染色;×630)
2.6 转染FOXA2-pcDNA3.1重组质粒组、转染pcDNA3.1对照质粒组及未转染质粒的空白对照组OVCAR3细胞β-catenin蛋白表达水平比较 与转染pcDNA3.1对照质粒组和未转染质粒的空白对照组相比,转染FOXA2-pcDNA3.1重组质粒组OVCAR3细胞β-catenin在细胞质中大量积累,而在细胞核中显著减少(P<0.05),见图7。即OVCAR3细胞中,过表达FOXA2可以显著抑制Wnt/β-catenin信号通路。
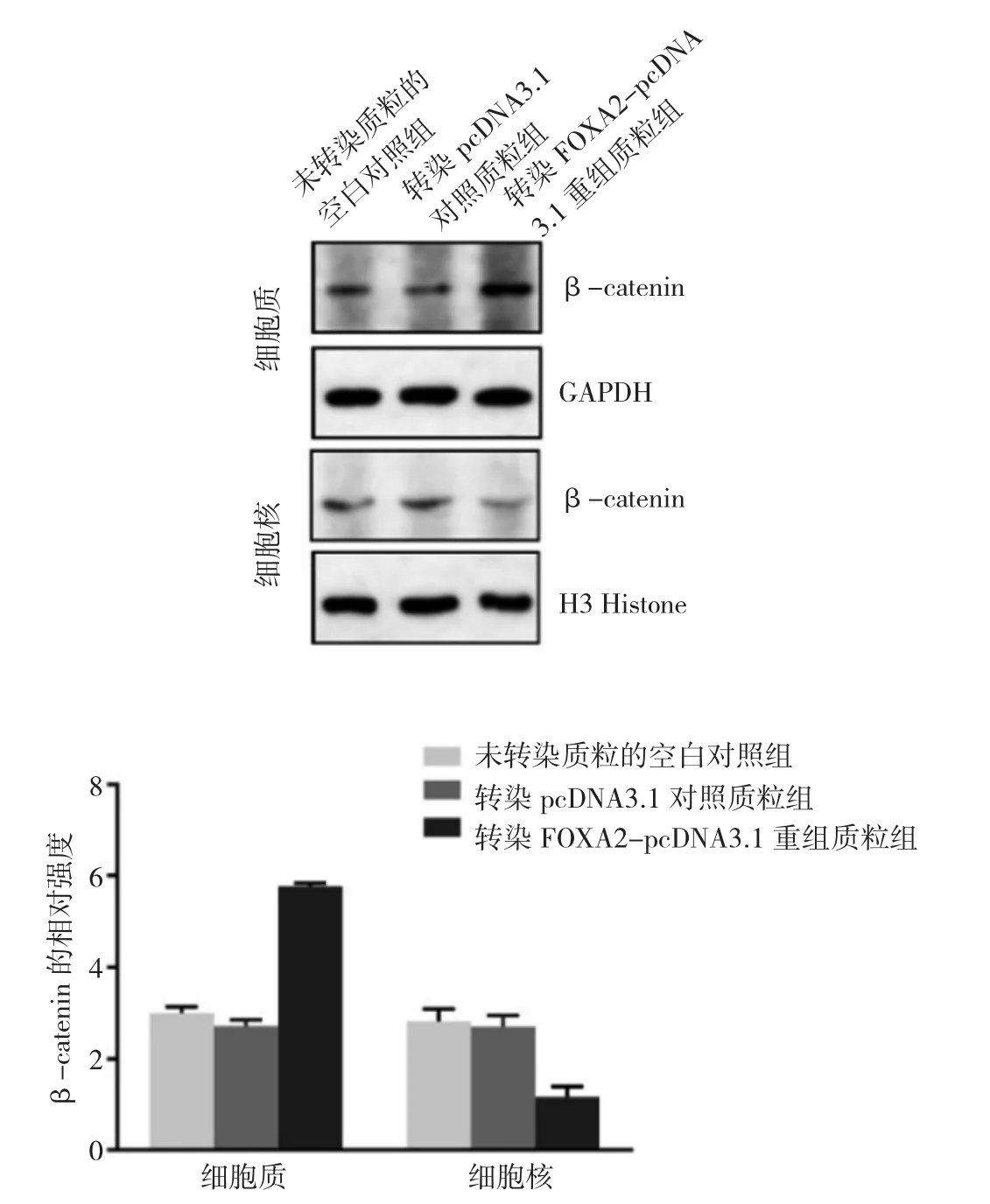
图7 转染FOXA2-pcDNA3.1重组质粒组、转染pcDNA3.1对照质粒组及未转染质粒的空白对照组OVCAR3细胞β-连环蛋白(β-catenin)表达水平比较
3 讨论
卵巢癌是常见的妇科恶性肿瘤之一,但病死率却高居首位。由于卵巢癌发病隐匿,缺乏典型的症状及有效的卵巢癌筛查生物标志物,被诊断时大多患者已经处于卵巢癌的晚期阶段,严重威胁着女性的生命健康[12-13]。因此,探寻有效的卵巢癌生物标志物及发病机制是当下的研究热点。
FOXA2基因位于人的20号染色体上,由3个外显子及2个内含子构成,全长45 kb,包含两段转录激活区域、保守的叉头框区域以及抑制区和磷酸化区[14]。FOXA2作为FOXA家族中的一员在胚胎发育、能量代谢、恶性肿瘤的发生、增殖、浸润及转移等过程中发挥重要作用,同时当FOXA1不足时,FOXA2可以代替FOXA1的功能[15]。在不同的肿瘤中,FOXA2的表达及其作用均不相同。FOXA2的表达情况与肿瘤发生以及恶性转化过程高度相关,而且FOXA2可以通过直接结合在E-cadherin的启动子上激活其表达[16-18]。张震[19]的研究显示FOXA2是乳腺癌E型细胞的相关因子,抑制EMT过程;李正平等[20]研究发现FOXA2是通过上调E-cadherin表达,下调基质金属蛋白酶(matrix metalloprotein,MMP)基因表达,进一步抑制EMT过程来实现对肝癌细胞浸润转移的抑制。张正良等[21]发现FOXA2通过抑制EMT过程进而抑制胃癌的发生、发展。然而Song等[22]发现FOXA2在胰腺癌中促进EMT发生,增加细胞活性诱发肿瘤转移,从而诱发胰腺癌的发生、发展,本研究中FOXA2抑制卵巢癌OVCAR3细胞的增殖和侵袭,该结果与已有研究结果相符。另外本研究结果显示过表达FOXA2会促进E-cadherin蛋白表达,抑制Vimentin蛋白表达,进而抑制EMT过程。说明FOXA2可能通过抑制EMT过程抑制卵巢癌的发生、发展。
Wnt/β-catenin信号通路是高等动物胚胎发育分化过程中的重要信号通路,可以调控相关靶基因参与细胞的增殖、分化、极化、侵袭、凋亡等过程。同时Wnt/βcatenin通路异常也与恶性肿瘤的发生相关,通常表现为正常表达于细胞膜的β-catenin蛋白发生细胞质聚集与细胞核异位表达[23]。有研究表明,β-catenin蛋白在卵巢癌组织中异位聚集表达明显高于癌旁正常组织,说明卵巢癌中存在Wnt/β-catenin通路的活化[24]。而本研究中过表达FOXA2,卵巢癌OVCAR3细胞中β-catenin蛋白在细胞核与细胞质中明显增加,可能激活了Wnt/βcatenin信号通路。这说明过表达FOXA2可能通过调节Wnt/β-catenin信号通路从而影响EMT过程,进而抑制卵巢癌细胞的增殖和侵袭能力。
综上所述,FOXA2过表达可能通过Wnt/β-catenin信号通路影响EMT过程,进而抑制卵巢癌OVCAR3细胞的增殖和侵袭能力。本研究可能为卵巢癌的诊断、治疗以及预后生物标志物的选择提供参考。然而,FOXA2的功能及其在卵巢癌发生中的作用及其具体作用机制还有待进一步研究。

