超声引导下经皮血管内成形术和内瘘切除重建术对自体动静脉内瘘狭窄的疗效比较
张慧,马胜银,高军,宫峰
(皖北煤电集团总医院肾内科,安徽 宿州 234100)
血液透析(hemodialysis,HD)是目前终末期肾病(end stage renal disease,ESRD)的主要治疗手段,良好的血管通路是HD顺利进行和透析充分性的必备条件。目前,维持性血液透析(maintenance hemodialysis,MHD)的血管通路类型有动静脉内瘘(autogenous arteriovenous fistulas,AVF)、中心静脉导管(central venous catheter,CVC)和移植物内瘘(arteriovenous graft,AVG),其中AVF被推荐为MHD患者的首选。但随着透析时间延长,AVF易出现血管内膜增生、血栓或感染等并发症,继而引起AVF狭窄甚至闭塞,导致AVF功能不良甚至丧失功能[1-2]。内瘘切除重建术是临床外科治疗AVF狭窄的经典手段,操作简单方便,但存在手术创伤,且反复手术也存在诸多弊端。超声引导下球囊扩张术(percutaneous transluminal angioplasty,PTA)是近些年AVF狭窄腔内治疗的研究热点,具有技术应用优势。目前关于PTA和内瘘切除重建术治疗AVF狭窄的应用比较报道偏少,二者临床疗效是否存在明显差异仍需研究论证[3]。本研究回顾性分析94例AVF狭窄患者的临床资料,对两种常用治疗手段进行比较,为临床治疗方案选择提供依据。
1 资料和方法
1.1 一般资料
收集2019年9月至2020年9月皖北煤电集团总医院肾内科收治的94例AVF失功患者,对病例资料进行回顾性分析。纳入标准:(1)接受维持性血液透析治疗>6个月,经彩色多普勒血流成像检查,狭窄程度超过周围正常血管内径的50%,内瘘自然血流量<500 mL/min,或透析穿刺困难,透析机泵血流量<200 mL/min[4];(2)完成PTA或内瘘切除重建术治疗;(3)术后成功随访≥6个月。排除标准:(1)临床或随访资料欠缺;(2)AVF完全闭塞;(3)血液透析穿刺困难者。根据血管通路治疗方式不同,将患者分为PTA组(n=50)和手术组(n=44)。两组患者基线资料比较,差异无统计学意义(P>0.05)。见表1。
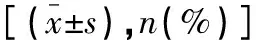
表1 两组AVF失功患者基线资料比较
1.2 方法
PTA组患者术前彩超(PHILIPS HD15彩色多普勒超声仪)检查明确患者血管狭窄位置和走行等信息,并确定合适大小的球囊。选择肱动脉或桡动脉穿刺,穿刺点1%利多卡因局麻,消毒铺巾。超声引导下采用Seldinger技术进行穿刺,置入4F鞘管,鞘管内注射肝素15~20 mg,注入对比剂10~15 mL造影显示狭窄部位。经鞘管置入超滑导丝,导丝通过狭窄部位后,在超声探头引导下沿超滑导丝将球囊导管置入狭窄部位,球囊导管直径超过狭窄部位临近正常血管内径1 mm为宜,一般球囊导管内径4~6 mm,长度20~40 mm。球囊导管与压力泵相连,缓慢向球囊内注水,2~3 s增加1个大气压,使球囊逐渐扩张,扩张压力为8~15 atm,待球囊完全扩张后保持15~30 s,然后缓慢回缩球囊,重复扩张2~4次。超声密切监视球囊扩张回缩过程,待狭窄程度<30%后拔鞘,加压包扎。若球囊扩张1~2次后效果不佳,狭窄程度>30%,可选择直径>1 mm球囊进行扩张。
手术组患者局麻条件下接受内瘘切除重建术治疗,主要步骤:于吻合口近端行长度约2 cm的纵行切口,查找并游离明显粗动脉化的内瘘静脉端,沿吻合口方向分离,找到近端静脉增生狭窄,在静脉远端结扎血管狭窄处,近端用肝素盐水加压扩张。止血夹夹住桡动脉后,行长度为6~8 mm的纵行切口,切除狭窄段,对静脉侧血管进行适当修整,采用Prolene无损伤线对动静脉机端侧连续缝合。松开止血夹见内瘘明显震颤,且无活动性出血后,切口依次缝合处理。
1.3 观察指标
观察下列指标:(1)手术前后超声测量指标,包括内瘘狭窄处血管内径、横断面积和内瘘自然血流量,均由同组自身超声科医师测量。(2)并发症,记录渗血(穿刺点或手术切口)、局部肿胀等常见并发症发生率。(3)术后随访,本研究入选病例均保留≥6个月的随访资料,分别统计两组术后1个月、3个月、6个月AVF通畅率情况。
1.4 统计学分析
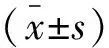
2 结果
2.1 两组内瘘狭窄处超声测量指标比较
两组治疗前内瘘狭窄处血管内径、横断面积和血流量比较,差异无统计学意义(P>0.05);术后1~2 d行彩色多普勒超声检查,上述指标均较术前明显增大,差异有统计学意义(P<0.05)。PTA组和手术组术后超声测量指标比较,差异无统计学意义(P>0.05)。见表2。
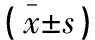
表2 两组内瘘狭窄处超声测量指标比较
PTA典型病例见图1-图2,同1例AVF狭窄PTA手术前后狭窄处的彩超血流图像,男性,59岁,图1,取样框内狭窄处血流颜色为花色,血流充盈较差,血流量248 mL/min,流速明显缓慢;图2,取样框内原狭窄处血流颜色呈蓝色,血流充盈良好,血流量523 mL/min,流速正常。

2.2 两组并发症发生率比较
两组均未发生感染、血栓形成等并发症,仅出现少量渗血和局部肿胀,经加压包扎、按摩和抬高手臂等简单处理后逐渐好转。两组轻度渗血、局部肿胀发生率和总并发症率比较,差异均无统计学意义(P>0.05)。见表3。
2.3 两组术后随访AVF通畅率比较
两组术后1个月AVF通畅率均为100%,PTA组术后3个月、6个月略低于手术组,但差异无统计学意义(P>0.05)。见表4。
3 讨论
AVF是MHD患者目前最理想的血管通路,具有血流量大、使用时间长、操作简单和并发症少等优点[5]。良好的血管通路是MHD患者的生命线,维持血管通路通畅对治疗顺利进行、改善预后等具有重要意义。临床发现,MHD患者易出现AVF狭窄,血栓形成,不利于患者顺利治疗,严重时可危及生命。部分报道[6-7]指出,AVF狭窄的发生因素复杂,3年通畅率不足60%。因此一旦发现AVF狭窄或失功,应立即采取干预措施恢复内瘘通畅,但究竟采取何种治疗方法效果最佳,目前临床尚无定论。
本研究通过回顾分析,比较PTA和内瘘切除重建术两种主要治疗方法的疗效差异。内瘘切除重建术是AVF狭窄的传统治疗手段,术中无需使用造影剂,患者术后能立刻恢复HD治疗,通畅率高,而且费用低廉,在广大基层地区开展广泛。但对于远离内瘘吻合口或存在≥3处节段性的AVF狭窄,会损伤较长的内瘘血管,因此不宜反复手术,以免造成血管资源枯竭[8-9]。随着介入放射学的迅速发展,腔内介入疗法已成为治疗多种血管狭窄性疾病的重要手段。临床经验和动物模型研究[10]表明,PTA治疗AVF狭窄具有操作创伤小、耗时短、出血量少、见效快和并发症少等优点,而且与内瘘切除重建术比较,能充分保护血管资源,重复性好。数字减影血管造影(digital subtraction angiography,DSA)是评估血管狭窄的金标准,既往临床多采用DSA引导下进行PTA治疗,虽然即刻疗效显著,但DSA价格昂贵,在基层医院难以推广,而且可能会造成X线辐射损伤。随着PTA技术不断成熟,超声引导下PTA不仅与DSA引导下PTA的疗效无异,而且具有费用低廉、无辐射损伤和可重复操作等优点[11]。随着超声引导下PTA技术的经验积累,其临床应用价值日益凸显。
本研究显示,PTA组和手术组术后内瘘狭窄程度均<30%,血管内径、横断面积和内瘘自然血流量均较术前明显增大,且组间上述指标并无明显差异,与已有报道[12-13]相符,表明PTA和内瘘切除重建术均能迅速恢复AVF通畅,即时通畅率高。但吴莹等[14]报道发现,PTA术后内瘘狭窄恢复情况在短期内优于内瘘切除重建术,这可能与二者研究样本量、患者血管条件差异等有关。AVF静脉壁较薄,且解剖位置不固定,若血管狭窄程度较重,导丝通过狭窄部位阻力增大,PTA术中操作可引起医源性血管破裂、穿刺部位渗血或局部血肿等并发症。但随着PTA临床操作经验,熟练度不断提高,上述并发症发生现象将会逐渐减少。本研究显示,两组仅出现少量渗血和局部肿胀,经简单处理后好转,组间并发症发生率比较无明显差异,表明超声引导下PTA的安全性较好;且两组术后3个月、6个月AVF通畅率逐渐下降,但组间通畅率比较并无明显差异,提示与内瘘切除重建术比较,PTA并不明显增加AVF再狭窄发生率,二者改善AVF狭窄的近期疗效接近。
本研究也存在不足:未能开展前瞻随机对照研究,证据等级偏低;保留的随访资料参差不齐,仅观察截至术后6个月的AVF通畅率,二者远期疗效是否存在明显差异尚不明确,与刘远浩等[15]研究结论相异。AVF再狭窄发生原因复杂,与血管通路维护、患者血管条件以及血管损伤情况有关[16],后续需扩大样本量进行长期随访观察远期疗效。
综上,PTA和内瘘切除重建术均是AVF狭窄的有效治疗手段,二者各有优势和不足。相较而言,PTA能充分保护患者血管资源,临床应用前景较广阔。

