瓶尔小草不同溶剂提取物的体外生物活性
曾永芳,廖华珍,许海棠, ,王 聪,韦贻春
(1.贵港市疾病预防控制中心,广西贵港 537100;2.广西民族大学化学化工学院,广西南宁 530006)
瓶尔小草(OphioglossumvulgatumL.),又名一支箭、一枝枪、矛盾草等,为蕨类植物,广泛分布于云南、贵州、四川、广西等地。瓶尔小草是我国民间一味重要的中药,具有清热凉血、解毒镇痛之功效。常用于治疗肺热咳嗽、小儿高热惊风、目赤肿痛、胃痛、疔疮痈肿、蛇虫咬伤、跌打肿痛等症[1]。目前,从瓶尔小草同属植物中鉴别分离得到的化合物有氨基酸、有机酸、黄酮类、甾体类及多糖等[2-4]。文献已报道其不仅具有抗病毒、抗溃疡作用,还具有一定的抗肿瘤作用[5-7]。但是,关于瓶尔小草的抗氧化、抑菌和抗增殖方面的研究较少见报道。
越来越多的证据表明许多疾病都与自由基有关,自由基进入细胞破坏DNA,引起细胞损伤、死亡,并引发许多慢性疾病,例如心脑血管疾病、帕金森氏病和癌症等[8]。因此,利用抗氧化剂有效抑制自由基的氧化反应至关重要[9]。然而,研究表明,合成抗氧化剂具有一定的肝脏毒性和致癌作用[10-11],因此,开发和利用安全有效的天然抗氧化剂成为研究热点。近年来,天然产物因具有良好的抗癌活性和低毒性受到人们的关注[9,12]。多酚类化合物普遍存在天然绿色植物中,研究发现植物多酚可以通过阻滞细胞周期、诱导细胞凋亡、免疫调节和增强体内抗氧化酶活性等方面发挥抗肿瘤作用[13-14]。
为了研究瓶尔小草的抗氧化、抑菌和抗增殖活性,本实验对瓶尔小草进行脱脂,然后分别用氯仿、乙酸乙酯、正丁醇、乙醇加以提取,获得不同的提取物。通过测定瓶尔小草各提取物对DPPH自由基,ABTS自由基和羟自由基的清除率进行抗氧化能力的评估;并测定其对6种常见致病菌和1种真菌的最低抑菌浓度,用以评价瓶尔小草不同溶剂提取物的抑菌性;还采用MTT法考察其对3种癌细胞的增殖抑制作用,以期为瓶尔小草的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
瓶尔小草 广西玉林中药材市场提供,经广西中医药大学生药教研室鉴定为瓶尔小草(Ophiolossum vulgatumL.)的干燥茎叶;二苯代苦味酰、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐 Sigmaaldrich公司;金黄色葡萄球菌CMCC26003、普通变形杆菌CMCC49027、肺炎克雷伯氏菌CMCC46117、大肠埃希菌CMCC44102、铜绿假单胞菌CMCC 10104、乙型溶血性链球菌ATCC21059、白色念珠球菌ATCC10231 广东环凯微生物科技有限公司提供;细胞:SKOV3卵巢癌细胞 广西医科大学提供,U251脑胶质瘤和A375黑色素瘤 南京科佰生物科技有限公司提供;细菌培养基、真菌培养基、1640培养基、胰蛋白酶EDTA消化液等 为国产生物制剂;所有分离测试用的试剂 均为分析纯;水为自制超纯水。
全波长酶标仪 Thermo Labsystems公司;CKX41倒置显微镜 日本Olympus公司;5% CO2饱和湿度细胞培养箱 美国Thermo Fisher scientific公司;RE52A旋转蒸发仪 上海亚荣生化仪器厂;SPX-500生化培养箱 宁波江南仪器厂;CMP-TA-20L型超纯水器 成都优越科技有限公司。
1.2 实验方法
1.2.1 不同溶剂提取物的制备 称取干燥的瓶尔小草100 g,剪碎,用800 mL石油醚回流2 h后,取滤渣,挥干溶剂,加入800 mL的氯仿回流提取2次,每次2 h,合并两次滤液,得氯仿提取液。同法,取挥干石油醚的滤渣,分别加入适量乙酸乙酯、正丁醇、乙醇回流提取2次,分别收集滤液。旋蒸提取液,真空干燥后得到瓶尔小草的氯仿、乙酸乙酯、正丁醇和乙醇的4种极性溶剂提取物,储存于-20 ℃待用。
1.2.2 样品溶液的制备 精密称取各提取物,加入1 mL的二甲基亚砜(DMSO),超声波超声助溶,抗氧化实验需配成20 mg/mL的样品溶液,抑菌实验需配成250 mg/mL的样品溶液,抗增殖实验需配成40 mg/mL的样品溶液,测试之前用相应溶剂稀释至适宜浓度。
1.2.3 总黄酮含量的测定 芦丁标准曲线绘制:取6个25 mL容量瓶,分别加入芦丁对照品溶液(0.128 mg/mL)2.0、4.0、6.0、8.0、10.0、12.0 mL,加入5%的亚硝酸钠溶液1.0 mL,振摇,静置6 min;再加入10%的硝酸铝溶液1.0 mL,摇匀,6 min后加入10.0 mL氢氧化钠试液(1 mol/L),加60%乙醇溶液定容,摇匀,放置15 min。以不含芦丁的上述混合溶液为空白溶液,在510 nm处测定吸光值[15]。绘制标准曲线,得方程Y=12.036X+0.0012,r=0.9999,其中,Y为吸光度值,X为浓度值,单位为mg/mL。
样品总黄酮含量测定:精密量取样品溶液1.0 mL,置于50 mL量瓶中,按上述方法操作测定吸光值,并计算总黄酮含量,结果以芦丁当量(每克提取物相当于芦丁的毫克数)表示。
1.2.4 总酚含量的测定 没食子酸标准曲线绘制 取一批试管,分别加入不同浓度没食子酸标准溶液(20、40、60、80、100 μg/mL)0.1 mL,加入0.5 mL福林酚试剂和7.9 mL水,避光放置5 min,加入1.5 mL碳酸钠溶液(10%,w/v),避光放置2 h后在765 nm波长处测定吸光值[15]。绘制标准曲线,得方程Y=0.0106X+0.174,r=0.9991,其中,Y为吸光度值,X为浓度值,单位为μg/mL。
样品总酚含量测定:精密量取样品溶液各0.1 mL,置于试管中,按上述方法处理后测定吸光值,计算总酚含量,结果以没食子酸当量(每克提取物相当于没食子酸的毫克数)表示。
1.2.5 抗氧化活性的测定 本实验主要是通过测定瓶尔小草各溶剂提取物对DPPH自由基、ABTS自由基和羟自由基的清除能力来评价其抗氧化活性。
参照文献[16]测定瓶尔小草各提取物的DPPH自由基清除能力。配制DPPH溶液(0.1 mmol/L)以及不同浓度的各提取物溶液,按文献方法分别取两种溶液等体积混匀,避光放置30 min,以抗坏血酸溶液为对照,在517 nm处测定吸光度。计算清除率的公式如下:
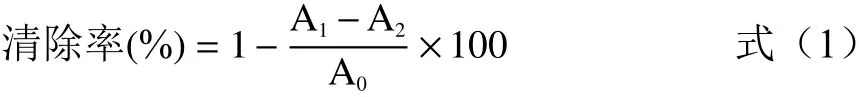
式中,A1为 DPPH溶液+样品溶液的吸光值;A2为样品溶液+无水乙醇的吸光值;A0为DPPH溶液+无水乙醇的吸光值。
测定ABTS自由基清除率,参照吴丰鹏等[17]的方法配制ABTS+工作液,精密吸取ABTS+溶液3.8 mL和样品溶液0.2 mL混合摇匀,6 min后在734 nm波长处测定吸光值,清除率的计算公式为:
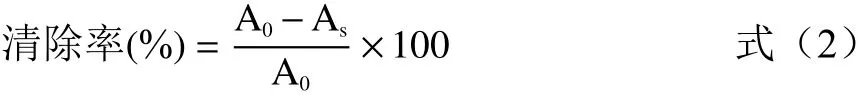
式中,A0为空白溶液的吸光值,As为样品溶液吸光值。
羟自由基清除能力的测定参考夏秀芳等[18]的方法,实验前配制好不同浓度的样品溶液,抗坏血酸溶液以及反应需要的各溶液:磷酸盐缓冲液(pH=7.4),邻菲罗啉溶液(5 mmol/L),硫酸亚铁溶液(7.5 mmol/L)和1%双氧水溶液。按表1依次加入各溶液分别配制损伤管,未损伤管和样品管。将管中溶液充分混合均匀后,置于37 ℃水浴反应1 h,在536 nm处测吸光值。样品管、损伤管和未损伤管测得的吸光值分别记为A样、A损、A未损,清除率计算公式为:
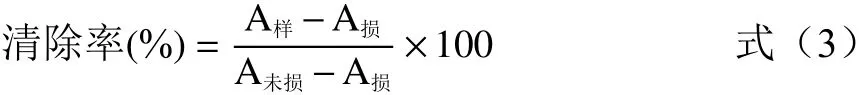

表1 配制各试验管所需溶液(mL)Table 1 Preparation of solutions for test tubes(mL)
1.2.6 抑菌活性的测试 参照文献[19],采用微量二倍稀释法测定最低抑菌浓度(MIC)。在聚乙烯96孔板上进行:先往每个孔加入液体培养基100 μL,然后吸取灭菌的样品溶液(10 mg/mL)100 μL加入第1孔中,混匀后吸取100 μL加入到第2孔中,依此类推,得到一系列浓度的样品孔。每个样品做3个平行试验行。向样品孔中加入100 μL检验菌液(106CFU/mL);阳性对照孔只加液体培养基和菌液;阴性对照孔不加菌液。实验结束后,将各细菌试验板置于生化培养箱中,设定37 ℃培养24 h;白色念珠球菌试验板置于28 ℃生化培养箱培养48 h,观察结果。
1.2.7 抗肿瘤活性测定 采用MTT法,参照文献[20]进行测定。SKOV3卵巢癌细胞经过活化培养后,将细胞悬液的密度控制在1×105个/mL,分别取100 μL接种于96孔板中,并于37 ℃、5% CO2、饱和湿度的培养箱中培养24 h。待细胞贴壁后,将孔内培养基吸出,将含有不同终浓度(0、25、50、100、200、400 μg/mL)样品溶液的培养基100 μL加入到96孔板中,并培养48 h。每个梯度接种5个平行孔。培养完全后,吸去上清液,向各孔中加入20 μL的MTT溶液(5 mg/mL),继续培养4 h。吸去孔内的上清液,每孔再加入100 μL DMSO,振荡10 min,使结晶物充分溶解,在490 nm处测定各孔吸光度值。细胞增殖抑制率的计算公式为:
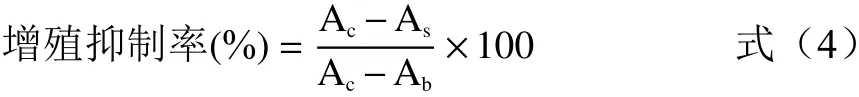
式中,As为加药孔的吸光值,Ac为对照孔(含有细胞,不加药物处理)的吸光值,Ab为空白孔(只加培养基)的吸光值。
本实验中考察了正丁醇提取物对U251脑胶质瘤和A375黑色素瘤癌细胞的抗增殖作用,按上述同法操作。
1.3 数据处理
所有实验分别取样重复测定3次,结果用平均值±标准差表示。数据采用Excel 2010和SPSS17. 0软件处理,并采用Origin8.0软件作图。
2 结果与分析
2.1 总黄酮和总酚含量
瓶尔小草4种溶剂提取物的总黄酮和总酚含量如表2所示。从表中可以看出,正丁醇提取物中的总黄酮和总酚含量都是最高的,达到了3.35和18.40 mg/g;其次是乙酸乙酯提取物,含量分别是1.63和5.98 mg/g。总黄酮含量最低的是乙醇提取物,只有0.94 mg/g;总酚含量最低的是氯仿提取物,含有2.63 mg/g。植物多酚具有多元酚的结构,极性较大,易溶于正丁醇和乙酸乙酯中[21],因此,正丁醇和乙酸乙酯提取物中的总黄酮和总酚含量较高。
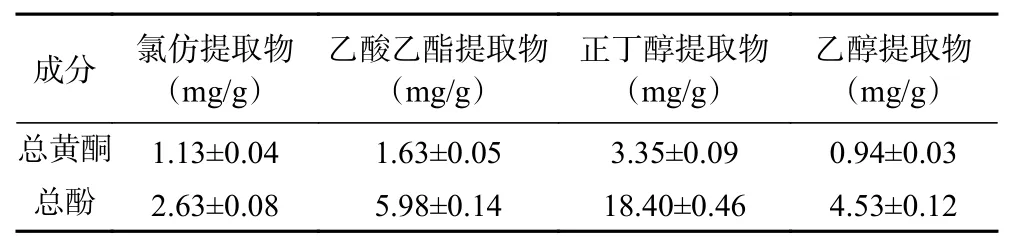
表2 总黄酮和总酚含量测定结果Table 2 Content of total flavonoids and total phenols
2.2 DPPH自由基清除能力
各提取物清除DPPH自由基的能力见图1,由图1可看出各提取物在试验范围内呈量效关系。当浓度从0.2增至1.0 mg/mL时,氯仿、乙醇和乙酸乙酯提取物对DPPH自由基的清除率由17.4%、38.2%、49.8%分别上升至48.4%、91.1%、92.6%。当浓度为0.2 mg/mL时,正丁醇提取物的清除率已超过90%,远优于另外3个提取物,且与抗坏血酸较为接近。通过对各样品溶液与清除率进行回归分析,得到氯仿、乙酸乙酯、正丁醇、乙醇提取物清除DPPH自由基活性的IC50(清除50%的自由基所需要的样品质量浓度)值依次是0.965、0.243、0.114、0.326 mg/mL。显然,对DPPH自由基清除能力最强的是正丁醇提取物,最弱的是氯仿提取物。
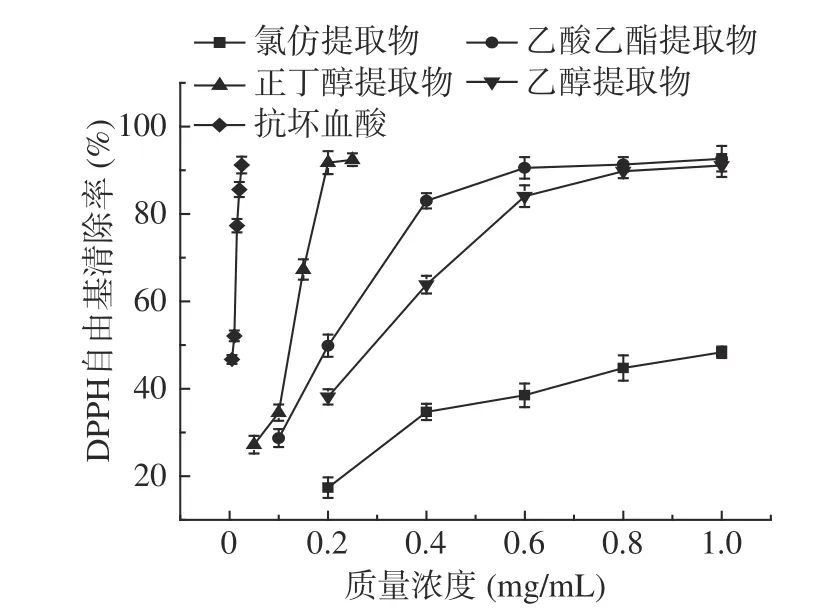
图1 瓶尔小草提取物对DPPH自由基的清除能力Fig.1 DPPH radical scavenging ability of extracts from Ophiolossum vulgatum L.
将不同提取物的总酚、总黄酮含量测定结果与不同方法测得的抗氧化能力结果作了相关性分析,结果见表3。从表3可以看出,瓶尔小草提取物清除DPPH自由基的能力与总酚、总黄酮的相关系数分别为0.669和0.583,表明酚酸和黄酮类化合物为瓶尔小草中清除DPPH自由基的主要作用成分。
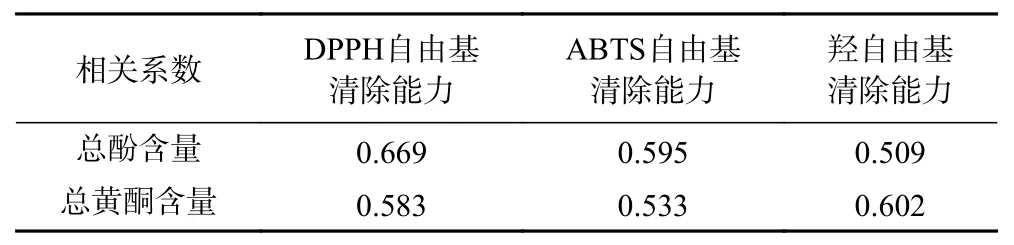
表3 抗氧化能力与总酚、总黄酮含量的相关性Table 3 Correlation analyses between antioxidant capacity with content of total flavonoids and total phenols
2.3 ABTS自由基清除能力
各提取物清除ABTS自由基的结果如图2所示,正丁醇、乙酸乙酯和乙醇提取物在0.2~2 mg/mL的范围内量效关系明显,呈较好的线性关系。由线性方程计算出氯仿、乙酸乙酯、正丁醇、乙醇提取物清除ABTS自由基活性的IC50值分别为4.34、1.02、1.07和1.90 mg/mL。显然,乙酸乙酯提取物和正丁醇提取物清除能力较强,且很接近;氯仿提取物的清除能力明显低于其它3种提取物。从表3可看出,ABTS自由基清除能力与样品中总酚和总黄酮的含量具有较高的相关性,相关系数分别为0.595和0.533,表明酚类和黄酮类化合物对ABTS自由基清除能力都有贡献。
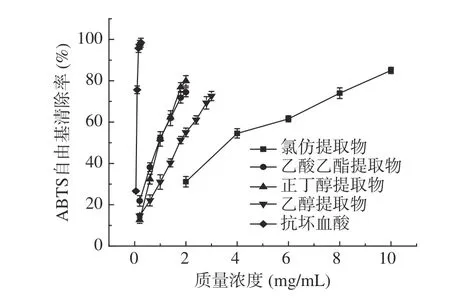
图2 瓶尔小草提取物对ABTS自由基的清除能力Fig.2 ABTS radical scavenging ability of extracts from Ophiolossum vulgatum L.
2.4 羟自由基清除能力
各提取物清除羟自由基的结果见图3。由图3可知,瓶尔小草各提取物对羟自由基的清除能力与浓度呈现很好的线性关系,增幅明显。由拟合的线性方程得到氯仿、乙酸乙酯、正丁醇、乙醇提取物羟自由基清除活性的IC50值分别为1.38、2.44、1.23、2.65 mg/mL。由IC50值可以推断对羟自由基清除能力最好的是正丁醇提取物,其次是氯仿提取物,清除作用最弱的是乙醇提取物,四者的清除能力都弱于抗坏血酸。强弱趋势与清除DPPH和ABTS自由基的趋势不一样,可能与样品对各自由基的清除原理不同有关。相关性分析结果显示,样品中总酚和总黄酮的含量与羟自由基清除能力具有较高的相关性,相关系数分别为0.509和0.602,表明瓶尔小草中黄酮类化合物对羟自由基清除能力的贡献大于酚酸类化合物。
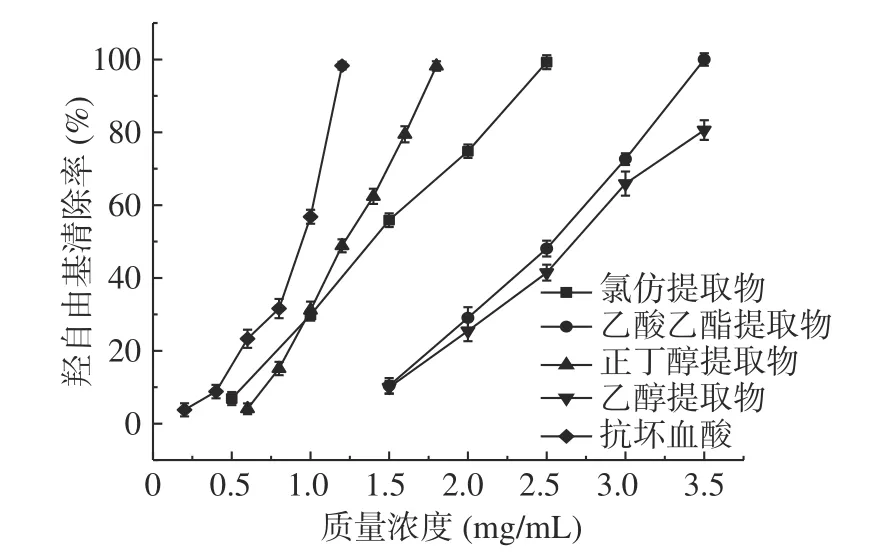
图3 瓶尔小草提取物对羟自由基的清除能力Fig.3 Hydroxyl radical scavenging ability of extracts from Ophiolossum vulgatum L.
有文献报导了提取物中较高的酚酸和黄酮含量与抗氧化活性呈正相关[22],本实验结果与文献的研究结果一致。瓶尔小草各提取物对自由基的清除活性具有差异性与总酚和总黄酮含量有关,总酚和总黄酮含量最高的正丁醇提取物表现为抗氧化能力最强。
2.5 MIC测定结果
瓶尔小草各提取物对各供试菌的最低抑菌浓度见表4。由表4可知,4种瓶尔小草提取物对不同试验菌的抑制性表现出明显差别。氯仿提取物对大肠埃希菌抑制效果最好(MIC为1.25 mg/mL),但是对铜绿假单胞菌抑制效果最差。乙酸乙酯提取物对乙型溶血性链球菌的抑制效果很好(MIC为0.313 mg/mL),但是对大肠埃希菌和肺炎克雷伯氏菌的抑制效果最差。正丁醇提取物表现出较好的抑菌效果,除了大肠埃希菌,对于其它6种试验菌的MIC均为4个提取物中最低。乙醇提取物对7种试验菌的抑制效果一般,为4个提取物中最差。总的来说,瓶尔小草各提取物都具有一定的抑菌作用,正丁醇提取物对其中6种试验菌的抑制效果最强,说明其具有较强的广谱抑菌性,提示其在呼吸科、皮肤科、外科及妇科等疾病治疗方面有良好的应用前景。正丁醇提取物对病原微生物具有较强的杀菌活性,这可能与其功能成分如多酚、黄酮类化合物的含量较高有关[23]。前人研究结果表明,植物多酚具有较强的抗病毒和抗菌作用[24]。
2.6 抗增殖测定结果
瓶尔小草各提取物对SKOV3卵巢癌细胞增殖的抑制活性结果见图4。研究结果表明,提取物浓度在25~400 μg/mL浓度下与癌细胞共培养48 h,SKOV3细胞的增殖受到抑制,并呈剂量依赖关系。正丁醇提取物对SKOV3细胞的抑制活性最强,当样品浓度为200、400 μg/mL时,正丁醇提取物的抑制率分别为82.5%和95.9%;其次是乙酸乙酯提取物,当样品浓度为400 μg/mL时,其抑制率为52.3%。
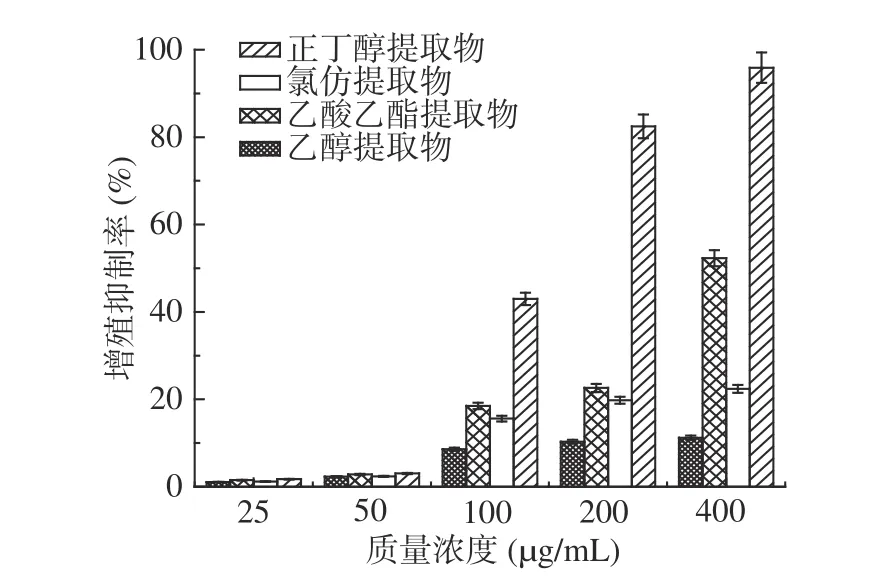
图4 瓶尔小草提取物对SKOV3细胞增殖的抑制作用Fig.4 Proliferation inhibition of SKOV3 cells of extracts from Ophiolossum vulgatum L.
进一步研究正丁醇提取物对U251脑胶质瘤和A375黑色素瘤细胞的抑制作用,并与它对SKOV3卵巢癌细胞的作用结果相比较,见图5。从图中可看出,瓶尔小草正丁醇提取物对3种癌细胞都比较敏感,对SKOV3卵巢癌细胞的抑制作用最强,其次是对U251脑胶质瘤细胞,最后是A375黑色素瘤细胞。通过软件数据分析,得到IC50依次是114.5、160.5、196.9 μg/mL。本实验中,瓶尔小草正丁醇提取物的总酚和总黄酮含量都是4种提取物中最高的,其较强的细胞增殖抑制作用,可能是由于其酚类和黄酮类等活性化合物的存在所致。这与以前的研究吻合,植物来源的酚类化合物已被证明能抑制或延缓癌细胞的增殖[25-26]。
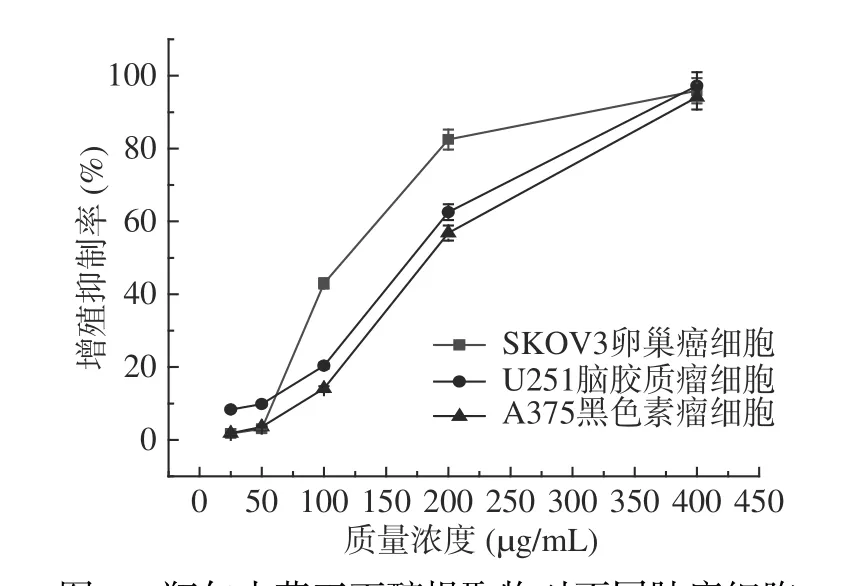
图5 瓶尔小草正丁醇提取物对不同肿瘤细胞生长的抑制作用Fig.5 Inhibitory effect of the n-butanol extract from Ophiolossum vulgatum L. on the growth of different tumor cells
3 结论
本研究通过对DPPH·、ABTS+、羟自由基的清除能力的测定来评价瓶尔小草提取物的抗氧化活性,发现瓶尔小草的不同溶剂提取物都具有一定的抗氧化活性,其中正丁醇提取物的抗氧化活性较强。此外,在抑菌活性测试实验中,各提取物在一定程度上可以抑制7种试验菌的生长,其中正丁醇提取物表现出较强的广谱抑菌性。在癌细胞抗增殖试验中,正丁醇提取物对SKOV3卵巢癌细胞、U251脑胶质瘤和A375黑色素瘤的细胞增殖均具有一定的抑制作用。相关性分析表明,瓶尔小草提取物的抗氧化能力与总酚、总黄酮含量正相关。正丁醇提取物的总酚、总黄酮含量在4种瓶尔小草提取物中最高,其对DPPH自由基的清除效果最佳,IC50为0.114 mg/mL;对乙型溶血性链球菌、铜绿假单胞菌和白色念珠球菌的MIC最低,为0.313 mg/mL;对SKOV3卵巢癌细胞的抑制作用最强,IC50为114.5 μg/mL。因此,可将瓶尔小草正丁醇提取物作为下一步研究重点,分离有效活性成分,确定其化学组成和结构,开发出安全有效的抗氧化剂、抑菌剂和抗癌药,以用于食品与医药领域。

