亚油酸水合酶生物合成微生物源羟基不饱和脂肪酸的研究进展
彭舒悦,梁暖意,张延镇,郭前婉,王 琪,赵 萌, ,Michael G. Gänzle,
(1.发酵工程教育部重点实验室,湖北省食品胶体国际科技合作基地,湖北省工业微生物重点实验室,湖北工业大学,湖北武汉 430068;2.农业、食品与营养科学系,阿尔伯塔大学,加拿大埃德蒙顿 T6G 2P5)
羟基不饱和脂肪酸(Hydroxy unsaturated fatty acids, HUFA)是一类具有羟基及不饱和键结构的特殊脂肪酸,主要有马桑酸(13-羟基-9,11-十八碳二烯酸)、蓖麻油酸(12-羟基-9-十八碳烯酸)、10-羟基-12-十八碳烯酸(10-HOE)、13-羟基-9-十八碳烯酸(13-HOE)等。特定结构的HUFA具有真菌抑制[1-2]、细菌抑制[3]、抗炎[4-5]、抗癌[6-7]等功能特性,其在生物医药领域应用潜力巨大,近年来,其合成方法及功能特性受到关注。
HUFA的合成途径主要包括化学合成、植物提取、生物转化(酶转化或细胞转化)三种方法。化学合成法一般缺乏特异性,会生成目标产物HUFA的一系列异构化合物,通常需要进行较复杂的下游纯化[8-9]。植物提取法可用于从植物本身油脂成分中分离HUFA,该方法较为简单、产率高、特异性强,但该法受限于特定的植物来源以及HUFA的结构种类(如马桑酸和蓖麻油酸)[10];或从植物受致病菌侵染时产生的防御反应物质中提取,这些防御反应物质成分一般较为复杂[11]。生物转化法产物较为简单、反应特异性强、对环境友好,已成为HUFA制备的主流途径。
加拿大阿尔伯塔大学Gänzle团队深入探索了多种HUFA的相关抑菌特性及应用[10,12],发现10-HOE及13-HOE在抑制真菌效果上表现优异,作为食品中的天然防腐剂具有良好的发展潜能[1]。10-HOE、13-HOE是目前研究最多的两种微生物源HUFA,可利用亚油酸水合酶通过生物转化法催化亚油酸合成[13-14]。韩国建国大学Oh团队[14-15]所报道的高效13-HOE的酶法合成及细胞合成,可使转化率达79%。本文首先介绍了10-HOE及13-HOE这两种典型HUFA的发展现状及功能特性,对其在食品等方面的应用做出展望;然后概述了10-HOE及13-HOE生物转化制备过程中起重要作用的亚油酸水合酶,总结其底物及结构特性、在HUFA转化中应用的相关研究进展等。
1 微生物源HUFA概述
HUFA广泛存在于自然界中,典型的HUFA主要有马桑酸、蓖麻油酸、10-羟基-12-十八碳烯酸(10-HOE)、13-羟基-9-十八碳烯酸(13-HOE)等,其生产方式如表1所示。马桑酸及蓖麻油酸合成方法多样,目前均可进行高效制备[2,16-17]。7,10-二羟基-8-十八碳烯酸、7,10,12-三羟基-8-十八碳烯酸相关功能特性研究较少,且微生物合成步骤较为繁琐[18]。10-HOE、13-HOE主要经肠道乳酸菌[19]、发酵制品微生物[1]等微生物直接合成,属于典型的微生物源HUFA。与其它HUFA相比,10-HOE及13-HOE抑真菌性良好,具有抗炎、抗过敏等功能,在生物医药领域应用潜力大。且微生物法合成10-HOE及13-HOE具有产物合成效率高、副产物少等优点。

表1 不同羟基不饱和脂肪酸的生产方式Table 1 Preparation of different hydroxyl unsaturated fatty acids
1.1 10-HOE及13-HOE的结构及来源
1.1.1 10-羟基-12-十八碳烯酸(10-HOE) 10-羟基-12-十八碳烯酸(10-OH C18:1,10-HOE),分子式为C18H34O3,分子量为298.450,结构如图1所示,其结构中包含一个12-位碳碳双键和一个10-位羟基[1]。10-HOE首次发现于1983年,Takatori等[20]用氯仿/甲醇(2:1,v/v)提取死亡人体中的总脂,在5%盐酸甲醇溶液中甲酯化,对收集的脂肪酸甲酯进行薄层色谱(TLC)、气液色谱(GLC)和气相色谱质谱(GCMS)检测时,发现一种未知的脂肪酸甲酯,最终通过结构分析确定该脂肪酸为10-HOE,并指出亚油酸为10-HOE的合成底物。
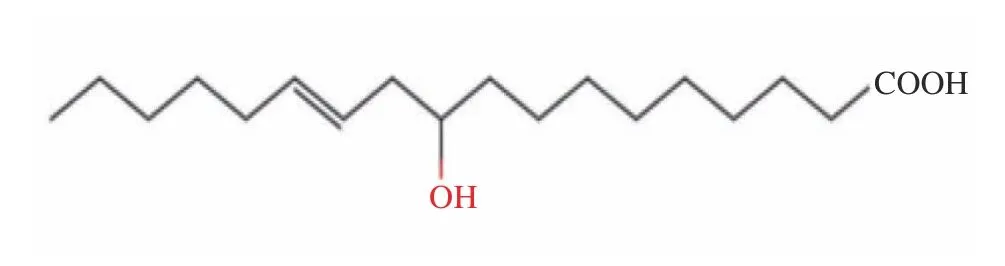
图1 10-HOE的分子结构Fig.1 Molecular structure of 10-HOE
随后,有研究报道Streptococcus pyogenes[21]等野生菌具有将亚油酸合成10-HOE的能力。Bergamo等[22]、Miyamoto等[23]发现肠道菌群也可将膳食亚油酸转化为10-HOE,并对肠道的免疫功能及稳态起到重要的调节作用。10-HOE不仅可由亚油酸作底物合成,与共轭亚油酸也有着密不可分的联系。Kishino等[19]在对乳酸菌的研究中发现:10-HOE在积累到一定程度后转化为10-氧-顺式-12-十八烯酸、10-氧-反式-11-十八烯酸、10-羟基-反式-11-十八烯酸,最后合成共轭亚油酸,其合成途径如图2所示。2019年
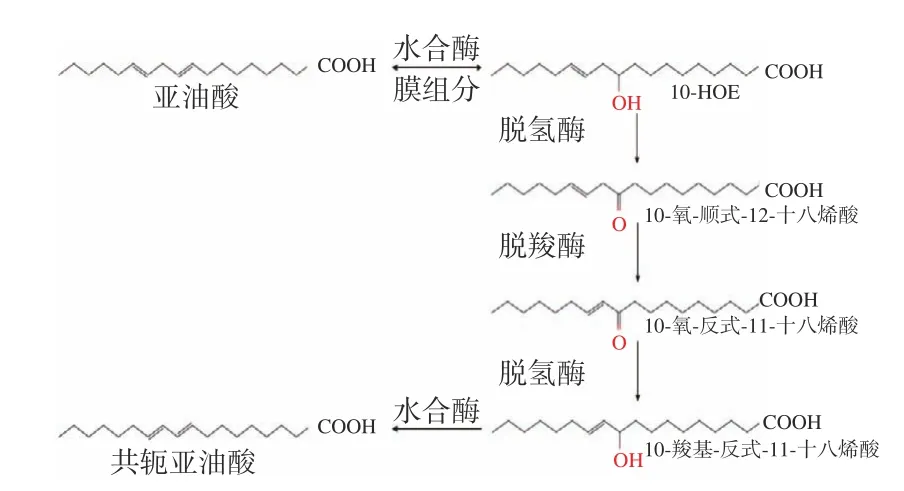
图2 10-HOE及共轭亚油酸的合成途径Fig.2 Synthesis of 10-HOE and conjugated linoleic acid
Gao[24-25]进一步研究证实了双歧杆菌中10-HOE可通过多组分酶系统转化为共轭亚油酸,在亚油酸过量产生胁迫时,提供新的合成共轭亚油酸的途径,同时10-HOE的含量与亚油酸水合酶的表达水平呈正相关。
1.1.2 13-羟基-9 -十八碳烯酸(13-HOE) 13-羟基-9 -十八碳烯酸(13-OH C18:1,13-HOE),分子式为C18H34O3,分子量为298.450,结构如图3所示,其结构中包含一个9-位碳碳双键和一个13-位羟基[1]。
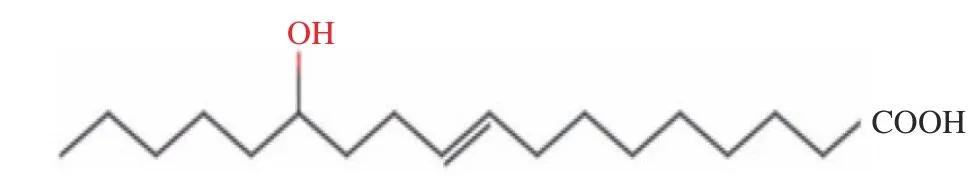
图3 13-HOE的分子结构Fig.3 Molecular structure of 13-HOE
1998年Hudson等[26]从哺乳期奶牛的新鲜粪便中分离出两株Enterococcus faecalis,加入亚油酸进行培养后利用高效液相色谱法(HPLC)和GC/MS对产物进行鉴定,结果显示亚油酸通过水合作用不仅可产生10-HOE,还首次利用细菌合成了13-HOE。该团队继续寻找亚油酸水化菌,从牛粪便中分离出Streptococcus bovis和S. bovisJB1,发现这两个菌株可水化亚油酸且只生成13-HOE,其中利用S. bovis合成13-HOE的产率可达28%。
2003年Kishimoto等[27]对86株乳酸菌进行培养鉴定,发现有两株Lactobacillus acidophilus和一株Pediococcus pentosaceus具有将亚油酸转化合成13-HOE的能力,其中L. acidophilus13951的合成能力最强,并且该研究首次确定了13-HOE的立体结构为S型。2013年Takeuchi等[28]进一步筛选了300株乳酸菌,研究其对13-HOE的合成能力,结果发现大多数菌株可合成13-HOE,其中Pediococcussp.AKU 1080最具潜力,可特异性将2 mg/mL亚油酸转化合成0.4 mg/mL的13-HOE。Chen等[13]采用10-亚油酸水合酶(linoleate 10-hydratase, 10-LHT)基因(lah)缺陷突变株Lactiplantibacillus plantarumTMA1.460Δlah,将底物亚油酸转化成13-HOE,并成功提纯13-HOE研究其抗真菌特性。13-HOE主要由含有亚油酸水合酶的菌株催化亚油酸转化而来,且不同的亚油酸水合酶可合成不同的HUFA。
1.2 10-HOE、13-HOE的功能特性
1.2.1 抑真菌性 HUFA具有良好的真菌抑制特性,而在食品腐败真菌中,HUFA抗真菌性主要针对的是霉菌而非酵母菌[12],2013年加拿大阿尔伯塔大学Gänzle团队首次在发酵面团中发现Levilactobacillus hammesii可转化亚油酸生成10-HOE,同时证实,与传统面包相比,用该发酵面团制备的面包货架期延长了2~6 d以上,其真菌抑制效果可与商品化真菌抑制剂丙酸(添加量为4%)媲美[1,29],且对面包的感官特性无不良影响。Quattrini等[30]认为HUFA在酸面团面包中的抗菌作用源于HUFA与醋酸等抗菌物质的协同作用。该团队系统性研究了10-HOE、13-HOE、马桑酸、蓖麻油酸等HUFA的真菌抑制特性。如表2所示,10-HOE、13-HOE、马桑酸、蓖麻油酸等HUFA对A. niger和P. roqueforti的抑制最明显,其MIC值均小于0.5 g/L。与HUFA相比,亚油酸、油酸不含羟基;12-羟基硬脂酸、9,12–二羟基硬脂酸不含不饱和键;硬脂酸中羟基及不饱和键都不具备,这五种物质的MIC均大于20 g/L,真菌抑制效果不明显[1,13]。研究表明10-HOE、13-HOE的羟基及不饱和键是它们抗真菌特性的重要结构特征[1,10,13];碳链中羟基的位置也对HUFA的抗真菌效果起到关键作用:羟基位于C9~C13位置的碳18HUFA抑制了霉菌P. roqueforti和A. niger生长,而羟基位于C2及C18位置的HUFA对霉菌抑制作用较小[12]。此外,其他乳酸菌来源的3-OH C10-12脂肪酸也被报道具有抗真菌作用[31]。HUFA所具有的广泛抑真菌谱使其可作为一种新型天然防腐剂应用于食品中,目前部分研究探索了以HUFA为代表的脂肪酸氧化产物在植物抗病、抗致病真菌方面的功能[11,32],虽未有文献报道10-HOE和13-HOE在这方面的功能,但与其结构类似的马桑酸、马桑酸9-OH同系物及C18:3的HUFA同系物均在植物抗病毒中发挥了重要的作用。例如,研究[33-34]发现,转基因水稻植株(transgenic rice(F78Ri))对稻瘟病菌Magnaporthe grisea有抗性,其C18:2脂肪酸到C18:3脂肪酸的转化途径受到抑制,该额外积累的C18:2脂肪酸转化成马桑酸等系列HUFA、其它脂肪酸氧化物和过氧化产物,这些积累的脂肪酸代谢产物均能抑制M.grisea的孢子萌发及生长。据报道,一些HUFA与产生这些HUFA的酶在不同的植物防御代谢途径中均起到重要的作用,如羟基在脂肪酸碳链中部(13-OH及9-OH羟基脂肪酸)、羟基在脂肪酸碳链两端(2-OH及w-OH脂肪酸)的HUFA[35]。这些与细菌源HOE结构极其类似的HUFA在植物抗病中有一定的应用前景,由此推测细菌源的10-HOE和13-HOE在植物防御方面可能有类似的调控作用,但该方面的研究及应用还没有报道。
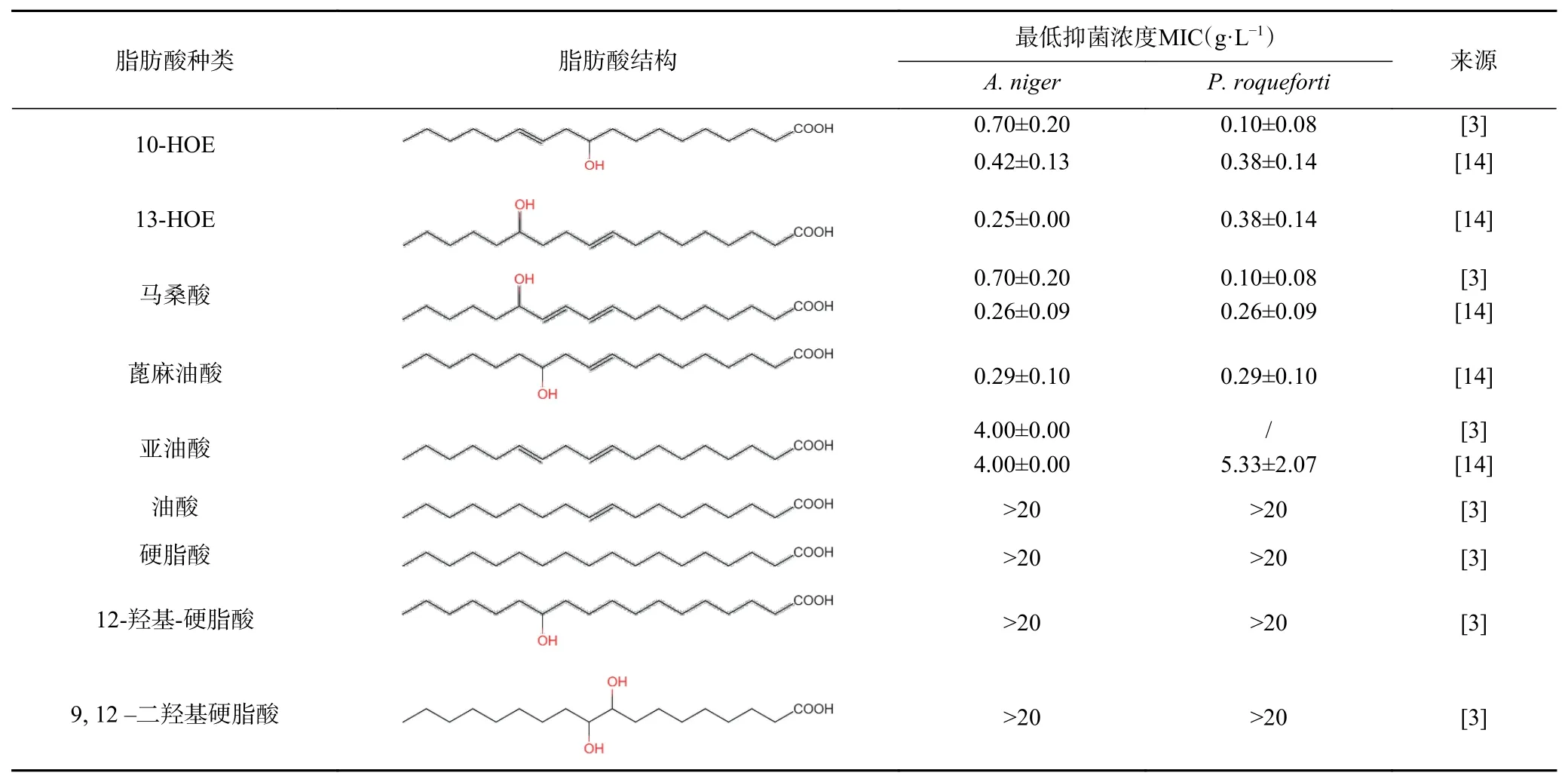
表2 典型脂肪酸的真菌抑制特性的比较Table 2 Comparison of fungal inhibition ability of typical fatty acids
大多数研究认为HUFA的抗真菌机制是由于其嵌入真菌细胞脂质双分子层,而破坏了真菌细胞膜功能[12,31,36]。Sjögren等[31]证明来源于L. plantarumMiLAB 14的四种3-羟基脂肪酸(3-羟基-5-十二碳烯酸、3-羟基十二烷酸、3-羟基四癸酸、3-羟基癸酸)可通过影响真菌的细胞膜结构,增加了膜的通透性,使细胞内电解质和蛋白质释放,最终导致真菌细胞的解体。Gänzle团队[12]则认为HUFA可能针对真菌细胞膜的特定区域或脂筏进行作用,而不改变整个膜的流动性;真菌对HUFA的敏感性可能与甾醇含量有关,耐HUFA的酵母(其MIC一般大于等于1 g/L)相对于HUFA敏感的霉菌(其MIC一般小于1 g/L)拥有更高的甾醇含量[10,12]。晏石娟等[37]研究了马桑酸等脂氧素的抑制真菌机制,认为脂氧素通过调控真菌的G蛋白偶联受体(GPCRs)活性而抑制曲霉属真菌生长繁殖。10-HOE及13-HOE的真菌抑制机理目前仍处于探索阶段,需要进一步研究其具体抑菌过程。
1.2.2 抗炎性 在肠道性炎症中,肿瘤坏死因子是发病的关键促炎细胞因子,肿瘤坏死因子受体的阻断已被证明能有效抑制小鼠结肠炎中的炎症和细胞凋亡[38],因此,肿瘤坏死因子受体的阻断成为一个抑制肠道炎症的有利手段。10-HOE是亚油酸的肠道微生物代谢物,Miyamoto等[23]发现G蛋白偶联受体40在肠道屏障中起关键作用,而肠道微生物代谢产物10-HOE可作为一种新型内源性G蛋白偶联受体40激动剂,通过不饱和双键与受体结合,下调肿瘤坏死因子受体2的表达,改善了肠道屏障的损伤,从而达到一定的抗炎作用。Bergamo等[22]通过研究10-HOE对脂肪酸代谢物在抗原呈递细胞成熟及促炎因子释放过程的影响,证实了肠道源L. plantarumAKU 1009a在合成共轭亚油酸过程中产生的10-HOE与食品、药品中的功能成分顺9,反11-共轭亚油酸类似,可通过增强抗氧化和解毒防御的能力对免疫细胞进行调节,这可能是由于10-HOE降低了促炎因子的释放而对肠道炎症起到一定的抑制作用。
除了可抑制肠道炎症,10-HOE对大脑炎症有潜在的调节和控制作用。阿尔茨海默症、帕金森综合征、多发性硬化症等神经退行性疾病的病理发生与大脑炎症密切相关[39]。Ikeguchi等[40]认为抑制小胶质细胞(中枢神经系统的一种免疫细胞)的活性对神经退行性疾病可能是一个有利的治疗方法,其研究发现酮醇和10-HOE可通过抑制胞外信号调节激酶磷酸化,从而抑制小胶质细胞一氧化氮合酶的表达及一氧化氮的产生,对大脑炎症有望达到抑制及治疗的作用。
另外,马桑酸(13-hydroxyoctadecadienoic acid,或称13-HODE和13-OH C18:2)及其异构体9-羟基十八碳二烯酸(9-HODE或称9-OH C18:2)是一种与10-HOE及13-HOE结构类似的HUFA,其含量变化与很多炎症都有较强相关性。有研究表明,这些HUFA在一定程度上参与了炎症过程的调控[4,5,41]。与马桑酸和9-羟基十八碳二烯酸结构类似,10-HOE和13-HOE有可能具有相应的调控作用,但该方面的研究仍有较多空白有待补充。
1.2.3 抗过敏性 Kaikiri等[42]通过对特异性皮炎模型鼠NC/Nga小鼠喂食含0.01%(W/W)10-HOE的AIN-93G饲料,测试其静脉血样中总IgE(免疫球蛋白E)水平、粪便中的IgA(免疫球蛋白A)和肠道菌群,分析小肠黏膜的皮肤淋巴细胞、皮肤切片组织,研究10-HOE对NC/Nga小鼠的抗过敏作用。结果显示10-HOE可通过降低血清IgE、调节Th1/Th2平衡相关的细胞因子,诱导IgA的产生,而IgA可以抑制肠道抗原的免疫激活,从而改善了NC/Nga小鼠的过敏性皮炎的症状,同时还抑制了皮肤背部的肥大细胞浸润(肥大细胞浸润是过敏性炎症的主要表现)。该研究表明,10-HOE有望作为一种新型功能性成分,具有预防过敏性皮炎等过敏性疾病的潜力。
2 亚油酸水合酶的研究进展
2.1 亚油酸水合酶概述
水合酶(EC 4.2.1.x)指催化双键可逆水化反应的一类酶,常见的水合酶主要有乙炔水合酶(EC 4.2.1.112)、基辅酮水合酶(EC 4.2.1.95)、延胡索酸水合酶(EC 4.2.1.2)[43]等。水合酶在常用重组宿主中表达良好,通常对底物具有良好的活性,但目前大多水合酶具有辅酶因子依赖性[43]。
亚油酸水合酶(linoleate hydratase, LHT)最初称为肌球蛋白交叉反应抗原(myosin-cross-reactive antigens,MCRA),是对亚油酸双键位置具有特异性且不会发生反异构化反应的特异性水合酶,分子量约为67 kDa[44],其特征在于它们可将脂肪酸双键羟基化,其中氧原子来自水而不是分子氧[45]。亚油酸水合酶广泛存在于革兰氏阳性和阴性细菌中,1994年Kil等[21]首次在Streptococcus pyogenes中发现MCRA由一类广泛存在于细菌中的蛋白质组成。研究证实MCRA具有脂肪酸水合酶的活性,并与Limosilactobacillus reuteriPYR8中的亚油酸异构酶具有高度的同源性[46]。亚油酸水合酶可归类为依赖黄素腺嘌呤二核苷酸(FAD)的双键水合酶,属于碳氧裂解酶,其中FAD不参与催化反应,但对蛋白质稳定性起作用[45]。
根据羟基位置的不同,亚油酸水合酶主要分为10-亚油酸水合酶(10-LHT)和13-亚油酸水合酶(13-LHT),其中10-LHT除对亚油酸具备活性外,也有催化油酸生成10-羟基硬脂酸的能力,也可称为油酸水合酶(EC 4.2.1.53)[47]。2011年Kishino等[48]发现L.plantarumAKU 1009a含有10-LHT,且主要存在于细胞膜上。2013年Yang等[49]探索了四种分别来自Lacticaseibacillus rhamnosus、L. plantarum、L.acidophilus和B. animalissubsp.lactis的MCRA,发现它们均具备10-LHT的活性。2015年,Kim等[15]首次深入研究了10-LHT及13-LHT,结果显示10-LHT对顺-9双键表现出较好的区域选择性,对亚油酸及油酸都具有活性,可合成10-HOE和10-羟基硬脂酸;13-LHT则具有顺-12双键的特异性,可经过酶转化合成13-HOE,且13-LHT蛋白是亚油酸特异性水合酶,不会发生反异构化反应。
2.2 亚油酸水合酶的底物特性和结构特性
亚油酸水合酶对不同的底物显示不同的活性,均可特异性转化为不同的羟基脂肪酸,但对亚油酸的活性最强。Kim等[15]研究了重组10-LHT和13-LHT酶促动力学,比较它们对不同底物的活性,通过动力学参数表明10-LHT对亚油酸及油酸均有一定的活性,10-LHT对亚油酸的催化效率(kcat/km)为5(1/mmol/L/min),高于对油酸的催化效率3.2(1/mmol/L/min);13-LHT则对亚油酸表现出更高的催化效率,约为82(1/mmol/L/min),同时13-LHT对α-亚麻酸的及γ-亚麻酸的催化效率仅分别为9和13(1/mmol/L/min),由于对其他底物的活性低,其余动力学参数未被确定。
通过克隆表达来源于L. acidophilusNCFM的亚油酸水合酶,Volkov等[50]研究证明亚油酸水合酶是由591个残基组成的蛋白质,晶体结构如图4所示。亚油酸水合酶是同型二聚体,每个单体含4个结构域;白色通道和黄色通道分别是底物和FAD结合通道;与其它FAD依赖性酶相比,多了第4个黄色结构域;亚油酸水合酶的第4个域位于C端,由三个螺旋组成,它覆盖从蛋白质表面通向活性位点的疏水底物通道的入口。在亚油酸存在的情况下,一个原基的第四个域发生构象变化,打开了同型二聚体的另一个原基的底物结合通道的入口。亚油酸分子结合在底物通道的入口,表明底物识别触发了盖子域的运动。亚油酸水合酶合成10-HOE及13-HOE原理如图5所示,通过亚油酸水合酶,可将亚油酸特异性转化为10-HOE和13-HOE,其中羟基来自于一个水分子[44]。亚油酸水合酶具有底物专一性,且因其种类不同对亚油酸不饱和键区域选择性不同,其晶体结构决定了该水合酶的FAD依赖性。据现有关于亚油酸水合酶动力学研究表明,野生菌中获得的13-LHT的活性均普遍高于10-LHT,高效10-LHT的筛选仍有较大的空白,有待继续探索。
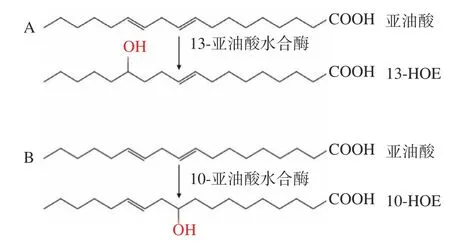
图5 亚油酸水合酶催化合成10-HOE(A)和13-HOE(B)的反应式Fig.5 Synthesis of 10-HOE (A) and 13-HOE (B)by linoleic acid hydratase
2.3 亚油酸水合酶合成HUFA
10-HOE及13-HOE主要通过含有亚油酸水合酶的野生菌转化亚油酸获得,但野生菌筛选过程繁琐,产物复杂,直接使用亚油酸水合酶可高效专一地合成10-HOE及13-HOE,酶法是合成10-HOE及13-HOE的常用方法之一。Oh等[51]克隆了L. acidophilusNBRC 13951中的双键水合酶,这些酶对亚油酸的C-9或C-12双键的水合作用非常专一,因此可以选择性地从亚油酸中生成10-HOE或13-HOE。Chen等[13]研究L. plantarum、L. reuteri、L. hammesii和L. spicheri中亚油酸水合酶的特性,在Escherichia coli中克隆、表达和纯化了10-LHT,建立了10-LHT的酶活测定方法:4.5 mg亚油酸,25 μg纯化的10-LHT,在1 mL含50 mmol/L NaCl、2%乙醇和10%甘油的50 mmol/L MES缓冲液(pH=6.1)中,25 ℃转化3 h。Kim等[15]在E. coli中克隆、表达和纯化了10-LHT和13-LHT,研究了两种酶的底物特异性和反应动力学,系统测定了酶转化过程中底物和产物浓度的变化,在10-LHT的酶底比是13-LHT的酶底比6倍的条件下,10-HOE、13-HOE的最终摩尔转化率分别是40%、81%。故目前看来13-LHT的酶转化效率要高于10-LHT,但酶转化相关研究报道较少,需要进行更多酶学特性研究和产物合成研究。
2.4 细胞转化合成
细胞转化主要是通过含有LHT的野生菌或基因工程菌进行转化合成。与酶法合成相比,细胞转化法简化了酶的提取纯化步骤,合成过程较简便。目前,多组研究发现L. plantarum[13]、L. acidophilus[14]、Nocardia cholesterolicum[52]等野生菌细胞具备合成HUFA的能力。其中以2 g/L亚油酸为底物,pH为6.5,在30 ℃转化7 d,L. acidophilus13951可合成65%的13-HOE,而Lacticaseibacillus paracaseisubsp.paracaseiJCM 1111对10-HOE的合成转化率达到91%,是目前野生菌合成10-HOE及13-HOE产量最高的报道[27]。
与野生菌相比,基因工程菌可专一性大量表达目标酶,细胞转化效率高、产物杂质少,因而基因工程菌细胞转化是产业化生产10-HOE和13-HOE的有效途径[13-14]。杨波[53]通过基因工程将L. plantarumZS2058中的10-LHT表达至大肠杆菌中,0.5 mg/mL湿菌体重悬于KPB缓冲液(pH6.0),37 ℃、200 r/min下进行简单的细胞转化6 h,重组大肠杆菌在辅酶因子FAD及NADH的催化下反应累积得到产物10-HOE。2015年Park等[14]在大肠杆菌中表达了L. acidophilus中的13-LHT,优化的表达条件为:50 mmol/L柠檬酸/磷酸盐缓冲液(pH6.0)中,加入0.25%(v/v)Tween 40、25 g/L菌泥和100 g/L亚油酸,40 ℃反应3 h,最终获得79%的13-HOE合成产率。与13-HOE相比,还未有文献报道工程菌在高底物浓度条件下高效率合成10-HOE。
3 展望
HUFA具有多种功能特性,特别是10-HOE和13-HOE可作为一类新型天然抗真菌防腐剂应用于食品防腐[30,54-55]。目前关于10-HOE及13-HOE的性质及应用研究刚起步,亚油酸水合酶的底物特性研究不完整,尤其关于10-LHT的高效转化未有具体报道,HUFA的抗真菌机制尚未深入解释,10-HOE及13-HOE更多的食用药用价值有待挖掘。此外,HUFA的酶法合成及细胞转化合成仅局限于酶学特性研究或实验室转化条件优化,转化效率较低,无法应用于工业生产,后续研究可通过酶和细胞的有效荷载、纳米乳液、皮克林乳液等胶体界面化学理论,来定向提高HUFA生物合成体系的转化效率。

