微胶囊化生姜、枸杞、栀子提取物的ACE抑制率、苦味及稳定性研究
朱启鹏,李晓东,刘 璐,陆欣宇,周星宇,唐雅倩,高铜韩
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
近年来,药食同源材料因其具有安全性高、效果好的特点日益受到食品研究者的重视。其中生姜、枸杞、栀子作为常见的药食同源材料,具有抗氧化、降血压等多种生物活性,在功能性食品方面有很大的应用潜力。生姜中含有多种酚类、黄酮类功能性成分。姜黄素是从生姜中提取出的一种植物多酚,具有抗氧化、降血压的活性[1-2]。研究发现姜黄素可以降低血浆及肾组织ET-1的含量[3],证明其作为多酚化合物具有类似ACE抑制肽的降血压作用。枸杞中含有20余种氨基酸,其醇提物具有很强的降血压作用,且剂量效应关系显著[4]。栀子中分离和鉴定出的活性化合物有40多种,包括环烯醚萜类、黄酮类、有机酸酯类、甾醇类及色素等,通过改善内皮功能调节血压[5-7]。同时研究表明,姜和栀子混合后与单一栀子相比较,其中栀子苷、芦丁等成分含量显著上升[8]。但由于它们所含的活性成分稳定性差,容易受环境的影响,其降血压活性会遭受破坏[9],同时苦味等问题也严重影响其在食品加工中的应用。目前提高稳定性的方法主要是使用微胶囊技术进行包埋。微胶囊可以保护活性物质,使其不被外界环境影响,从而提高了产品稳定性。
在微胶囊制备的过程中,包埋壁材的选择对最终产品的应用最为重要。常用的壁材有糖类、糊精类、纤维素类、蛋白类等[10-11],在实际应用中,为了达到更好的效果,有时候选用两种以上的材料复合进行包埋[12]。庄建鹏等[13]利用乳清浓缩蛋白和麦芽糊精为壁材,对乳清蛋白水解物进行包埋,得到了降胆固醇活性良好的产品。陈程莉[14]将改性淀粉复合阿拉伯树胶制备出黑枸杞花青素的微胶囊,提高了花青素的抗氧化能力。李秀等[15]以β-环糊精为壁材包埋枸杞叶黄酮提取物,改善了其溶解性和稳定性。Jla等[16]以阿拉伯树胶、海藻酸钠和壳聚糖为复合壁材,对姜黄素进行包埋,克服了其在存储加工过程中的降解问题。李雨田等[17]发现栀子与姜复合后的环烯醚萜苷类成分成分含量有所升高,抗氧化能力提升。目前,研究主要集中在对单一生姜、枸杞、栀子提取物的微胶囊化,但三种药材复合后的成分更加复杂,对于包埋壁材的要求更高,对生姜、枸杞、栀子混合提取物的微胶囊化研究仍然较少,如何能最大程度的保护好其降血压活性成分是一个挑战。
本文将生姜、枸杞、栀子进行浓缩提取,制备混合提取液后,以麦芽糊精、变性淀粉以及两者质量比1:1混合分别与明胶作为复合包埋材料,对三种药食同源提取物进行包埋,经喷雾干燥后制成微胶囊,对微胶囊的理化性质、形态结构以及稳定性进行研究分析,比较筛选出最佳包埋壁材,为生姜、枸杞、栀子提取物在食品工业中的应用提供理论参考。
1 材料与方法
1.1 材料与仪器
生姜、枸杞、栀子 西安国豪生物有限公司;明胶、变性淀粉、麦芽糊精 广州成硕生化试剂有限公司;4-羟乙基哌嗪乙磺酸(HEPES)、没食子酸标准品西格玛奥德里奇(上海)贸易有限公司;胰蛋白酶(3000 U/mg) 北京索莱宝科技有限公司;胃蛋白酶(3000 U/mg) 西安康诺化工有限公司;HCl、NaCl、Na2CO3、无水乙醇、磷酸、磷酸二氢钾、钨酸钠、碳酸钠、钼酸钠、溴化钾等 均为分析级,上海国药集团化学试剂有限公司。
XZ-10 DTD超声波清洗机 新芝生物科技有限公司;BL-6000Y喷雾干燥机 上海比朗仪器制造有限公司;S3400-N扫描电子显微镜 日本日立公司;VERTX 70型傅立叶变换红外光谱仪 德国BRUKER公司;Pyris 1 TGA型热重分析仪 美国PERKINELMER公司;T6新世纪紫外分光光度计 北京普析通用仪器有限公司。
1.2 实验方法
1.2.1 生姜、枸杞、栀子浓缩提取液的制备 分别取生姜、枸杞、栀子原料粉碎后,过100目筛备用。采用超声波辅助浸提法,根据李小多等[18]的试验方法进行改进,以50%浓度乙醇为提取液进行浸提。将三种粉末分别与乙醇溶液混合均匀,震荡1 min后开始浸提。超声最佳条件确定为:料液比15:1(g/mL),超声温度50 ℃,超声时间1 h,超声功率100 W。超声完成后冷却至室温,在5000 r/min下离心10 min,取上清液。同时根据前期试验结果,生姜、枸杞、栀子提取液混合比确定为生姜:枸杞:栀子=1:2:1(v/v/v)。
1.2.2 微胶囊的制备 制备方法参考陈程莉[14]、黄晓梅等[19]的进行修改,称量20 mL配好的原料浓缩液,按照芯壁比1:5(w/w)进行包埋,溶于100 mL温水中,壁材分别为2%麦芽糊精、2%变性淀粉、1%麦芽糊精和1%变性淀粉混合,同时壁材均混合1%明胶,配成120 mL混合液,经高速离心机在10000 r/min条件下高速均质乳化10 min后,进行喷雾干燥生产。进风温度设置为180 ℃,出口温度设置为80 ℃,进料流速设置为10 mL/min。
取上步配好的原料浓缩液,不加任何壁材直接进行喷雾干燥生产得到的微胶囊作为空白样品。
1.2.3 包埋率的测定 包埋率的计算参考Khashayar等[20]和王晓阳[21]的方法,准确称取1 g微胶囊产品,加入10 ml蒸馏水,再加入100 mL无水乙醇,静置3 min。在20 ℃,5000 r/min下离心5 min,用0.45 μm滤膜过滤获得上清液。以没食子酸作为标准曲线,用Folin-Ciocalteu比色法测定滤液中多酚含量,即为总酚类含量。准确称取1 g微胶囊产品,加入100 mL无水乙醇,旋涡震荡10 s后静置,在20 ℃,5000 r/min下离心5 min,用0.45 μm滤膜过滤获得上清液,测定滤液中多酚含量即为表面酚类含量。计算方式如下:
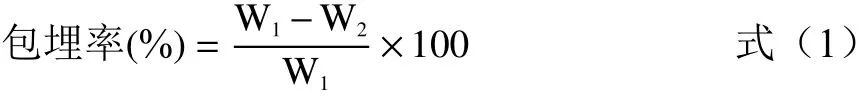
式中:W1:总酚类含量,mg;W2:表面酚类含量,mg。
1.2.4 苦味的评价 利用风味稀释分析法(TDA)对样品进行苦味评价。参考杨抒等[22]的方法,将各样品配成浓度为5%(w/w)的溶液,未包埋组为空白组,以原料浓缩液和各类壁材在相同配比和浓度下进行机械混合的溶液作为机械搅拌组,用去离子水对样品溶液进行1:1梯度稀释。稀释后的各样品溶液随机编号,由低浓度到高浓度依次给评价小组。共有20位感官评价员参与评分。感官评价进行三次平行实验。苦味越强,分值越高。风味稀释值(TD)为能够分辨出样品和空白组的苦味差异的最大稀释倍数。将样品分别按照2、4、8、16、32倍进行梯度稀释,以分辨出样品与空白组间明显苦味差异时的最大稀释倍数为TD值。TD值满分32,TD值越高,则说明样品苦味越重。
1.2.5 水分含量的测定 将精确称量的1 g粉末放入先前干燥并称重的培养皿中,然后放入烘箱中(在105±2 ℃下12 h),直至达到稳定的重量。根据干燥前后的重量损失计算水分含量。
1.2.6 吸湿性测定 产品的吸湿性是评价产品稳定性的重要指标。方法参考黄晓梅等[19],取1 g微胶囊粉末样品置于干燥器中,在25 ℃下,置于装有饱和NaCl溶液(75% RH)的气密塑料容器中。7 d后对样品称重,吸湿性计算公式如下:
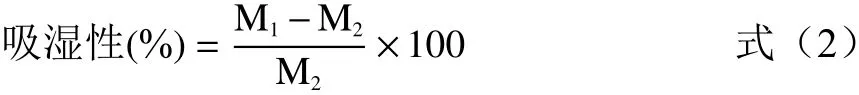
式中:M1:样品吸湿后质量,mg;M2:样品初始质量,mg。
1.2.7 微胶囊微观结构 微胶囊的微观结构通过扫描电子显微镜进行观察。将一层双面胶贴于扫描电镜样品台上,微胶囊粉末充分混合均匀后撒在双面胶上,稍加用力压实,喷洒一层薄金后用扫描电镜观察微胶囊的微观形貌。测量条件:电压设置为5 kV,放大倍数3000倍。
1.2.8 红外光谱分析 分别称取2 mg微胶囊粉末、变性淀粉、麦芽糊精、明胶以及未包埋的中药粉,加入100 mg溴化钾(105 ℃烘干),研磨均匀后压片,使用傅里叶红外光谱仪进行扫描并进行红外光谱分析。扫描范围4000~500 cm-1,光谱分辨率1 cm-1,扫描次数32次。
1.2.9 热稳定性测定 用热重分析仪分析麦芽糊精、变性淀粉以及混合壁材制备微胶囊粉末的热稳定性差异。称取各样品10 mg,测定条件:氮气流速率30 mL/min,测定范围30~500 ℃,升温速率10 ℃/min。
1.2.10 微胶囊体外释放试验
1.2.10.1 模拟胃液、肠液的配制 模拟胃液(SGF)和模拟肠液(SIF)的配制方法参考王静等[23]的方法。
模拟胃液:准确称取0.20 g NaCl溶于70 mL超纯水中,用1 mol/L HCl溶液调节溶液至pH为5.0,加水定容至100 mL,再加入0.45 g胃蛋白酶(比活力1:3000)和0.03 g脂肪酶(50 U/mg),在恒温37 ℃下以10 r/min磁力搅拌10 min,将溶液混匀。
模拟肠液:准确称取0.68 g K2HPO3溶于超纯水中,用1 mol/L HCl溶液调节溶液至pH为6.8,加水定容至100 mL,再加入0.12 g的胆盐和0.10 g胰酶,恒温37 ℃下以10 r/min磁力搅拌10 min,使溶液混匀。
1.2.10.2 释放度的测定 参考罗丽娟[24]的方法并完善操作如下。
取1.0 g各微胶囊粉末加入到500 mL 37 ℃的模拟胃液中混合均匀,每隔0.5 h取样1次,取样体积5 mL同时补加模拟胃液5 mL,测定其酚类含量。释放率计算公式如下:

式中:M3:模拟胃液中酚类的释放量,mg;M4:微胶囊中酚总量,mg。
将在上述模拟胃液中作用后的微胶囊粉末,在3000 r/min下离心5 min,水洗之后再次加入到500 mL 37 ℃的模拟肠液中混匀,每隔5 min取样1次,方法同上,测定其酚类含量。释放率计算公式(4)如下:
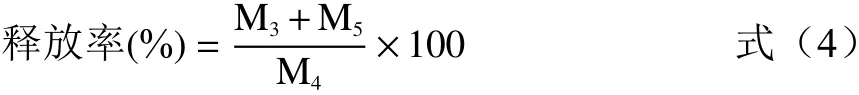
式中:M5:模拟肠液中酚类的释放量,mg。
1.2.10.3 ACE抑制率的测定 采用酶标仪法对ACE抑制率进行测定,根据陈琨[25]的方法进行改善,操作如下。
缓冲液的配制:称取HEPES 1.91 g和NaCl 1.75 g,加适量的蒸馏水,搅拌至将其完全溶解后,调节溶液pH至8.3,定容至100 mL,于4 ℃保存备用。
FAPGG的配制:称取19.97 mg FAPGG,加缓冲溶液溶解并定容至50 mL,于4 ℃避光保存备用。使用前37 ℃预热15 min。
样品的配制:喷雾干燥粉用缓冲液配成相应浓度。
ACE用去离子水配成0.1 U/mL。
ACE抑制率的测定:对照孔为20 μL ACE加40 μL HEPES缓冲液加50 μL FAPGG。样品孔为20 μL ACE加40 μL样品加50 μL FAPGG。在340 nm波长下,分别测定对照孔和样品孔的初始吸光度(a1和b1),酶标板于37 ℃条件下保温30 min后再测定其吸光度(a2和b2),每个样品测定3次重复。对照孔的吸光度减少值A=a1-a2,样品孔的吸光度减少值B=b1-b2。样品ACE抑制率的计算公式如下:

1.3 数据处理
采用Origin 9.0软件进行制图,采用软件SPSS 22.0对3次平行实验的数据进行显著性分析(P<0.05表示差异显著)和相关性分析。所有实验重复3次以上。
2 结果与分析
2.1 不同壁材的包埋效果
由表1可知,不同包埋壁材对活性成分保护是有影响的。其中混合壁材包埋率最高为75.24%,较单一麦芽糊精、变性淀粉分别显著高出3.56、6.17个百分点(P<0.05)。包埋率的顺序依次为:混合壁材>单一麦芽糊精>单一变性淀粉。同时总酚含量是评价中药材提取物降血压能力的指标之一[26],微胶囊化后包埋的酚类物质含量均在7.33~9.61 mg/g,与总酚类含量相比损失较小,证明包埋效果显著。因为在喷雾干燥时,颗粒周围会迅速形成薄膜,因此酚类大部分会保留在载体的结构中。这与Tolun等[27]的结论相似,其研究在不同芯壁比各类壁材对水果中酚类化合物生物活性包埋影响,发现以麦芽糊精和阿拉伯胶为混合壁材制备的微胶囊的包埋率最高,这是因为多酚类对理化因素非常敏感,需要多重保护。
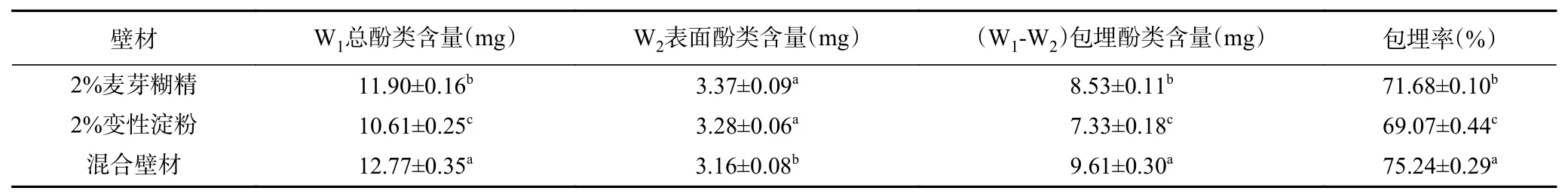
表1 不同壁材制备的微胶囊包埋效果Table 1 Embedding effect of microcapsule prepared from different wall materials
2.2 微胶囊的理化性质
壁材种类对微胶囊的苦味、水分含量、吸湿性的影响如图1所示。用风味稀释分析法(TD值)表征产品苦味的结果见图1A。未包埋的提取物苦味最强烈,TD值为32。三种壁材与提取物机械混合后溶液TD值均降为16。经过喷雾干燥微胶囊化处理后,单一麦芽糊精和变性淀粉包埋的提取物TD值降为8。而混合壁材制备的样品苦味下降最低,TD值为4。结果表明,喷雾干燥制备比机械混合更能降低其苦味(P<0.05)。这是因为微胶囊化后颗粒更均匀,更大程度的阻止了酚类中的黄酮类物质与味蕾的接触,有效地降低了中药材提取物的苦味[28]。
由图1B可知,在相同的喷雾干燥条件下,经过包埋的中药粉,其含水量都有所下降。其中麦芽糊精和混合壁材包埋后含水量下降最多,分别为2.88%、2.94%,较未包埋样品显著下降了0.75%、0.69%(P<0.05)。由于变性淀粉具有较高的持水力,所以麦芽糊精更能降低产品的含水量。而未包埋的中药粉,因为其中酚类是亲水性的,所以经过喷雾干燥后依然有较高的含水量[20]。
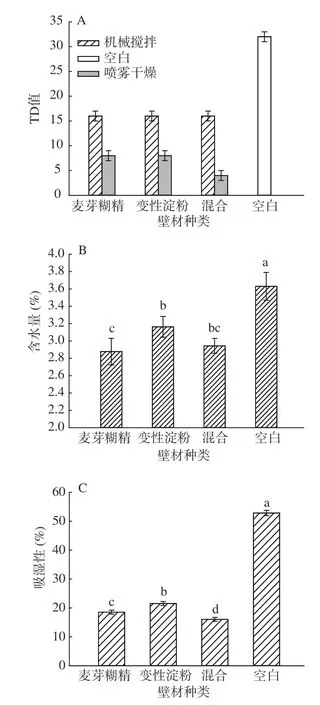
图1 壁材种类对微胶囊苦味(A)、水分含量(B)与吸湿性(C)的影响Fig.1 Effects of wall material types on microcapsule bitter taste(A), moisture content(B) and hygroscopicity(C)
吸湿性是指粉末从周围环境中吸收水分的能力,它影响喷雾干燥粉末的稳定性和保质期。从图1C中看出,7 d后,未包埋的样品吸湿性显著提高至52.83%(P<0.05)。而包埋过的样品吸湿性变化不大。推测这在一定程度上与包埋率有关,包埋率越高,吸湿性越低(P<0.05)。其中混合壁材的包埋率最高,所以吸湿性最低,为16.04%。Poonam等[29]的研究结果表明,微胶囊化可以阻止酚类等活性物质与空气中水分的直接接触,其中入口温度和壁材种类对含水量和吸湿性影响最大。
2.3 微胶囊形态的观察
由图2可知,在不同壁材的包埋下,微胶囊粉末展现出了不同的形态。在以单一麦芽糊精为壁材进行包埋时,其表面凹陷很多,这可能是喷雾干燥过程中,由于瞬间高温导致溶液液滴蒸发过快瞬间失水导致[30]。这是喷雾干燥制备微胶囊的特点。放大观察后能看到其呈不规则状且大小不一,可能是溶液从高压喷枪中射出时不稳定[20]。而以单一变性淀粉为壁材进行包埋时,其裂缝、孔洞较多且微胶囊较为分散。可能是变性淀粉遇水高温加热后形成了轻微糊状结构,不仅降低喷雾干燥效率,还产生了表面裂纹[27]。在混合壁材包埋下大部分粉末颗粒呈连续、球形结构。相较于单一壁材的微胶囊,其形状较为均匀完整,包埋效果明显。证明复合壁材比单一壁材具有更能保护酚类物质,提高微胶囊的稳定性。其中较大的圆球形颗粒可能是多个变性淀粉颗粒被明胶吸附,形成了更大的结构[31]。使用复合壁材制备的微胶囊样品,物理性质得到改善,内部成分均匀分布。根据Khashayar等[20]的研究可知,由于多糖与酚类直接的作用,抑制了分子间的聚集,为酚类提供了空间稳定性。所以,以混合壁材进行包埋是最有效的。

图2 不同壁材的中药提取物微胶囊粉末扫描电镜图Fig.2 Scanning electron microscopy(SEM) of microcapsules of Chinese herbal extracts from different wall materials
2.4 红外光谱分析
不同壁材包埋的提取物微胶囊粉末以及不同壁材的红外光谱如图3所示。在900~1700 cm-1区域内,主要是酚类有关的峰。在2800~3700 cm-1区域内,主要是羟基、羧酸有关的峰[32]。从图3A中看到,未包埋的粉末在1637 cm-1的峰对应着多酚结构中苯环的C=C的伸缩振动,这可能是花青素的骨架,在壁材包裹后偏移为1654 cm-1[33]。同时在1154和931 cm-1代表C-O、C-H的峰消失,表明微胶囊化过程中酚类提取物被壁材覆盖,且混合壁材包埋的效果更好。2928 cm-1处的峰为-CH2,可能是C-H拉伸振动引起,而1654 cm-1处的峰与C-C拉伸有关[34]。通过比较包埋前后的吸收峰特征差异,在混合壁材的红外光谱图中,酚类的各吸收峰强度减弱程度最大,证明其被包裹的效果最好,活性成分完全进入微胶囊的内腔[35]。
图3 B展示了不同壁材的红外光谱图,在纯麦芽糊精结构中,在1019 cm-1处的峰是=CH和=CH2键的角变形、846 cm-1的峰是-CH2和C-H的变形、760 cm-1处的峰是吡喃糖环的结构状态[14]。此外,麦芽糊精在1654 cm-1的峰主要与碳水化合物的-OH基团的氢键有关。变性淀粉在3416 cm-1处为-OH的吸收带,在2931 cm-1处的尖峰可能与C-H的拉伸有关。明胶在1663 cm-1处是酰胺I带,在1088 cm-1处是酰胺Ⅲ带[36]。同时对比图3A和图3B,在包埋后的样品中也能观察到壁材的所有峰,证明喷雾干燥的过程没有导致麦芽糊精、变性淀粉、明胶与中药提取物成分之间产生新的键。
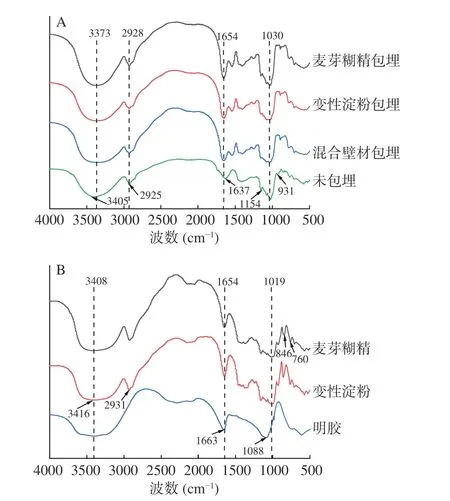
图3 不同粉末的红外光谱图Fig.3 Infrared spectra of different powders
2.5 热稳定性
通过热重分析可以比较出不同壁材微胶囊之间的热稳定性差异[37]。图4是三种壁材的热重曲线,可以看到微胶囊的分解过程大概是四个阶段。在30~100 ℃各微胶囊的质量损失率都在7%左右,主要是由自由水蒸发引起的;在100~180 ℃质量损失率下降减缓,均在12%左右,主要是结合水和挥发性物质的损失[38];在180~350 ℃失重加快,此时混合壁材保护效果显著优于其它,壁材和酚类都开始分解失重,导致大量中间产物产生,三种壁材损失率分别为在60%、58%、55%;在350 ℃以上,随着温度升高各物质完全氧化分解,损失率趋于稳定。在180 ℃以下时各壁材包埋的中药粉微胶囊质量损失均很少,证明其能满足正常食品的加工及储存条件。而混合壁材包埋的微胶囊在180 ℃以上时显著优于单一壁材的包埋。陈程莉[14]以单一变性淀粉作壁材包埋黑枸杞花青素,微胶囊在133.52 ℃处即受热分解。本研究中混合壁材制备的微胶囊受热分解约在180 ℃处,显著高于单一壁材。赵婕等[39]以阿拉伯胶和麦芽糊精为复合壁材包埋薏米糠油,结果也显示出混合壁材具有更好的热稳定性,略高于本研究中混合壁材微胶囊。这可能是混合壁材相对于界面可以形成弹性更高的膜,经过高温后水分蒸发、表面硬化,结构更致密,分解更难,所以拥有更好的热稳定性[38]。
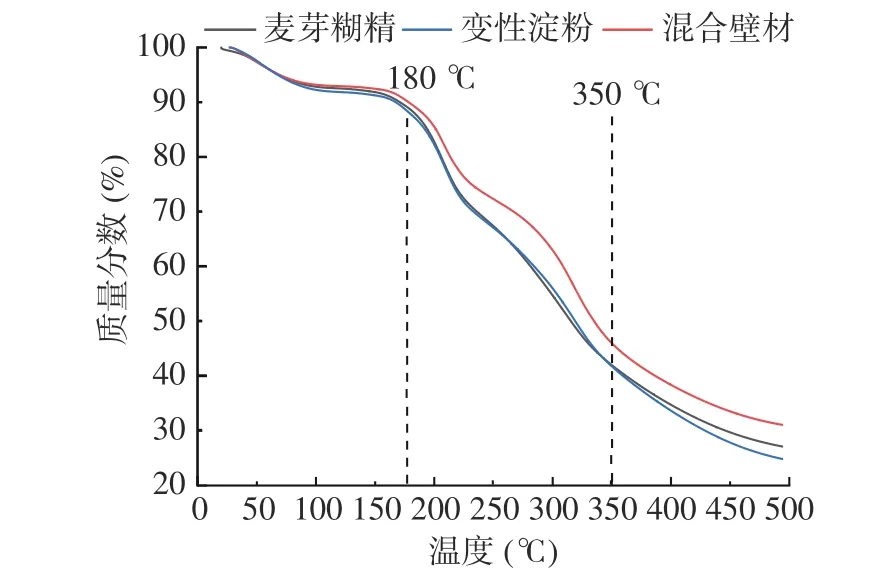
图4 不同壁材微胶囊的热重曲线Fig.4 Thermogravimetric curves of microcapsules with different wall materials
2.6 微胶囊的释放率及ACE抑制率
随着时间的延长,提取物中酚类的释放率从迅速增长逐渐趋于稳定。如图5所示,在模拟胃液中,到180 min时,最终释放率稳定在36.64%。释放率排序依次为:变性淀粉>麦芽糊精>混合(P<0.05),可能是偏酸性环境会使淀粉分子酸解而失去增稠和稳定能力,而混合壁材的保护效果更佳[40]。且停留时间越长,微胶囊的破坏情况越严重。在模拟肠液中,微胶囊进一步分解,至20 min时提取物释放率达69.64%,此时释放率排序依次为:麦芽糊精>混合>变性淀粉,证明糊精较淀粉更易在微碱性环境中分解。这与罗鹏等[41]的结果相似,其利用β环糊精制备的葵花籽ACE抑制肽微胶囊,经过200 min的胃肠道消化后释放率为74.2%。综上所述,通过包埋可以使中药提取物微胶囊在人体内达到缓释效果。由图5C可知储存时间对不同壁材微胶囊ACE抑制率的影响。未经包埋的提取物,其中的酚类活性受喷雾干燥的影响,在一开始就低至39.18%,而通过麦芽糊精、变性淀粉、混合壁材包埋的其一开始的ACE抑制率分别为45.56%、43.42%、49.64%(P<0.05),其中混合壁材包埋的微胶囊初始ACE抑制率最高。罗丽娟[24]以玉米淀粉、明胶为壁材,利用喷雾干燥对鲫鱼ACE抑制肽进行包埋,也得到了相同结论:包埋后的微胶囊ACE抑制率显著高于未包埋样品。证明包埋对酚类等活性物质的保护作用是明显的。随着在空气中暴露时间的延长,ACE抑制率均呈现出先快后慢的下降趋势,最后逐渐稳定。室温暴露7 d后,混合壁材包埋的ACE抑制率仍有22.36%,显著高于单一麦芽糊精和变性淀粉包埋(P<0.05),证明其对酚类活性的保护效果最为显著。这与罗鹏[41]的结论相似,其制备的葵花籽ACE抑制肽微胶囊室温储存8 d后抑制率仍可达到29.2%。
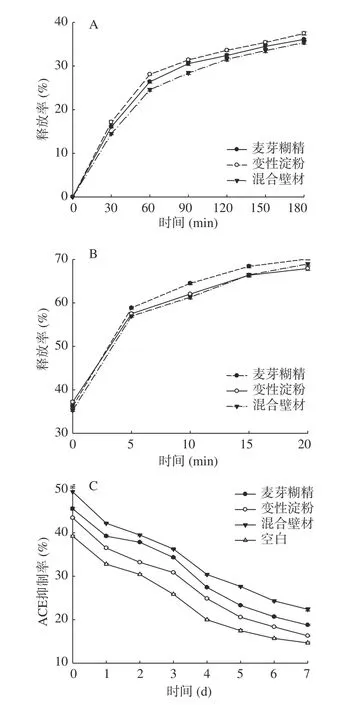
图5 微胶囊的释放率与ACE抑制率Fig.5 Release rate and ACE inhibition rate of microcapsules
3 结论
麦芽糊精和变性淀粉1:1(w/w)作为壁材对枸杞、生姜、栀子提取物包埋效果最佳,包埋率为75.24%(P<0.05)。其制备的微胶囊呈球型,表面最为连续完整,基本无孔洞或裂缝。红外图谱中酚类吸收峰强度减弱,证明提取物被包埋成功并形成了淀粉/糊精-酚类-明胶聚合体。通过混合壁材微胶囊化的枸杞、生姜、栀子提取物,苦味显著降低,吸湿性较未包埋的降低了36.79%。同时混合壁材制备的微胶囊热稳定性最高,该微胶囊经胃肠消化后释放率为69.64%,ACE抑制率为49.64%(P<0.05)与单一壁材包埋的微胶囊相比其消化释放率接近,但ACE抑制率降低程度最少,为药食同源提取物的微胶囊产品的应用提供一定理论基础。

