光诱导对人视网膜色素上皮细胞自噬和凋亡的影响
高园园 李娟 雒玉 李武军 俞洋
作者单位:1宁夏医科大学中医学院,银川 750004;2榆林市中医医院眼科,榆林 719000;3中国人民解放军联勤保障部队第941医院质量管理科,西宁 810000
光是哺乳动物视觉形成的必要条件,视网膜是含有最高内源性光敏剂的组织,可以被光激发,因此对光损伤高度敏感,过度的光照会对视网膜色素上皮层和感光细胞造成不同程度的损害[1],临床可表现为视力下降甚至致盲[2]。研究发现过强的光照或长时间的光照会加速光感受器变性,可直接损伤视网膜神经元,导致视网膜退行性疾病,如年龄相关性黄斑变性(AMD)、视网膜色素变性(Retinitis pigmentosa,RP)的发生、发展[3,4]。视网膜色素上皮(RPE)是神经视网膜和脉络膜之间含有黑色素的上皮细胞层,具有捕捉光信号并完成光电转换,合成生长因子和其他代谢物质,参与视色素再生,发挥血-视网膜屏障作用,维持光感受器的更新和吞噬作用的功能。有研究表明RPE细胞的蛋白稳态受到干扰,会导致AMD玻璃膜疣的集聚[5]。AMD是引起老年人失明的首要原因[6]。随着人口老龄化的日趋严重,AMD发病率也呈逐年上升趋势,预计到2040年,全球AMD的患病率将增到2.88亿人[7]。AMD对老年人及其家庭的身心都有重要影响,已成为一个重要的公共卫生问题。尽管AMD的发病率高,对视力影响严重,但治愈的患者却极其有限。近年来AMD已成为眼科学研究的热点。自噬起源于希腊语,意思是自己吃自己[8]。自噬在40年前首次在视网膜中进行描述[9],自噬对维持细胞内稳态及其重要,在一定条件的刺激下,在自噬溶酶体或自噬囊泡的作用下,自噬通过自噬溶酶体降解清除亚细胞碎片、受损细胞器来为细胞基本生存提供必要的物质[10,11]。但是,目前自噬与视网膜光损伤的关系未明确。有研究表明自噬可引发细胞凋亡并导致光感受器死亡[12];自噬功能障碍诱导RPE细胞凋亡[13]、视网膜色素变性[14],也有研究表明抑制自噬可保护光感受器免受光诱导的损伤[15]。为阐明光损伤中自噬与凋亡的关系,本研究采用自噬抑制剂——3甲基腺嘌呤(3 methyladenine,3MA)对ARPE-19细胞进行预处理,观察光照对ARPE-19细胞的影响,研究RPE细胞光损伤中自噬及其与凋亡之间的关系并探讨3MA对光诱导下RPE细胞自噬和凋亡的影响,以寻求治疗AMD的有效策略。
1 材料与方法
1.1 细胞株
ARPE-19 细胞购于中国北纳生物公司(编号:BNCC337713)。置于37 ℃、5%的CO2培养箱中培养,隔日换液1次,待细胞成长密度达到80%~90%时,消化细胞,进行1∶3传代,取对数生长期3~6代细胞用于实验。将细胞悬液,按1×104个/孔细胞接种于96孔培养板内,每孔100 μl,置37 ℃、5%CO2培养箱内培养12 h,待细胞贴壁后进行实验。
1.2 试剂和仪器
胎牛血清、DMEM/F12均购自以色列Bioind公司;AnnexinV-FITC细胞凋亡检测试剂盒购自上海贝博生物科技有限公司;BCA蛋白定量试剂盒、全蛋白提取试剂盒购自江苏凯基生物技术股份有限公司;3MA(A8353,美国APEXBIO公司)、LC3A-Specific Antibody、LC3B-Specific抗体、P62/SQSTM1抗体均购自中国武汉三鹰生物技术有限公司);Rabbit Anti-Beclin 1 抗体购自中国Proteintech公司。Multiskan酶标仪购自美国Thermo公司;FACSAriaⅡ型流式细胞检测仪购自美国BD公司;TES-1332A数位式照度计购自台北泰仕电子工业;透射电子显微镜(H7800)购自日本日立公司;无目镜倒置荧光显微镜细胞成像仪(Evos FL Auto2)购自美国Thermo公司;双光子激光共聚焦显微镜(FV1200MPE)购自日本OLYMPUS公司;凝胶成像分析仪(Gel Doc XR)购自美国BIORAD公司。
1.3 细胞分组
将体外培养人RPE细胞(ARPE-19)按随机数字表法分为12 h对照组、12 h模型组、12 h 3MA组;24 h对照组、24 h模型组、24 h 3MA组。对照组用锡纸包裹避光培养;模型组接受光照刺激,3MA组中加入3 mmol/ml 3MA后接受光照刺激,以自制三基色LED(发光二极管)冷光灯作为光源,在(16 500±500)lx光照强度下照射细胞12 h和24 h。
1.4 构建人RPE细胞光损伤模型
将3~6代对数生长期的人RPE细胞培养于6孔板,光照在培养箱内密闭进行,无自然光干扰。以自制三基色LED冷光灯作为光源,悬挂于培养箱内顶端,采取直落式照射,照度计监测光照强度,使被照细胞光照强度为(16 500±500)lx,分别照射细胞12 h和24 h。光照时,细胞平面的温度变化控制在36.5~37.5 ℃之间,排除温度升高引起细胞光热损伤的可能。
1.5 透射电子显微镜观察光照对细胞超微结构影响
取生长状态良好的ARPE-19细胞用于实验。光照结束后弃去原培养液,二甲坤酸钠缓冲液(0.1 mol/L)1.5 ml冲洗细胞,之后加入1 ml固定液后,转移至4 ℃冰箱静置20 min,收集细胞,置于1 000 rpm水平转子离心10 min。弃上清,加入2%戊二醛1 ml,混匀,4 ℃冰箱中静置固定30 min。离心,弃上清,加入2 ml缓冲液吹打混匀(重复3 次),4 ℃冰箱静置30 min。1%锇酸浸泡1 h,缓冲液冲洗2次,每次15 min。梯度乙醇脱水,环氧树脂逐级渗透,包埋后,超薄切片,醋酸双氧铀、柠檬酸铅染色后,采用透射电子显微镜(Transmission electron microscopy,TEM)观察细胞超微结构。
1.6 流式细胞仪测定细胞凋亡率
取生长状态良好,且处于对数生长期的人RPE细胞用于实验。光照处理结束后处理各组细胞,收集旧培养液,温PBS洗涤2~3 遍,用0.25%不含EDTA、不含酚红的胰酶消化细胞,将细胞吹打混匀,制成单细胞悬液,移入相应离心管中,1 200 rpm,离心5 min,弃上清;冷PBS 2 ml洗涤1次,轻轻混匀成单细胞悬液,1200 rpm,5 min离心后,弃上清,此步骤重复2次;将细胞悬浮于400 µl的Annexin-V结合液中,避光加入5 µl异硫氰酸荧光素(Fluorescein isothiocyanate,FITC),4 ℃放置15 min;上机前5 min避光加10 µl碘化丙啶(Propidium iodide,PI),在1 h内完成流式细胞仪检测。
1.7 观察自噬溶酶体形态并测定自噬溶酶体的生成水平
用D-Hanks梯度稀释LysoTracker Red原液,配置成2 μmol/ml的工作液;将生长状态良好的6孔板中的ARPE-19,去除完全培养基,预热的D-Hanks轻柔洗涤2~3 次,避光下每孔中加入配置好的预热的LysoTracker Red(2 μmol/ml)染色工作液1 ml,37 ℃黑暗条件下孵育2.5 h;去除LysoTracker Red染色工作液,预热的D-Hanks洗涤1~2次,避光加入预热的Hochest33258(5 μg/ml)染色工作液,孵育3~5 min,预热的D-Hanks洗涤1~2次,加入新鲜的细胞培养液;采用激光扫描共聚焦显微镜观察或倒置荧光显微镜观察拍片,Image J图像处理软件分析荧光强度。
1.8 Western Blot法检测Beclin1、LC3、P62、蛋白表达量
用蛋白裂解液提取各组细胞蛋白,利用BCA蛋白定量测定试剂盒对蛋白进行定量。通过计算机调整后变性,50 μg上样,经SDS-PAGE电泳后,用PVDF转膜,加入一抗,5%脱脂奶粉封闭2 h,4 ℃封闭过夜,TBST洗涤10 min,洗3次,加入二抗,37 ℃摇床孵育2 h。暗室中加发光液并进行曝光。X光片显影和定影后采用Image J软件分析蛋白条带的灰度值。
1.9 统计学方法
实验研究。采用SPSS 21.0或Graphpad Prism 6.0软件进行数据分析。对数据进行正态分布检验,符合正态分布者数据以均数±标准差表示。数据符合正态分布且方差齐的资料比较采用单因素方差分析,不符合正态分布或方差不齐的数据进行秩转换的非参数检验,多个样本间的多重比较采用SNK-q法检验。以P<0.05为差异有统计学意义。
2 结果
2.1 光照诱导ARPE-19细胞自噬形态观察
透射电子显微镜对ARPE-19 细胞进行形态观察,如图1所示,模型组中可见双膜状的典型自噬小体、自噬溶酶体及内质网、高尔基体的扩张等其他自噬特征。典型自噬小体可以将包括细胞器在内的胞液物质隔离在双膜结合的小泡中,然后将其作为降解的目标(白色箭头所示),自噬溶酶体由单层膜包绕,其内含有细胞器,大小不一(黑色箭头所示)。而对照组中少见细胞自噬小体及自噬溶酶体,少见内质网、高尔基体的扩张。这表明可见光照射可以诱导ARPE-19细胞的自噬。

图1.透射电子显微镜观察光照前后细胞超微结构变化(×5 000)A:对照组;B:模型组。白色箭头所示为典型自噬小体,黑色箭头所示为自噬溶酶体Figure 1.Observation of cell ultrastructural effects using transmission electron microscopy (×5 000).A:Control group.B:Model group.The white arrow indicates a typical autophagosome,the black arrow indicates autophagy-lysosome.
2.2 光照诱导ARPE-19细胞自噬溶酶体形态观察
LysoTracker Red为溶酶体荧光探针,呈红色荧光,溶酶体以红色颗粒状分布在RPE细胞中,对照组细胞呈梭形或长梭形;3MA组中部分细胞变为椭圆形且细胞间隙变宽;模型组自噬溶酶体荧光亮度增加,细胞形态变为圆形或椭圆形,且24 h的红色颗粒多于12 h自噬溶酶体荧光染色。见图2。这表明(16 500±500)lx光照强度可诱导ARPE-19细胞的自噬,随着光照时间的延长自噬增强。
2.3 自噬溶酶体荧光强度分析
使用Hochest33258(5 μg/ml)染色工作液对活的ARPE-19 细胞核进行染色,LysoTracker Red(2 μmol/ml)的工作液对自噬溶酶体进行染色,Image J对各组细胞荧光强度进行分析,自噬溶酶体的增多反映ARPE-19 细胞的自噬增强。如图3 所示,光诱导12 h后,对照组平均荧光强度为10.78±2.32,模型组平均荧光强度为63.81±0.13,3MA组平均荧光强度为24.63±1.63;光诱导24 h后,对照组平均荧光强度为11.34±1.31,模型组平均荧光强度为71.14±1.32,3MA组平均荧光强度为31.33±1.93。光照12 h和24 h后,3组间差异均有统计学意义(F=931.53,P<0.001;F=1156.67,P<0.001)。24 h模型组荧光强度高于12 h模型组的荧光强度,表明随着光照时间延长,ARPE-19细胞自噬增强。光照12、24 h后,3MA组的荧光强度介于同一时相内对照组、模型组的荧光强度之间,这表明3MA可能抑制光诱导的ARPE-19细胞自噬溶酶体的生成。
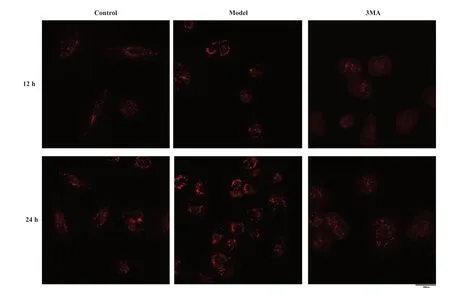
图2.光照诱导ARPE-19细胞自噬溶酶体的形态学变化(×200)Figure 2.The morphological changes in autophagy-lysosome in ARPE-19 cells induced by light (×200).
2.4 3MA干预对光诱导ARPE-19细胞凋亡率的影响
光诱导ARPE-19细胞12 h,3MA组细胞凋亡率明显高于模型组和对照组。光诱导ARPE-19 细胞24 h,3MA组细胞凋亡率高于对照组且低于模型组。光诱导12 h和24 h后,3组间差异均有统计学意义(F=294.51,P<0.001;F=102.17,P<0.001)。这表明,光照12 h,3MA可能促进光诱导的ARPE-19细胞的凋亡,光诱导ARPE-19细胞24 h,3MA可能抑制细胞的凋亡。见图4。

图3.自噬溶酶体荧光强度分析(×20)A:自噬溶酶体荧光强度分析;B:自噬溶酶体荧光强度比较。a,与光照12 h对照组相比,P<0.05;b,与光照12 h模型组相比,P<0.05;c,与光照24 h对照组相比,P<0.05;d,与光照24 h模型组相比,P<0.05。3MA,3甲基腺嘌呤Figure 3.Fluorescence intensity analysis of autophagy-lysosome (×20).A:Fluorescence intensity analysis of autophagolysosome.B:Comparison of fluorescence intensity of autophagic lysosomes.a,compared to the control group after 12 h of illumination,P<0.05;b,compared to the model group after 12 h of illumination,P<0.05;c,compared to the control group under 24 h of illumination,P<0.05;d,compared to the model group with 24 h of illumination,P<0.05.3MA,3-methyladenine.
2.5 3MA对光诱导ARPE-19 细胞Beclin1、LC3、P62蛋白表达的影响
在光照12、24 h的组内比较中,与对照组相比,模型组Beclin1 蛋白表达增高(均P<0.001)、LC3Ⅱ/LC3Ⅰ比值增高(均P<0.001),P62蛋白呈低表达(均P<0.001)。这表明,与对照组相比,模型组自噬明显被激活即光照诱导自噬并增加自噬通量。而光诱导12 h及24 h采用3MA干预后,与模型组相比,3MA 组P62 蛋白表达量明显升高(均P<0.001),3MA组Beclin 1 的表达量下降(均P<0.001)及LC3Ⅱ/LC3Ⅰ的比值降低(均P<0.001)。这表明3MA干预可降低光诱导的ARPE-19细胞自噬通量。见图5。
3 讨论
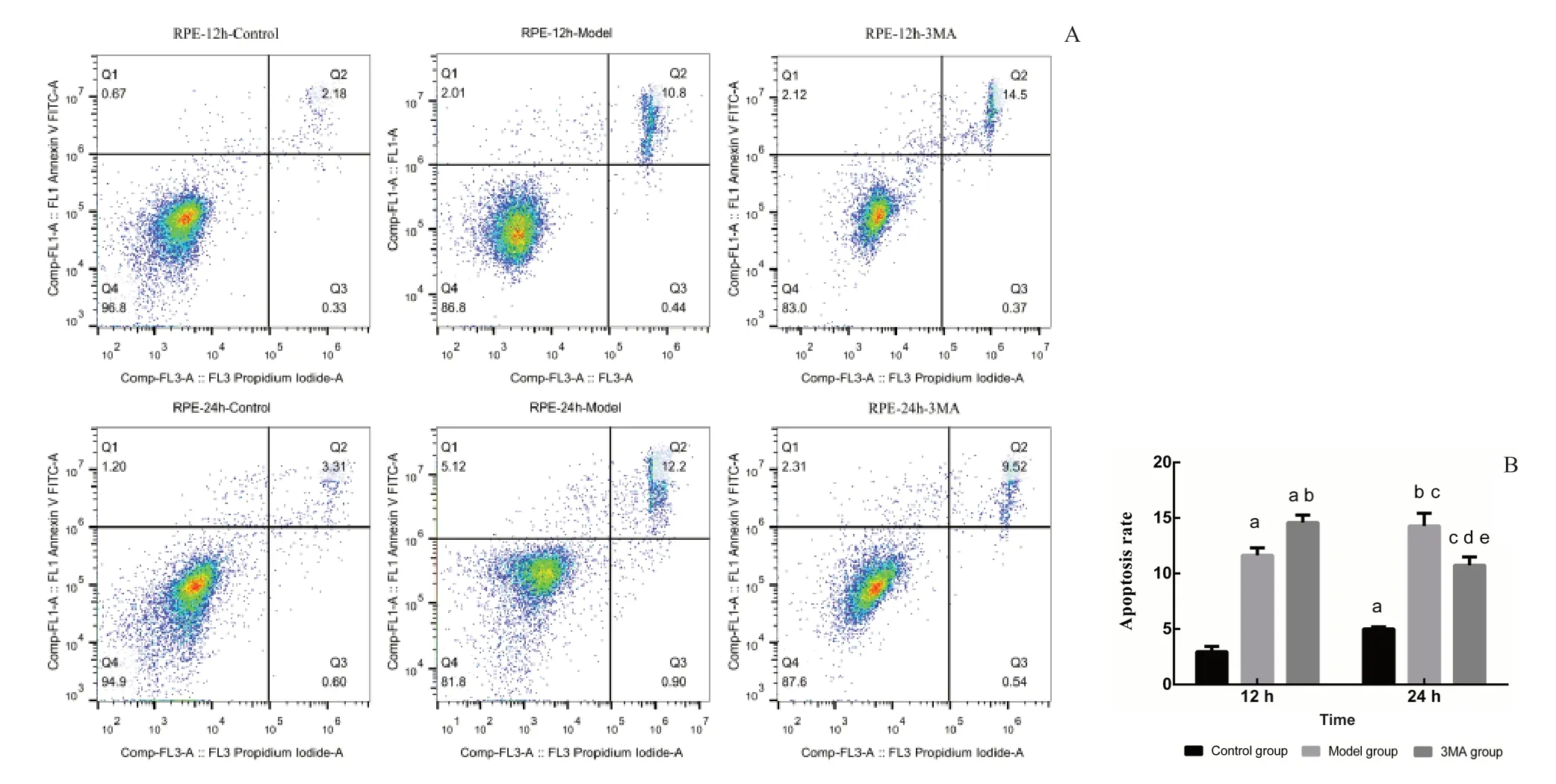
图4.3MA干预对光诱导ARPE-19细胞凋亡率的影响A:ARPE-19细胞凋亡率;B:ARPE-19细胞凋亡率比较。a,与光照12 h对照组相比,P<0.05;b,与光照12 h模型组相比,P<0.05;c,与光照24 h对照组相比,P<0.05;d,与光照24 h模型组相比,P<0.05;e,与光照12 h 3MA组相比,P<0.05。3MA,3甲基腺嘌呤Figure 4.Effect of 3MA intervention on light-induced apoptosis rate of ARPE-19 cells.A:The apoptosis rate of ARPE-19 cells.B:Comparison of apoptosis rate of ARPE-19 cells.a,compared to the control group after 12 h of illumination,P<0.05;b,compared to the model group under 12 h of illumination,P<0.05;c,compared to the control group under 24 h of illumination,P<0.05;d,compared to the model group with 24 h of illumination,P<0.05;e,compared to the 3MA group with 12 h,P<0.05.3MA,3-methyladenine.

图5.3MA对光诱导ARPE-19细胞自噬相关蛋白表达的影响A:Western blot条带;B:P62蛋白表达量;C:LC3Ⅱ/LC3Ⅰ相对蛋白表达量;D:Beclin1蛋白表达量。1:12 h对照组;2:24 h对照组;3:12 h 3MA组;4:24 h 3MA组;5:12 h模型组;6:24 h模型组。a,与光照12 h对照组相比,P<0.05;b,与光照12 h模型组相比,P<0.05;c,与光照24 h对照组相比,P<0.05;d,与光照24 h模型组相比,P<0.05;e,与光照12 h 3MA组相比,P<0.05。3MA,3甲基腺嘌呤。n=3Figure 5.Effect of 3MA on the expression of autophagy-related proteins in photo-induced ARPE-19 cells.A:Western blot strip.B:P62 protein expression.C:LC3Ⅱ/LC3Ⅰ relative protein expression.D:Beclin1 protein expression.1:12 h control group;2:24 h control group;3:12 h 3MA group;4:24 h 3MA group;5:12 h model group;6:24 h model group.a,compared to the control group after 12 h of illumination,P<0.05;b,compared to the model group under 12 h of illumination,P<0.05;c,compared to the control group under 24 h of illumination,P<0.05;d,compared to the model group with 24 h of illumination,P<0.05;e,compared to the 3MA group with 12 h,P<0.05.3MA,3-methyladenine.n=3.
AMD是一种年龄相关性疾病,通常可引起视网膜黄斑区光感受器、RPE细胞退行性改变和新生血管生成。黄斑富含视锥细胞,主要负责视觉的高分辨率及色觉辨别。随着疾病的进展,RPE细胞发生变性,继而导致感光器的功能障碍和AMD相关的视力障碍[16],因此 AMD可以引起严重的视觉障碍甚至永久失明[17]。
自噬的特征是将部分细胞质隔离在称为自噬小体的双膜囊泡中,随后与溶酶体融合,形成自噬溶酶体[18]。自噬有助于维持正常组织稳态平衡和代谢适应性,是不可或缺的生物学过程,但是超过一定的能力也会带来严重的后果[19]。自噬有助于清除RPE细胞中的脂质过氧化物[20]。
视网膜RPE细胞及光感受器细胞中,自噬极其活跃,自噬功能的损害可导致RPE细胞早期退化变性[21]。RPE的生理功能将自噬与视网膜衰老性疾病及光损伤导致的视网膜退行性疾病如AMD紧密关联。RPE细胞的退行性改变是AMD发病的主要特点[22],过度的光照会加速RPE细胞死亡,加剧AMD的进程。本研究结果表明,光照12 h的ARPE-19细胞自噬水平可以抵抗光损伤,而光照24 h后,自噬会在光诱导下损伤RPE细胞,抑制自噬对光损伤的RPE细胞具有保护作用,这与其他研究结果[15,23]一致。这可能是早期AMD的潜在治疗策略。
Beclin 1 是自噬小体形成过程中的重要因素,形成复合体正向调控自噬[24]。LC3是最经典的自噬分子标记物[25],能靶向定位于自噬体膜,当自噬被激活时,胞浆内的LC3-Ⅰ被转化为膜结合形式的LC3-Ⅱ,通常认为LC3-Ⅱ的增加或LC3Ⅱ/Ⅰ增高标志着自噬体的形成[26],反映了细胞的自噬水平增强。p62 连于LC3 的底物,被整合到自噬体中,然后与溶酶体结合形成自噬溶酶体,当自噬激活时处于自噬囊泡中的P62 及细胞器被降解,P62 水平降低[27],反之,当自噬被抑制时,P62水平增高。
我们使用透射电子显微镜对自噬小体及自噬溶酶体进行定性分析,使用激光共聚焦对LysoTracker染色的溶酶体进行形态观察,同时倒置荧光显微镜定量测定了自噬溶酶体的生成率,(16 500±500)lx光照射24 h后,定性分析发现了典型的自噬小体及自噬溶酶体,且激光共聚焦显微镜观察到染色后呈红色的自噬溶酶体明显增多;定量分析表明光照射12 h和24 h后,模型组ARPE-19细胞的红色荧光强度较对照细胞明显增强,且3MA干预后细胞的荧光强度较模型组明显降低。这些结果表明,光照射可以诱导ARPE-19细胞的自噬且3MA降低了其自噬水平。
3MA 是一种经典的自噬抑制剂,通过抑制CLASSⅢPI3K型磷脂酞肌醇激酶的活性,从而抑制自噬体的形成和自噬溶酶体对蛋白的降解功能[28]。有研究报道3MA抑制自噬可增加硝苯地平诱导的细胞凋亡并下调Beclin1表达,起到防治肝炎、肝脏纤维化[15]的作用;3MA通过阻止自噬小体的形成来抑制自噬[29],本研究使用自噬抑制剂3MA处理细胞,降低了光照刺激下(12 h和24 h)ARPE-19细胞的自噬溶酶体荧光强度。本研究的Western Blot显示,光照12 h和24 h,模型组自噬相关蛋白Beclin1、LC3Ⅱ的表达量均增高且LC3Ⅱ/LC3Ⅰ比值增高,P62 蛋白呈低表达。而采用3MA干预后,与对照组相比,光诱导12 h和24 h条件下,自噬相关蛋白Beclin1、LC3 Ⅱ的表达量均下降且LC3 Ⅱ/LC3 Ⅰ的比值降低,P62蛋白的表达量增高。这表明模型组自噬明显被激活即光照诱导自噬并增加自噬通量,而3MA干预后抑制了细胞的自噬。
凋亡可以维持细胞稳态,是一种程序性的细胞死亡。有研究表明,凋亡在多种疾病的发病机制中发挥着不可或缺的作用,包括涉及视网膜变性的疾病,如AMD[30]。结合凋亡及Western Blot检测结果,我们得出如下结论:给予ARPE-19细胞光照强度为(16 500±500)lx的可见光照射,细胞的自噬水平随着光照时间的不同而变化,在光照12 h时,细胞的自噬水平可以对抗光损伤维持细胞的代谢,所以3MA干预后细胞凋亡率较模型组增高;光照刺激24 h后,细胞自噬水平超过其正常调节的范围,因此3MA组细胞凋亡率低于模型组。我们猜测细胞的自噬水平不足会诱导细胞的凋亡,长时间的自噬也会导致细胞凋亡[31],使用自噬抑制剂3MA抑制光损伤诱导的ARPE-19细胞过度自噬,降低细胞凋亡率。
综上所述,本研究探讨了RPE细胞光损伤中自噬与凋亡之间的关系,并探讨3MA对光诱导下RPE细胞自噬和凋亡的影响,旨在为预防AMD发生、降低罹患风险以及开发治疗AMD的天然药物提供新的研发思路。本研究不足之处是只选取了2 个时间点来观察细胞自噬与凋亡情况,其动态性需要进一步的研究。
利益冲突申明本研究无任何利益冲突
作者贡献声明高园园:实施研究,收集数据及资料的分析和解释;撰写论文;根据编辑部的修改意见进行修改。李娟:实验研究,采集数据。雒玉:资料的分析和解释。李武军:分析解释数据,修改论文。俞洋:参与选题、设计、资料的分析和解释,修改论文中关键性结果、结论,根据编辑部的修改意见进行核修

