miR-21通过下调PPAR-α参与脂质代谢紊乱并促进糖尿病大鼠肾组织及肾小管上皮细胞纤维化病变*
向珈谊, 张会芳, 梁露群, 周星丞, 王 丹, 毛彦稳, 张小欢, 王圆圆, 郭 兵
(贵州医科大学基础医学院病理生理教研室,贵州省常见慢性疾病发病机制及药物研究重点实验室,贵州贵阳550025)
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病(diabetic mellitus,DM)严重的并发症之一,是导致慢性肾衰竭的重要原因。在DKD 进展至慢性肾衰竭的过程中,表现出肾小球滤过率下降,尿白蛋白排泄率增加,系膜细胞增生,肾小球硬化及肾小管间质纤维化[1],其中代谢紊乱在肾小管间质纤维化的发生发展中有着重要的作用。除典型糖代谢紊乱外,脂代谢紊乱也影响着肾纤维化的进展[2]。导致肾纤维化的机制是复杂的,包括炎症反应、氧化应激、肾脏近端小管细胞的凋亡、肌成纤维细胞的活化和细胞外基质的合成等[3]。微小RNA(microRNA,miRNA,miR)是高度保守的非编码小RNA,通过与靶转录物上的互补位点结合,在转录后调节基因表达水平,这使得miRNAs成为许多细胞过程的重要调节因子,如能量稳态、脂质代谢和胰腺细胞发育,脂肪生成等。近年来,体内和体外实验研究均表明miRNAs 在调节脂质代谢中起着至关重要的作用[4]。有文献报道,miR-21 通过促进脂蛋白的形成参与冠状动脉的粥样硬化过程[5]。在肾脏中的过度表达miR-21 会导致大鼠肾小管上皮细胞增殖,促进肾脏纤维化的发生[6]。提示miR-21 的失调可能通过影响代谢途径参与DKD 的发生发展。作为脂质代谢的关键调控因子过氧化物酶体增殖物激活受体α(peroxisome prolifer ator-activated receptors-α,PPAR-α),对氧化应激、抗炎和减缓凋亡发展等具有重要的调控作用。特异性PPAR-α 激动剂非诺贝特已被用于临床治疗减少脂毒性介导的细胞损伤[7],我们前期研究表明miR-21 可以促进糖尿病肾病的进展[6],但miR-21 是否作用于PPAR-α 影响脂质代谢紊乱,并且是否与DKD 的发生和发展有关,目前并不清楚。因此,本研究旨在探索在DKD 大鼠病程发展中miR-21及PPAR-α的表达变化与肾纤维化的可能关系。
材 料 和 方 法
1 实验动物与细胞
6 周龄清洁级雄性SD 大鼠12 只,体质量(180±20)g,购自辽宁长生生物技术有限公司,生产许可证号为SCXK(辽)2015-0001;大鼠肾小管上皮细胞株NRK-52E 购自广州吉妮欧生物科技有限公司;人肾皮质近曲小管上皮细胞HK-2 购自中国科学院昆明细胞库。
2 主要试剂
链脲佐菌素(streptozotocin,STZ)购自Sigma;胎牛血清(fetal bovine serum,FBS)、DMEM 正常糖培养液(葡萄糖浓度为5.5 mmol/L)、DMEM 高糖培养液(葡萄糖浓度为30.0 mmol/L)和胰蛋白酶购自Gibco;BCA 蛋白浓度测定试剂盒、Ⅰ抗稀释液和超敏ECL 化学发光显示剂(Beyotime);过硫酸铵(ammonium persulphate,APS)为Boster 产品;0.45 μm PVDF膜(Millipore);Tween-20(Solarbio);iQTM SYBR~Green Supermix(Bio-Rad);Lipofectamine 2000(Thermo);miR-21 inhibitor 和miR-21 mimics(RiboBio);非诺贝特(ApexBio);α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和β-actin 抗体(Solarbio);转化生长因子β1(transforming growth factor-β1,TGF-β1)、白细胞介素6(interleukin-6,IL-6)和PPAR-α 抗体(Abcam);纤连蛋白(fibronectin,FN)和Bax 抗体为Proteintech 产品;IL-18 ELISA 试剂盒(Elabscience);Annexin V-EGFP 细胞凋亡检测试剂盒(KeyGEN);双萤光素酶报告基因检测试剂盒(Beyotime)。
3 主要方法
3.1 糖尿病大鼠模型的复制和分组 将12只SD大鼠随机分为DM 组和正常对照(normal control,NC)组。适应性喂养1 周后,DM 组大鼠进行模型复制:乙醚麻醉后通过尾静脉给大鼠注射55 mg/kg 的STZ(STZ 用0.01 mmol/L、pH 为4.5 的无菌柠檬酸-柠檬酸钠缓冲液溶解),72 h 后测尾静脉空腹血糖,空腹血糖≥16.7 mmol/L,持续3 d 即为造模成功[1]。各组大鼠予普通饲料继续喂养,自由饮水,于成模10 周末处死。
3.2 收集大鼠尿、血和肾组织样本 成模10 周末收集大鼠24 h尿液并记录尿量;通过股动脉取血,静置后离心取血清,置于-80 ℃保存;取双侧肾脏,去除包膜及脂肪。用40 g/L 的多聚甲醛溶液将一侧肾脏固定,剩余的肾脏保存在-80 ℃。
3.3 生化检测 大鼠血糖用葡萄糖氧化酶法检测,血总胆固醇和甘油三酯用酶分析法检测,尿蛋白浓度用双缩脲法检测,具体操作步骤按试剂盒进行,其中24 h尿蛋白量=尿蛋白浓度×24 h尿量。
3.4 肾组织形态学的观察 用4%中性甲醛固定的肾脏组织制作成厚度约3 μm 的石蜡切片,用于HE和天狼星红染色,镜下观察肾组织形态学结构和纤维化病变的情况。天狼星红染色后胶原纤维呈红色,200 倍镜下随机选取10 个带肾小球的视野用Image J分析软件测量胶原红色阳性染色面积占组织总面积的百分比,即胶原容积分数(collagen volume fraction,CVF),取其平均值作为该肾组织的CVF。
3.5 细胞转染与分组 大鼠肾小管上皮细胞株NRK-52E 在37 ℃及5% CO2条件下进行培养。待细胞生长融合度达80%时,弃去培养瓶中的培养液,1 mL 无菌PBS 洗涤3 次,弃上清液并吸干,加入1 mL胰蛋白酶(浓度为0.25%,37 ℃预热)进行消化,细胞悬液均匀铺于6 孔板中。随机将细胞分为正常糖(normal glucose,NG)组、高糖组(high glucose,HG)组、空载体组(HG+vehicle)组、miR-21 抑制剂组(HG+miR-21 inhibitor 组),正常糖浓度为5.5 mmol/L葡萄糖,高糖浓度为30 mmol/L 葡萄糖;各组细胞于培养箱中孵育过夜;待细胞融合至50%~60%时,进行转染。转染液配制:Lipofectamine 2000 和miR-21 inhibitor 各7.5 μL,再加入DMEM 培养液(不含血清及双抗)285 μL 混匀、瞬离,在室温下于无菌环境静置10 min,最后加入DMEM 培养液2.7 mL 混匀为总体系3 mL 转染液;弃去培养皿中的培养液,加入已经混匀好的转染液,轻晃摇匀,继续于培养箱(37 ℃,5%CO2)中孵育48 h后收集细胞进行后续检测。
3.6 Western blot 检测目的蛋白 称取约60~100 mg 肾皮质置于冰预冷的匀浆器内,加入0.5~1 mL蛋白裂解液充分裂解后冰上研磨。超声击打组织液,1 616×g离心10 min,将上清转移至一个新的EP管中;各组细胞进行相应处理后,加入细胞裂解液后刮取细胞提取总蛋白。BCA 试剂盒测定蛋白浓度,加入1.5×上样缓冲液配制成统一浓度的蛋白样品,100 ℃煮沸10 min。蛋白经SDS-PAGE 分离后,转移至PVDF 膜上,5%脱脂奶粉溶液室温封闭1 h,TBST洗膜,分别加入PPAR-α(1∶1 000)、Bax(1∶5 000)、IL-6(1∶2 000)、TGF-β1(1∶1 000)、α-SMA(1∶200)、βactin(1∶10 000)和FN(1∶1 000)的Ⅰ抗,4 ℃孵育过夜,TBS 洗膜后加入相应Ⅱ抗,室温孵育1 h,TBST 洗膜3 次后ECL 显影,凝胶成像系统(ChemiDoc,Bio-Rad)扫描条带并分析结果。
3.7 ELISA 检测IL-18 水平 IL-18 试剂盒购自Elabscience,产品型号为E-EL-R0567c,操作步骤完全按照试剂盒说明书进行。
3.8 Real-time PCR 方法检测miR-21 和PPAR-α mRNA 表达 采用Trizol 法分离纯化各组组织的总RNA,分光光度法测定计算提取的总RNA 含量及浓度。由RiboBio 公司设计并合成miR-21 引物,并用RiboBio 试剂盒进行反转录,步骤及反应体系配制均按照说明书进行。扩增条件为:50°C 30 min;95°C 10 min;95 °C 2 s,60 °C 20 s,70 °C 10 s,40 个循环,70°C 10 min。Bio-Rad CFX96 荧光定量PCR 分析系统进行检测,分别以U6 和GADPH 为内参照,目的基因的相对含量以2-ΔΔCt表示,引物序列和退火温度见表1。
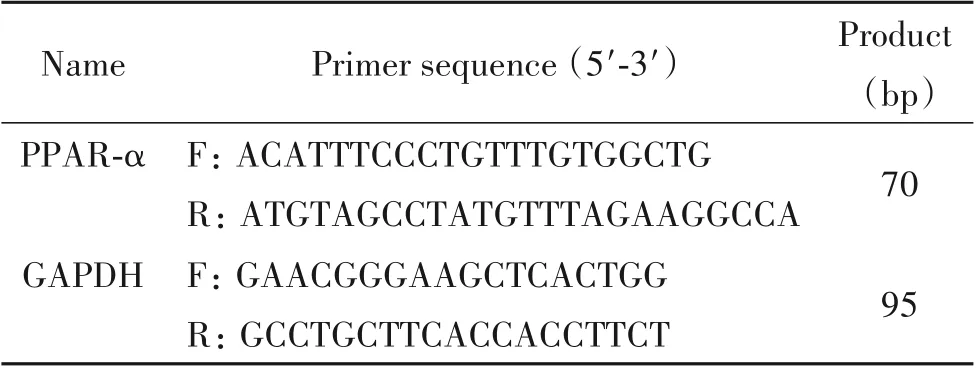
表1 Real-time PCR引物序列Table 1. Sequences of the primers used in real-time PCR
3.9 双萤光素酶报告基因实验验证miR-21 对PPAR-α 转录调控的作用 TargetScan 预测miR-21和PPAR-α 的3’UTR 区可能结合位点,合成包含PPAR-α 的野生型(WT-PPAR-α)或突变体(MUTPPAR-α)种子区的序列,并将其克隆到萤光素酶和海肾萤光素酶质粒中。HK-2 细胞予DMEM/F12 培养液(含10%胎牛血清)在培养皿中培养,待细胞融合至50%~60%,分别将WT-PPAR-α、MUT-PPARα 与miR-NC、miR-21 mimics 共转染,继续培养48 h,按照萤光素酶活性检测试剂盒,使用多功能酶标仪(Thermo Scientific VarioskanTMLUX)先后测定萤火虫萤光素酶和海肾萤光素酶的萤光数值,用海肾萤光素酶萤光强度作为内参照标准化后,统计比值数据、作图。
3.10 流式细胞仪分析NRK-52E 予非诺贝特刺激后的细胞凋亡水平 将稀释后的NRK-52E细胞悬液均匀铺于6 孔板中,随机将细胞分为NG 组、HG 组、溶剂对照组(HG+DMSO 组)和非诺贝特组(HG+Fenofibrate 组),细胞生长至60%融合时,弃上清,设3个复孔,以终浓度为10 mg/L 的非诺贝特刺激48h,弃上清,PBS 洗1 次,无EDTA 的胰酶消化细胞,加入1 mL 含2%BSA 的PBS 终止消化后,用PBS 洗2 次后收集细胞,加入试剂盒配备的试剂悬浮细胞后,分别加入Annexin V-EGFP,Propidium Iodide,混匀;室温、避光、反应5~15 min 进行流式细胞仪的观察和检测细胞凋亡水平(试剂用量按试剂说明书进行)并计算各组凋亡率。
4 统计学处理
所有数据用SPSS 26.0统计软件分析处理,各组数据经SPSS 26.0 分析后,数据用均数±标准差(mean±SD)表示。组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
结果
1 一般情况与相关生化指标改变
造模第1 周,大鼠血糖逐渐升高,部分大鼠血糖值≥16.7 mmol/L;造模第2 周时,全部模型组大鼠血糖值≥16.7 mmol/L;造模第10 周时,NC 组大鼠毛发光亮,饮食饮水正常,与NC 组比较,DM 组大鼠逐渐出现多饮、多食、尿量增多。与NC 组相比,DM 组大鼠血糖、24 h 尿蛋白、总胆固醇和甘油三酯均有显著增高(P<0.05),见表2。

表2 各组大鼠部分血液生化指标比较Table 2. Comparison of renal function indexes and biochemical indexes in each group(Mean±SD.n=6)
2 HE和天狼星红染色观察肾组织形态学改变
HE染色显示,NC组肾小球固有细胞未见显著增生,基底膜未见显著增厚,系膜区未见显著增宽,肾小管未见显著萎缩,上皮细胞未见显著变性,管腔内未见显著管型,肾间质及血管未见显著病变;DM 组部分肾小球囊腔稍扩张,系膜细胞及基质轻度增生,基底膜未见显著增厚,肾小管局灶节段性萎缩(萎缩面积小于10%),部分小管上皮颗粒变性,未见明显管型,肾间质小灶性淋巴细胞浸润。小血管壁未见显著增厚。肾脏组织天狼星红染色显示,NC 组肾脏组织结构清晰完整,肾间质阳性染色(红色)少;与NC组比较,DM 组肾脏组织结构排列紊乱,肾小球和肾小管有显著阳性染色,CVF升高(P<0.05),见图1。
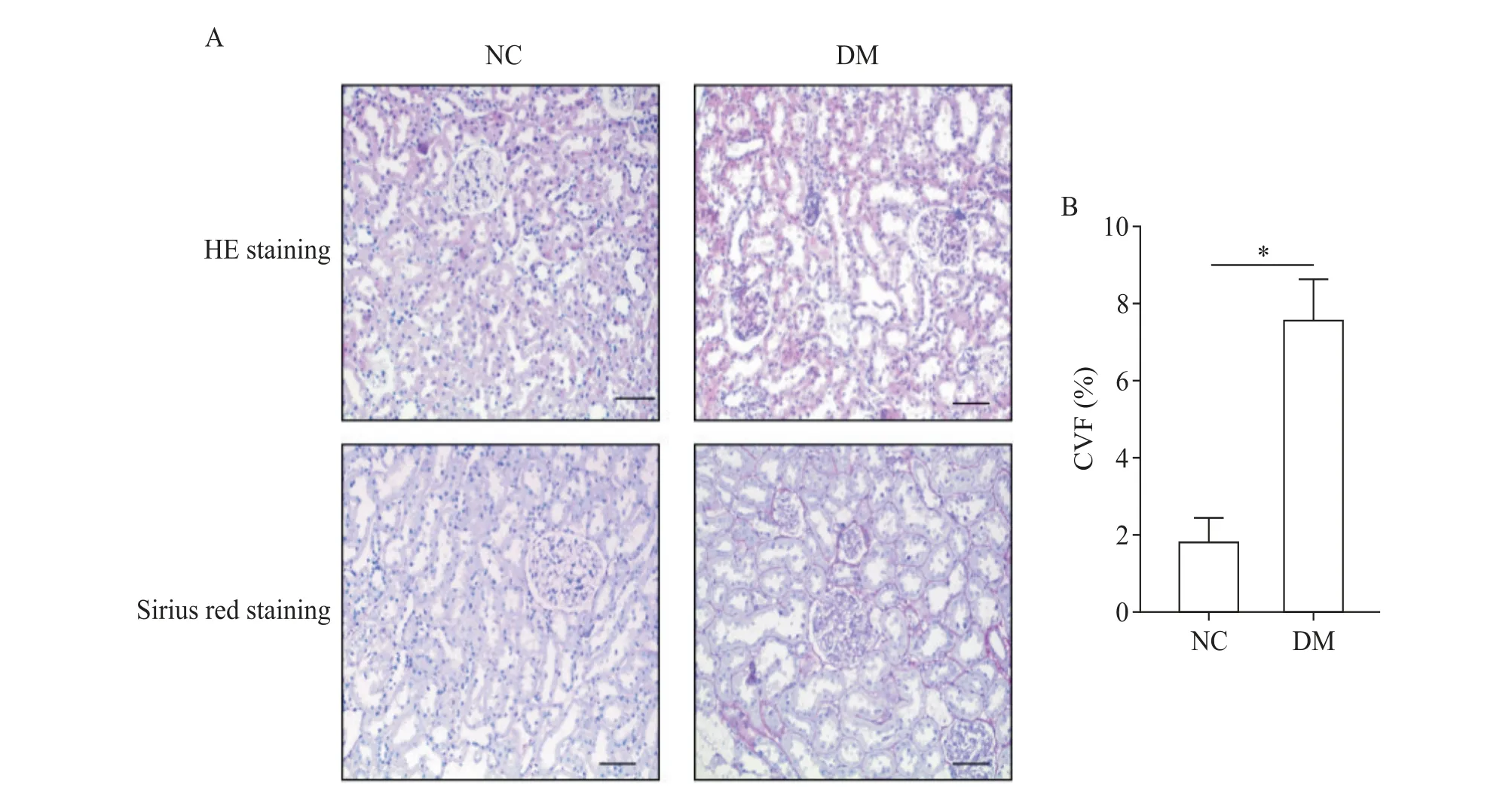
Figure 1. Histological change of kidneys in each group. A:representative images of HE staining and Sirius red staining(scale bar=50 μm);B:collagen volume fraction(CVF)was detected. Mean±SD.n=6.*P<0.05.图1 各组肾组织形态学变化
3 miR-21和PPAR-α mRNA 在各组大鼠肾组织中的表达
与NC 组相比,DM 组大鼠肾组织中miR-21 显著增多(P<0.05);PPAR-α mRNA 在DM 组中的表达量显著降低(P<0.05),见图2。

Figure 2. The levels of miR-21(A)and PPAR-α mRNA(B)in kidney tissues from NC group and DM group. Mean±SD.n=6.*P<0.05.图2 miR-21和PPAR-α mRNA在NC及DM大鼠肾组织中的表达
4 PPAR-α、FN、α-SMA、TGF-β1、IL-6、Bax 和IL-18蛋白在肾组织中的表达
Western blot 结果显示,PPAR-α 蛋白在NC 组大鼠肾皮质呈高表达,在DM 组表达较NC 组显著减少(P<0.05)。与NC 组相比,DM 组大鼠肾组织中FN、α-SMA、TGF-β1、IL-6 和Bax 蛋白表达增多(P<0.05),见图3A;ELISA 检测结果显示,与NC组相比,DM组IL-18的含量升高(P<0.05),见图3B。

Figure 3. Relative protein expression of PPAR-α,FN,α-SMA,TGF-β1,IL-6,Bax and IL-18 in renal tissues of each group. A:the protein levels of PPAR-α,FN,α-SMA,TGF-β1,IL-6 and Bax in renal tissues were detected by Western blot;B:the expression of IL-18 in renal tissues was detected by ELISA. Mean±SD.n=6.*P<0.05.图3 PPAR-α、FN、α-SMA、TGF-β1、IL-6、Bax和IL-18蛋白在各组肾组织的表达
5 miR-21靶向抑制PPAR-α表达
通过TargetScan 预测,分别构建含有野生型PPAR-α 3'-UTR 和突变型PPAR-α 3'-UTR 序列的萤光素酶报告基因质粒(图4A)。双萤光素酶报告实验结果显示,在HK-2 细胞中转染野生型载体WTPPAR-α的细胞实验中,miR-21组萤光素酶活性显著低于miR-NC 组(P<0.05);转染突变型载体MUTPPAR-α的细胞实验中,miR-21 组萤光素酶活性与miR-NC 组比较,差异无统计学意义(P>0.05),见图4B。Western blot 结果显示,在HK-2 细胞过表达miR-21 后,PPAR-α 蛋白表达显著降低(P<0.05),见图4C。

Figure 4. PPAR-α expression was inhibited by miR-21. A:bioinformatics website TargetScan predicts that miR-21 may regulate thePPAR-α gene;B:PPAR-α luciferase activity detection results;C:down-regulation of PPAR-α protein level after miR-21 mimics transfection. Mean±SD.n=3.*P<0.05.图4 miR-21靶向抑制PPAR-α表达
6 miR-21 抑制剂减轻高糖条件下大鼠肾小管上皮细胞的损伤
Western blot 结果显示,与NG 组相比,高糖刺激肾小管上皮细胞后PPAR-α 蛋白表达显著下降,FN、IL-6 和Bax 蛋白表达水平均显著增加(P<0.05);在HG处理并转染miR-21抑制剂后,NRK-52E中PPARα 蛋白表达水平显著升高,FN、IL-6 和Bax 蛋白表达显著下调(P<0.05),见图5。

Figure 5. miR-21 inhibitor attenuated hyperglycemia-induced NRK-52E cell damage. Mean±SD.n=3.*P<0.05;#P<0.05.图5 miR-21抑制剂减轻高糖条件下大鼠肾小管上皮细胞的损伤
7 非诺贝特抑制高糖对大鼠肾小管上皮细胞的损伤
流式细胞仪检测细胞凋亡实验结果显示,与NG组[(4.34±0.27)%]相比,HG 刺激后细胞凋亡率[(15.29±3.07)%]显著增高;与溶剂对照组[(14.88±4.04)%]相比,在给予PPAR-α 特异性激动剂非诺贝特后,其细胞凋亡率[(7.17±0.61)%]减少(P<0.05),见图6A;Western blot 结果显示,与NG 组相比,高糖刺激肾小管上皮细胞后PPAR-α蛋白表达显著下降,FN 和IL-6 蛋白表达水平均显著增加(P<0.05);在HG处理并给予非诺贝特后,NRK-52E细胞PPAR-α 蛋白表达水平显著升高,FN 和IL-6 蛋白表达显著下调(P<0.05),见图6B。

Figure 6. Fenofibrate inhibited the damage of renal tubular epithelial cells induced by high glucose. A:flow cytometry results of NRK-52E cells in each group;B:Western blot results of PPAR-α,FN and IL-6 expression. Mean±SD.n=3.*P<0.05;#P<0.05.图6 非诺贝特抑制高糖对大鼠肾小管上皮细胞的损伤
讨论
DKD 是糖尿病的主要并发症之一,已经成为终末期肾病的首要病因,其主要病理改变特点为肾小球硬化和肾小管间质纤维化,常表现为上皮细胞-间充质转化(epithelial-mesenchymal transitio,EMT)发生和细胞外基质(extracellular matrix,ECM)过度沉积[8]。代谢紊乱在DKD 病程的发展中有着重要的作用,长期的高血糖会引起脂蛋白脂肪酶的功能降低,导致甘油三酯水平升高,高密度脂蛋白胆固醇下降等血脂改变[9]。本研究结果显示,与NC 组相比较,DM 组大鼠10 周末血糖、24 h 尿蛋白、总胆固醇与甘油三酯均显著增高,生化指标结果表明DM组大鼠已发生糖、脂代谢紊乱;同时肾脏切片显示,肾小管管腔增大,胶原纤维沉积,明确肾脏形态已经发生异常病理改变;与NC组相比,DM组中α-SMA、FN和TGFβ1 的表达增加;结合生化指标与病理形态学,说明DM大鼠肾脏发生了EMT及纤维化病变。
目前研究表明,多种miRNAs在肾细胞中有功能表达,并且在肾脏生理功能调节和肾脏相关疾病如糖尿病肾病发生和发展中发挥重要调控作用,如miR-21、miR-377 和miR-93 等[10]。其中,miR-21 可通过调控下游PTEN/AKT、TGF-β1/smad3 等几种主要的信号通路影响DKD 的发生发展[11]。课题组前期研究结果显示miR-21 在肾脏纤维化发生发展过程中发挥重要作用[6],本研究结果与前述文献结果[6,11]一致。在本研究中,糖尿病大鼠肾组织中miR-21 表达水平显著升高、α-SMA、TGF-β1 和FN 蛋白表达增多;高糖培养的大鼠肾小管上皮细胞中抑制miR-21可降低FN 蛋白表达减缓纤维化的发展。这些结果均证实miR-21参与DKD 的发生发展,而抑制miR-21可延缓肾脏纤维化。
Ni等[12]在人类非小细胞肺癌细胞中过表达miR-21后,观察到细胞内脂质的含量显著增加,并且脂肪酸合酶,乙酰辅酶A羧化酶1等关键脂质代谢酶的水平显著提高。PPAR-α 是过氧化物酶体增殖物激活受体(peroxisome prolifer ator-activated receptors,PPARs)中一个重要亚型,在肾脏、肝脏和心脏等脏器中呈高度表达[13]。作为脂肪酸氧化酶基因的主要转录调控子,PPAR-α 能够激活过氧化物酶体、线粒体基质中涉及脂肪酸氧化的多个基因参与维持正常的脂质代谢。因PPAR-α是与脂质代谢关系非常密切的基因,为了进一步阐明miR-21 参与脂质代谢紊乱调节糖尿病肾病大鼠的机制,我们采用real-time PCR 方法研究DM 组大鼠体内miR-21 与PPAR-α mRNA 的表达情况。结果显示,与NC 组相比,DM 组肾组织miR-21 表达较NC 组显著性增高,而PPAR-α mRNA 和蛋白的表达则显著降低。并且在高糖条件下培养的肾小管上皮细胞中,给予miR-21 inhibitor能逆转高糖对PPAR-α 的抑制效应。这些数据提示miR-21 可调控PPAR-α基因表达。我们通过生物信息学网站TargetScan 分析预测miR-21 的种子序列(5'-AGCUUA-'3)与人PPAR-α mRNA 的3'UTR 序列(5'-UAAGCU-3')互补。体外萤光素酶检测结果显示miR-21 mimics 可显著抑制PPAR-α 的转录活化,若突变PPAR-α 3'UTR 结合区域,可消除该效应;并且,给予miR-21 mimics 可下调肾小管上皮细胞PPAR-α蛋白水平,提示miR-21能够靶向抑制PPARα 表达。因此,我们推测miR-21 通过抑制靶基因PPAR-α表达发挥其生物学作用。
在单侧输尿管梗阻的模型中,上调PPAR-α可显著抑制促炎细胞因子/趋化因子IL-6,肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的mRNA 表达[14]。在肝癌细胞中,PPAR-α 还抑制炎症因子IL-18 的表达[15]。IL-6 和IL-18 作为重要的促炎细胞因子,可促进其他炎症因子释放,使血管通透性增加,致使肾小球基底膜损伤进而导致肾脏的损伤以及纤维化[16]。有文献报道,上调PPAR-α的表达可减弱凋亡源性因子如Bax 、caspase 的水平[17]。Tanaka 等[18]研究结果显示,PPAR-α 特异性激动剂非诺贝特可减轻高脂导致的肾小球损伤和肾小管间质的损伤,增加脂肪分解酶的表达,加强肾脏的脂解作用,减弱肾脏的氧化应激反应与炎症反应。体内实验中,在DM组肾组织中炎症因子IL-6和IL-18及凋亡蛋白Bax的表达水平较NC 组显著升高。体外实验中,与NG 组相比,在HG环境中,IL-6、Bax和FN蛋白表达显著升高,抑制miR-21 后上述效应反转;给予PPAR-α 激动剂非诺贝特后,不仅显著降低细胞凋亡率,并且可减少HG 诱导的IL-6 和FN 蛋白表达。这与抑制miR-21 的效应相同,结合上述实验结果,我们认为miR-21可下调脂代谢关键因子PPAR-α促进细胞炎症与凋亡反应,这可能是miR-21导致DKD进展的重要机制之一。
综上所述,高糖可通过上调miR-21 抑制PPARα 表达,导致脂质代谢紊乱,进而促进肾小管上皮细胞炎症反应及凋亡,参与糖尿病大鼠肾脏组织EMT的发生和ECM 沉积,最终影响其肾脏纤维化的发生发展,但具体机制仍需要进一步研究阐释。

