维甲酸受体反应蛋白2活化NLRP3炎症小体在慢性阻塞性肺疾病炎性损伤中的作用机制研究*
杨文俊, 肖迎港, 张 扬, 陆大浩, 李华玲, 高 巨△
(1扬州大学临床医学院附属苏北人民医院麻醉科,2扬州大学,江苏扬州 225001)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以气流受限为特征的肺部疾病,气流受限不完全可逆,呈进行性发展。COPD 的炎性损伤涉及肺部及其他肺外器官[1]。近年来全球范围内的COPD 发病率与死亡率都急剧上升,预计到2030 年,COPD 将成为世界第三大死因和第五大致残原因[2]。维甲酸受体反应蛋白2(retinoic acid receptor responder 2,RARRES2)是与肺、皮肤和心血管等多个器官炎症和免疫代谢疾病的发生息息相关的脂肪因子之一[3]。目前已有研究证明,RARRES2 在COPD 发展中表达异常,可能与COPD发展中的炎性损伤有关[4]。核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)是参与炎症反应的重要蛋白,可能在COPD 炎性损伤中的发挥重要作用[5]。然而目前对RARRES2在COPD 中NLRP3炎症小体的作用知之甚少。本研究旨在探寻RARRES2 在COPD 小鼠中的作用以及RARRES2 是否通过NLRP3炎症小体调控COPD的炎性损伤。
材 料 和 方 法
1 实验动物
SPF 级野生型雌性C57BL/6J 小鼠32 只,10~12周龄,体质量(18±2)g,由扬州大学动物实验中心提供,许可证号为SYXK(苏)2017-0044。
2 主要试剂与仪器
RARRES2-siRNA 及阴性对照(negeative control,NC)siRNA(Cohesion);小鼠白细胞介素1β(interleukin-1β,IL-1β)和IL-18 ELISA 试剂盒(Thermo Fisher Scientific);RARRES2 抗体(Abcam);NLRP3、caspase-1、IL-1和IL-18抗体(中国武汉赛维尔生物科技有限公司);大前门香烟(焦油10 mg,烟碱0.8 mg,CO 12 mg)。自制烟熏有机玻璃舱(规格40 cm×30 cm×16 cm)。实验中RARRES2-siRNA 及NC siRNA分别溶解于不含RNA 的无菌水中,与适量阳离子脂质体(Lipofectamine)于室温下温育30 min 以形成siRNA-Lipofectamine 复合体(10 g/L),以用于小鼠尾静脉注射。
3 实验方法
3.1 COPD 小鼠模型的构建 将入选的野生型C57BL/6J 小鼠随机分成4 组(n=8):空白对照小鼠组(control 组)、COPD 小鼠组(COPD 组)、注射NC siRNA 的COPD 小鼠组(COPD+NC 组)和注射RARRES2-siRNA 的COPD 小鼠组(COPD+siRNA组),所有动物饲养和处置过程均符合规范。参考Demoor等[4]的方法,我们采用香烟烟雾烟熏小鼠的方法进行COPD 造模。除control 组小鼠外,其余3 组小鼠均全身暴露在3 支香烟的烟雾中,每天3 次,间隔30 min,每周进行7次烟熏,共持续12周。COPD+NC组和COPD+RARRES2-siRNA 组每周从尾静脉注射相应siRNA(2.5 mg/kg)。最后一次烟熏后24 h取材。
3.2 HE 染色观察肺组织病例形态学改变 12周动物称重后断颈处死。取左肺下叶肺用甲醛固定24 h后,进行脱水、石蜡包埋、切片,行HE染色,显微镜下观察肺组织病理学改变。
3.3 血气分析 3 组小鼠取动脉血样本0.2 mL 进行血气分析,以检测氧分压(PaO2)、二氧化碳分压(PaCO2)和pH,并计算氧合指数(oxygenation index)。
3.4 血浆及支气管肺泡灌洗液(broncho alveolar lavage fluid,BALF)细胞因子测定 动物断颈取血后,使用烘干的肝素管或有少量液体的肝素抗凝管,将得到的全血与抗凝剂充分混匀,经过1 006.2×g离心15 min 分离出血浆样本。结扎左支气管以阻断左肺,用0.5 mL 对右肺进行单肺灌洗,重复抽吸3 次,获得BALF。按照ELISA 试剂盒说明书,检测小鼠BALF和血浆中IL-18和IL-1β的表达情况。
3.5 肺湿/干重比的测定 所有小鼠肺灌洗结束后,取左肺上叶肺组织,称其湿重后置于80 ℃烘箱烘烤24 h后称其干重,计算湿重/干重比值。
3.6 免疫组织化学染色 4 μm 的组织切片抗原修复后放入3%双氧水中孵育25 min,加入抗NLRP3、抗IL-1β 和抗caspase-1 抗体在4 ℃孵育过夜。然后用磷酸盐缓冲液洗涤切片,在37 ℃的Ⅱ抗中孵育30 min,用DAB显色,苏木素复染细胞核,脱水封片。使用ImageJ软件对其进行分析。
3.7 RARRES2、NLRP3、IL-1β 和caspase-1 的蛋白含量分析 制备肺匀浆组织并静置30 min,于4 ℃、25 155×g离心15 min 得到蛋白溶液,将蛋白质样品(60 μg)电泳并转移到硝酸纤维素膜上。在用5%脱脂牛奶封闭后,将膜与抗RARRES2、抗NLRP3、抗IL-1β 和抗caspase-1 抗体在4 ℃下孵育过夜。随后,用PBS洗涤3次后,将膜与辣根过氧化物酶偶联Ⅱ抗在室温下孵育2 h,酶法显色扫描。用ImageJ 图像分析系统进行分析对蛋白条带进行定量分析。以目的蛋白条带灰度值与GRAPH 带灰度值的比值,计算上述蛋白的相对表达量
3.8 RT-qPCR 取适量肺组织,利用Trizol 法提取组织中的总RNA,测定浓度后按照试剂盒说明书逆转录为cDNA,用SYBR-Green I Real-Time PCR Kit 进行PCR。GAPDH 的上游引物序列为5'-AGGTCGGTGTGAACGGATTTG-3',下游引物序列为5'-TGTAGACCATGTAGTTGAGGTCA-3';RARRES2的上游引物序列为5'-GTCCACTGCCCATAGAGAC-3',下游引物序列为5'-CCAGGGAAGTAGAAGCTGTGG-3'。
4 统计学处理
采用SPSS 19.0 和GraphPad Prism 8.0 进行统计分析和作图。正态分布计量资料以均数±标准差(mean±SD)表示。组间均数比较使用单因素方差分析,两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
结果
1 敲减RARRES2 对COPD 小鼠血气分析和肺湿/干重比的影响
与control 组比较,COPD 组肺湿/干重比显著增加(P<0.05),氧合指数显著降低(P<0.05);与COPD组相比,COPD+NC组肺湿/干重比和氧合指数的差异无统计学意义(P>0.05),COPD+siRNA 组小鼠肺湿/干重比显著下降(P<0.05),氧合指数显著增加(P<0.05),见图1。

Figure 1. Comparison of lung wet/dry weight ratio(A)and oxygenation index(B)of the mice in each group. Mean±SD.n=8.*P<0.05vs control group;#P<0.05vs COPD group.图1 各组小鼠肺湿/干重比和氧合指数
2 敲减RARRES2对COPD小鼠肺组织病理结构的改变
镜下可见control 组小鼠肺组织完整,未见明显的肺泡水肿及结构破坏,未见炎症细胞浸润,平滑肌层和支气管管壁未见异常(图2A);COPD 组和COPD+NC 组小鼠肺泡结构紊乱,肺泡不规则扩大,小气道和肺血管大量炎症细胞浸润,平滑肌层增厚,支气管管壁上皮增生(图2B、C);COPD+siRNA 组小鼠肺泡结构基本完整,小气道和肺血管少量炎症细胞浸润,平滑肌层和支气管皮偶见异常(图2D)。

Figure 2. Histopathological observation(HE staining,scale bar=20 μm). A:control group;B:COPD group;C:COPD+NC group;D:COPD+siRNA group. The lung tissue of mice in control group was intact and there was no obvious alveolar edema and structural damage. The structure of alveoli in COPD group and COPD+NC group was disordered,the alveoli were enlarged irregularly,and a large number of inflammatory cells infiltrated in small airway and pulmonary vessels. These pathological changes were attenuated in COPD+siRNA group.图2 各组小鼠肺组织HE染色
3 吸烟小鼠肺组织内RARRES2表达增高
与control 组相比较,COPD 组小鼠肺内RARRES2 表达显著增高(P<0.05);与COPD 组相比较,COPD+NC 组RARRES2表达水平无显著差异(P>0.05),COPD+siRNA 组RARRES2 表达水平显著下降(P<0.05),见图3。

Figure 3. The protein(A)and mRNA(B)expression levels of RARRES2 in lung tissues of the mice in each group. Mean±SD.n=8.*P<0.05vs control group;#P<0.05vs COPD group.图3 各组小鼠肺组织中RARRES2表达
4 敲减RARRES2 对小鼠肺组织NLRP3、IL-1β 和caspase-1表达影响
Western blot 分析显示,与control 组比较,COPD组小鼠肺组织NLRP3、caspase-1 p20 和IL-1β 表达均显著增高(P<0.05);与COPD 组比较,COPD+NC 组小鼠肺组织NLRP3、caspase-1 p20 和IL-1β 表达水平的差异无统计学显著性(P>0.05),COPD+siRNA 组小鼠肺组织NLRP3、caspase-1 p20 和IL-1β 表达水平显著降低(P<0.05),见图4A。免疫组织化学染色分析也提示相似结果,见图4B。
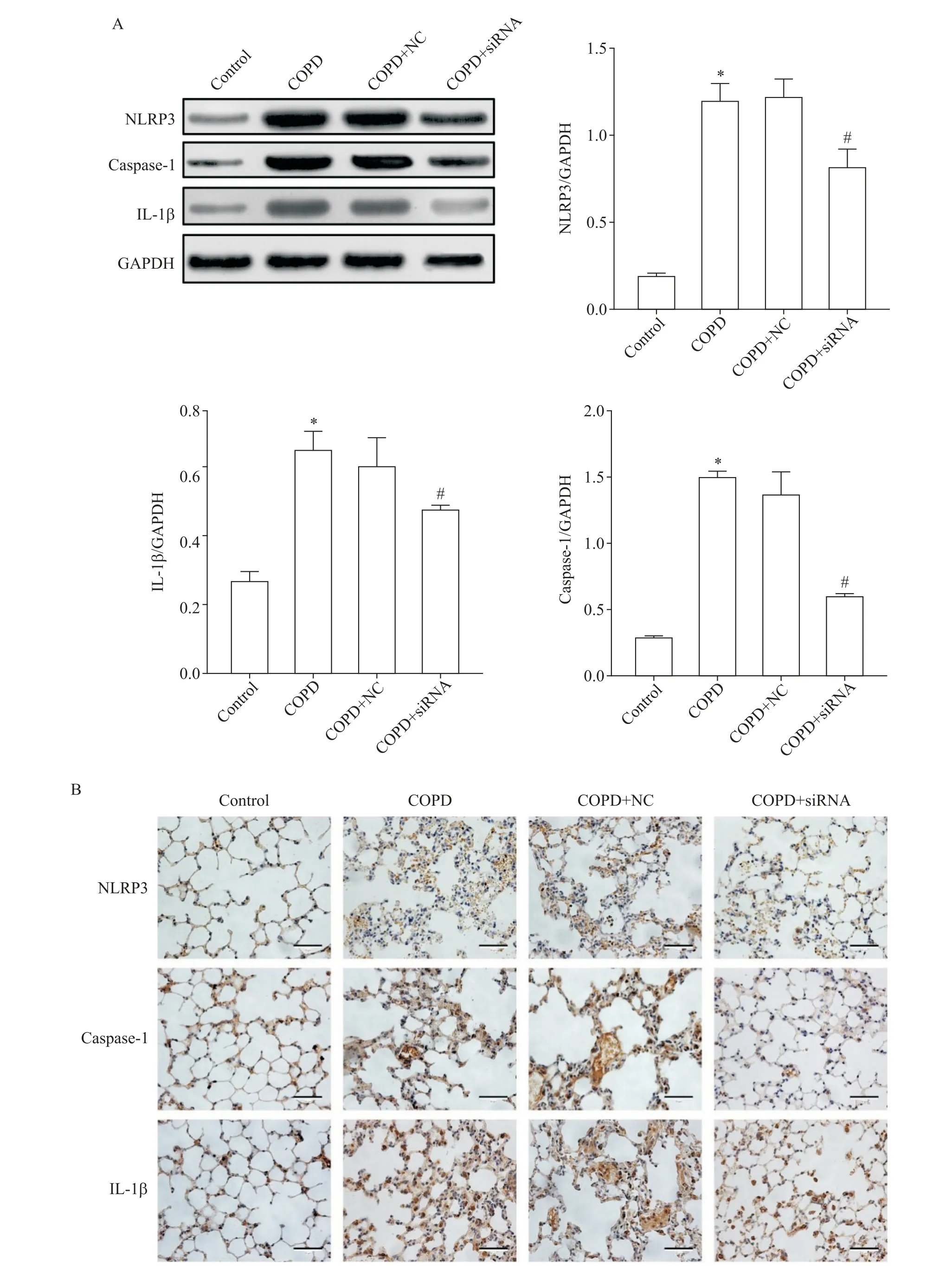
Figure 4. The protein expression of NLRP3,IL-1β and caspase-1 in lung tissues of the mice in each group. A:the protein expression of NLRP3,IL-1β and caspase-1 was detected by Western blot;B:immunohistochemical staining of NLRP3,caspase-1 and IL-1β(scale bar=50 μm). Mean±SD.n=8.*P<0.05vs control group;#P<0.05vs COPD group.图4 各组小鼠肺组织中NLRP3、IL-1β和caspase-1的表达
5 敲减RARRES2 对小鼠BALF 和血浆中细胞因子的影响
与control 组比较,COPD 组小鼠BALF 和血浆中IL-1β 和IL-18 表达水平均显著升高(P<0.05);与COPD 组比较,COPD+NC 组小鼠BALF 和血浆中IL-1β 和IL-18 表达水平的差异无统计学显著性(P>0.05),COPD+siRNA 组小鼠BALF 和血浆中IL-1β 和IL-18表达水平显著降低(P<0.05),见图5。

Figure 5. The expression levels of IL-1β in plasma(A)and BALF(B),and IL-18 in plasma(C)and BALF(D)of the mice in each group. Mean±SD.n=8.*P<0.05vs control group;#P<0.05vs COPD group.图5 各组小鼠血浆和BALF中细胞因子的表达
讨论
COPD 疾病发病机制十分复杂,而气道长期慢性炎症与疾病发生发展进程密切相关[6]。近年来,随着对炎症小体的进一步研究,炎症小体所介导的慢性炎症在COPD 疾病发生发展中的作用愈发受到关注。目前COPD 疾病条件下调控炎症小体的关键上游分子尚知之甚少。因此本研究参考Demoor 等[4]的方法,建立香烟烟雾烟熏COPD 小鼠模型,观察RARRES2 通过调控NLRP3 炎症小体参与COPD 疾病发生发展。在本研究中,我们观察到COPD 组小鼠的肺组织病理学损伤、湿干重比比值的增加、动脉血氧合指数的下降,提示动物造模成功。
RARRES2 属于趋化素家族一员,在炎症条件下RARRES2 前体可通过丝氨酸蛋白酶及蛋白水解酶的裂解,去除羧基末端最后6 或7 个抑制性氨基酸,最终转化为具有完全活性的RARRES2,并与其受体共表达于特异性免疫细胞,并参与炎症调控[7]。本研究表明,在COPD 小鼠肺组织中RARRES2 表达显著上调,通过持续尾静脉注射RARRES2-siRNA 敲减RARRES2表达,COPD 小鼠肺组织损伤程度及炎症反应水平均明显减轻,提示RARRES2 可能在COPD疾病中发挥重要作用。与之类似的是,柴油废弃颗粒物诱导[8]和香烟烟雾诱导[4]急性肺炎小鼠模型中RARRES2 被中性粒细胞所活化募集了更多的炎症细胞作用于血管内皮细胞以影响血管重塑[9],同时还促进了抗原呈递细胞和更多中性粒细胞从而加重炎性损伤[10-11]。
NLRP3 炎症小体由NLRP3、caspase-1 和含胱天蛋白酶募集结构域的凋亡相关斑点样蛋白组成,它通过调节促炎细胞因子,如IL-1β 等的成熟和分泌,有效地调节机体天然免疫功能[12]。而NLRP3炎症小体的异常活化则与糖尿病[13]、COPD[14-15]等疾病的发生与发展有关。与之相一致,本研究表明NLRP3 炎症小体在COPD 小鼠肺组织内异常活化,促进炎症因子IL-1β 和IL-18 的高表达,我们通过敲减RARRES2表达可以抑制NLRP3 炎症小体的活化,提示RARRES2 可能是NLRP3 炎症小体关键的上游调控因子。既往研究中RARRES2 被认为参与在非酒精性脂肪性肝病小鼠模型[16]和肢体缺血/再灌注急性肺损伤大鼠模型[17]中Kupffer 细胞中NLRP3 炎症小体的激活。与既往研究相似,本研究表明COPD小鼠的肺组织中NLRP3 炎症小体表达增加,在RARRES2 低表达小鼠组中NLRP3 炎症小体表达下降,同时NLRP3 炎症小体下游通路IL-18 和IL-1β[18]的肺内外过度表达被抑制。本实验结果提示,RARRES2 不仅在肺内激活NLRP3 炎症小体促进COPD 小鼠肺部的炎性损伤,对肺外的炎症同样有促进作用;因此我们推测RARRES2对肺内的NLRP3炎症小体的激活使其发挥生物学效应,激活下游炎症因子高表达,而炎症因子在气道高表达的同时外溢进入循环系统,激活血浆中的相关细胞因子,产生级联放大效应,诱发和维持炎症反应,RARRES2 对肺外的炎症因子的激活也许是COPD 中系统性炎症长期存在的原因。
综上所述,本实验对RARRES2介导NLRP3炎症小体在COPD 小鼠炎性损伤中的作用进行了初步探讨,研究表明RARRES2基因敲减可减轻COPD 小鼠的肺部损伤,减少肺内外炎症因子表达,从而减轻COPD 小鼠炎性损伤,其机制可能与抑制NLRP3 炎症小体表达,从而降低IL-1β 和IL-18 等炎症因子水平有关。

