干旱胁迫下发菜光合作用相关基因差异表达分析
马晓蓉,梁新华,张 筝,胡进红,周思丽,梁文裕
(宁夏大学 生命科学学院, 银川 750021)
发菜(Nostocflagelliforme)是一种分布在中国西北干旱半干旱荒漠草原地区的陆生固氮念珠藻。发菜为适应干旱的生存环境,进化出一系列独特的形态结构和生理代谢特性来适应干旱,如细胞被主要成分为多糖的胶质鞘包裹,使发菜具有极强的吸收水分和保持水分的能力,在极端干旱环境下与其他旱生植物相比具有更强的适应能力,干旱胁迫下发菜生理活性降低甚至进入类似休眠状态以度过不良时期[1]。已有研究表明,陆生念珠藻耐干旱的机理是其结构、生理及分子水平上协调作用的综合反映[2]。
由于光合作用作为发菜生长发育的生理基础和能量代谢的起点,其相关基因差异表达及其调控的机制对深入理解其生长发育和抗逆机制至关重要,虽然目前对发菜响应干旱胁迫的光合生理及蛋白质表达规律有了初步的认识,然而发菜在干旱胁迫条件下光合机构及光合作用相关基因如何变化以适应干旱胁迫并不明确。因此,本研究采用高通量测序技术及生物信息学方法对发菜干旱胁迫下差异表达的光合作用相关基因进行筛选,采用qRT-PCR进一步分析关键基因差异表达规律,并对光合色素和相关酶活性进行检测,进而解析干旱条件下发菜光合相关基因差异表达规律,为深入认识发菜耐旱的光合分子机理奠定基础。
1 材料和方法
1.1 材 料
将采自宁夏贺兰山自然生长的发菜培植于培养床上,持续培养10 d,测定光合速率及Rubisco活性,与野生状态发菜进行比较,确保发菜处于正常生长状态后对样品进行处理。发菜失水率0%的样品为对照组(A),经过失水处理30 min、60 min和48 h分别获得发菜失水率为30%的样品(B)、75%的样品(C)和100%的样品(D)。每组处理重复3次。
1.2 方 法
1.2.1 RNA提取及cDNA测序文库构建发菜RNA提取采用杨佳[9]的方法。样品总RNA质量检测合格后,构建测序文库。将RNA样本充分混合,然后去除rRNA富集mRNA。以mRNA为模板,合成第一条cDNA链,经过dNTP反转录合成第二条cDNA链,纯化双链cDNA以及做末端修复、加polyA并连接测序接头,然后进行片段大小选择,最后进行PCR扩增,建立样本转录组测序文库。
使用核酸蛋白定量仪(Qubit2.0)初步定量构建完成的文库,稀释文库至1 ng/μL,随后使用安捷伦2100生物分析仪(Agilent 2100)对文库的大小进行检测。采用qRT-PCR方法将插入片段符合预期的文库准确定量其有效浓度(文库有效浓度>2 nmol/L),以确保文库质量达到送样要求。
1.2.2 Illumina HiSeq测序及差异基因筛选通过高通量Illumina HiSeq PE150测序平台对已构建好的文库进行测序获得原始数据。对原始数据进行去除带接头(adapter)的读段(reads)、去除N(N表示无法确定碱基信息)的比例大于10%的reads和去除低质量reads(碱基质量值Phredscore≤5的碱基数占整个读段长度的50%以上)的处理,获得测序后的过滤数据(clean reads)。然后以发菜基因组(http://genome. kazusa.or.jp/cyanobase/NostocflagelliformeCCNUN1)作为参考基因组进行序列比对。以P<0.05为光合作用相关差异表达基因筛选标准。
1.2.3 光合作用相关基因的qRT-PCR分析选择转录组测序中筛选的部分重要差异光合作用相关基因进行qRT-PCR验证。qRT-PCR定量实验用(Vazyme)诺唯赞生物科技有限公司(中国,南京)试剂盒完成。荧光定量检测用ChamQ Universal SYBR qPCR Master Mix试剂盒。根据NCBI上已发表的发菜基因组信息,用Primer Premier 5.0设计目的基因扩增引物(表1),内参基因16S rDNA引物16S-F和16S-R,用Roche LightCycler480型荧光定量PCR仪进行反应,PCR扩增条件为95 ℃ 10 min;95 ℃ 30 s;60 ℃ 1 min;共41个循环。采用2-ΔΔCt方法[10-11]分析基因的相对表达量,每个反应3次重复。
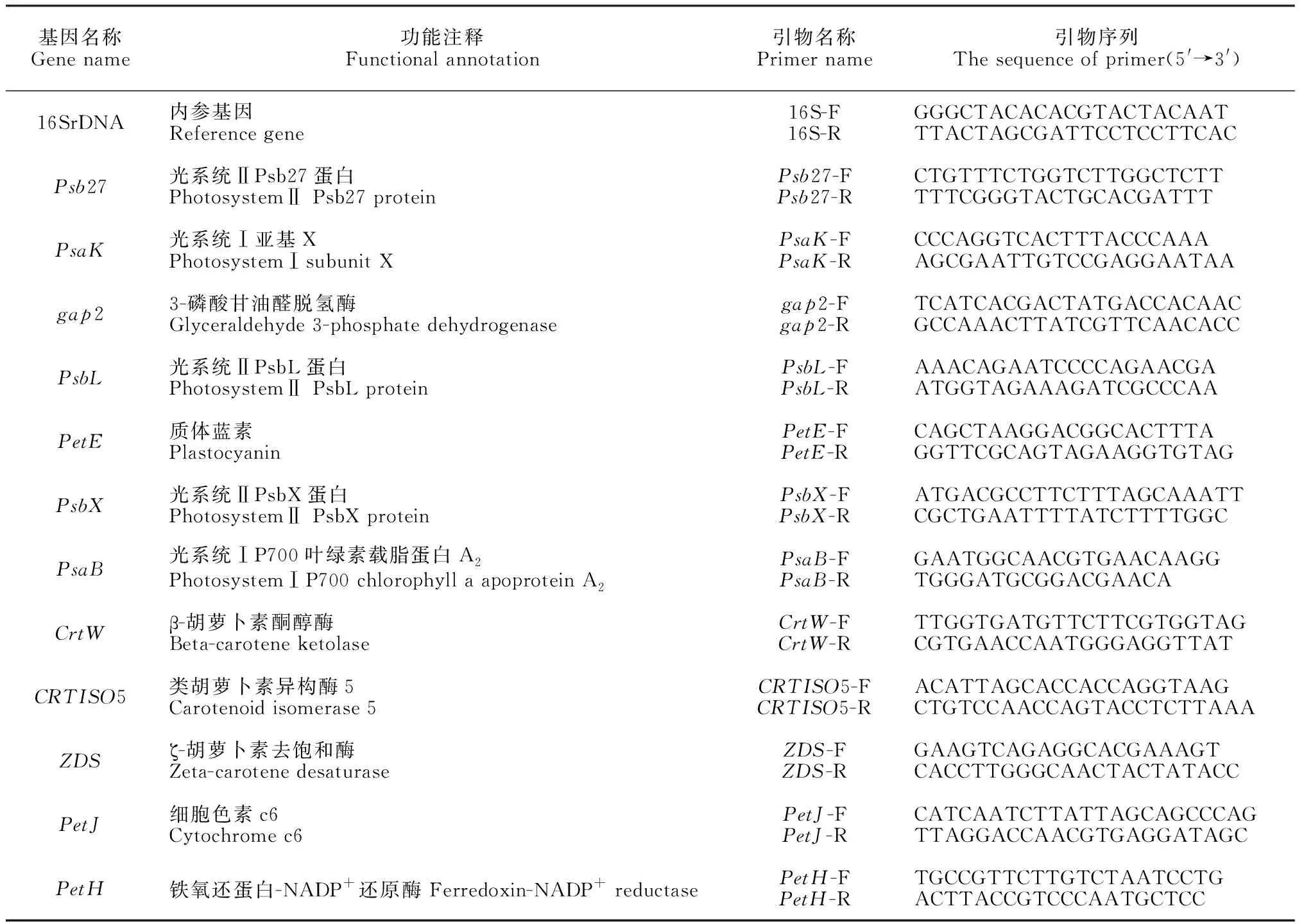
表1 基因功能注释及引物序列
1.2.4 光合色素含量检测藻蓝素、异藻蓝素、藻红素和藻胆素含量测定参照张薇君等[12]的方法。
藻蓝素(PC,mg·mL-1)=0.187OD620-0.089OD652
异藻蓝素(APC,mg·mL-1) = 0.196OD652-0.041OD620
藻红素(PE,mg·mL-1) =0.104OD562-0.253PC-0.088APC
藻胆蛋白(w,%)=PC%+APC%+PE%
叶绿素a、类胡萝卜素含量测定参照马增岭[13]的方法。
叶绿素a含量:Ca (μg·mL-1)=16.29×OD665-8.54×OD652
类胡萝卜素含量:C (μg·mL-1)=7.6×(OD480-1.49×OD510)。
1.2.5 干旱胁迫下Rubisco和GAPDH活性测定采用苏州科铭生物技术有限公司对Rubisco活性进行测定。在340 nm吸光度的变化可计算还原型辅酶Ⅰ氧化速率,还原型辅酶Ⅰ氧化速率可反映Rubisco的活性。25 ℃中1 mg蛋白1 min氧化1 nmol NADH,按样本蛋白浓度计算Rubisco活性。
GAPDH活性测定采用苏州科铭生物技术有限公司试剂盒。通过分光光度计测定340 nm处NADPH减少量计算GAPDH活性,每mg组织蛋白每分钟消耗1 nmol的NADH定义为一个酶活力单位。
1.3 数据处理
所得实验数据用SPSS Statistics 26.0、Origin和Excel进行方差分析检验结果的差异显著性并作图。
2 结果与分析
2.1 测序数据质量评价
样本测序数据中,每个样本的错误率≤0.03%,测序碱基质量值大于20的碱基占总体碱基的百分比在97%以上、大于30的碱基在93%以上。GC含量占总碱基的45%左右。测序数据具有较高的准确性。对发菜4个的不同样本进行相关性检测,样本间的相关系数均大于0.88,表明测序数据可靠、样本间重复性良好且变异不大。
2.2 干旱胁迫下发菜光合作用相关基因的差异表达
对发菜干旱胁迫下所有差异表达基因通过KEGG pathway显著性富集进行分析,选择显著富集到光合作用途径的相关基因(P<0.05),包含113个差异基因(表2)。以失水率0%(A)为对照,失水率30%(B)发菜光合作用的差异基因共有44个,失水率75%(C)发菜光合作用的差异表达基因共有74个,失水率100%(D)发菜光合作用差异表达基因共有91个。B、C和D均有显著差异基因的个数为31个(图1)。进一步分析表明,B样上调基因为8个,占光合作用总差异基因18.2%,下调基因为36个,占光合作用总差异基因81.2%;C样上调基因为21个,占光合作用总差异基因28.4%,下调基因为53个,占光合作用总差异基因71.6%;D样上调基因为46个,占光合作用总差异基因50.5%,下调基因为45个,占光合作用总差异基因49.5%。
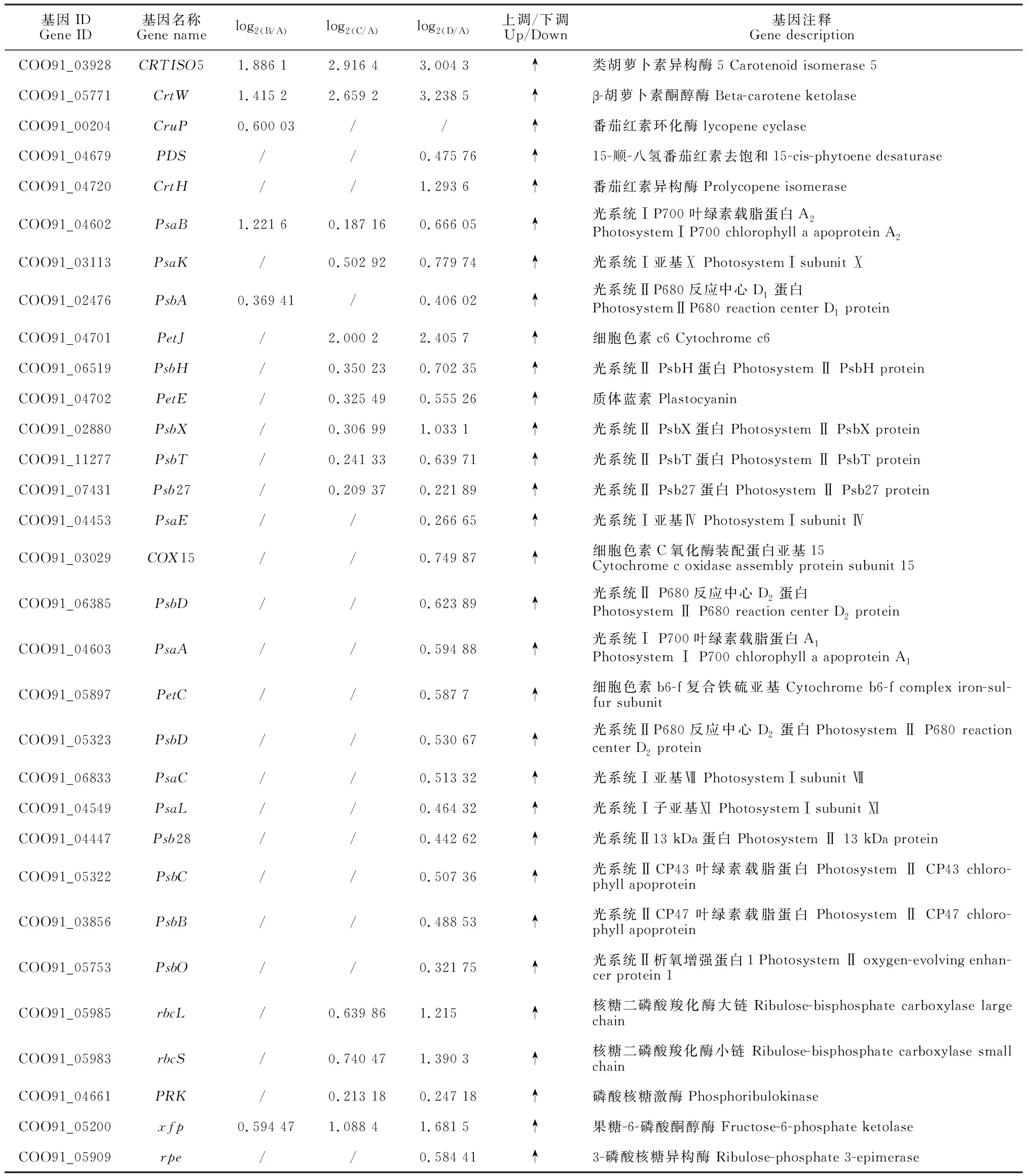
表2 不同发菜样品参与光合作用相关的差异表达基因
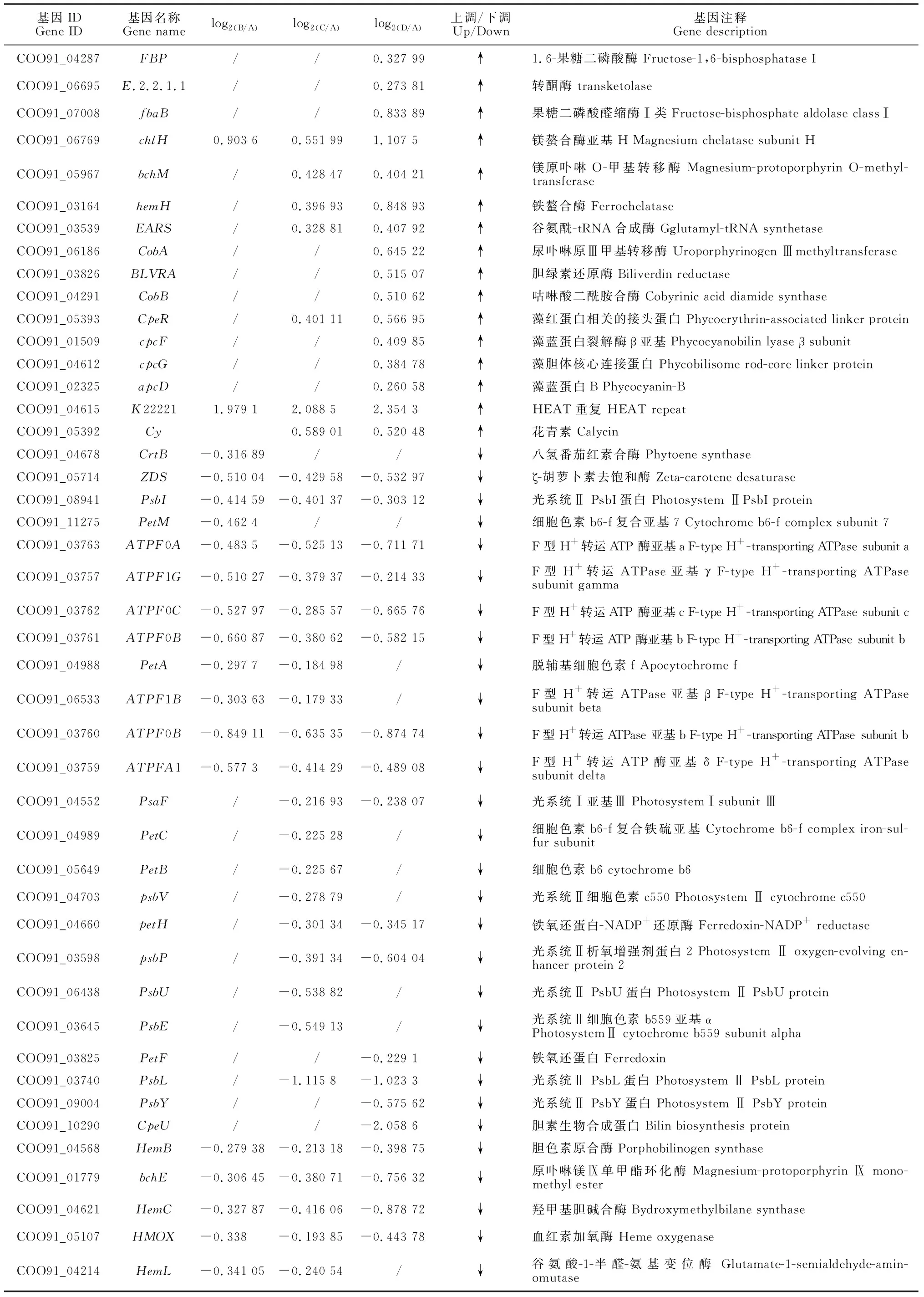
续表2 Continued Table 2
续表2 Continued Table 2
2.3 干旱胁迫下发菜光合作用相关差异基因的qRT-PCR分析
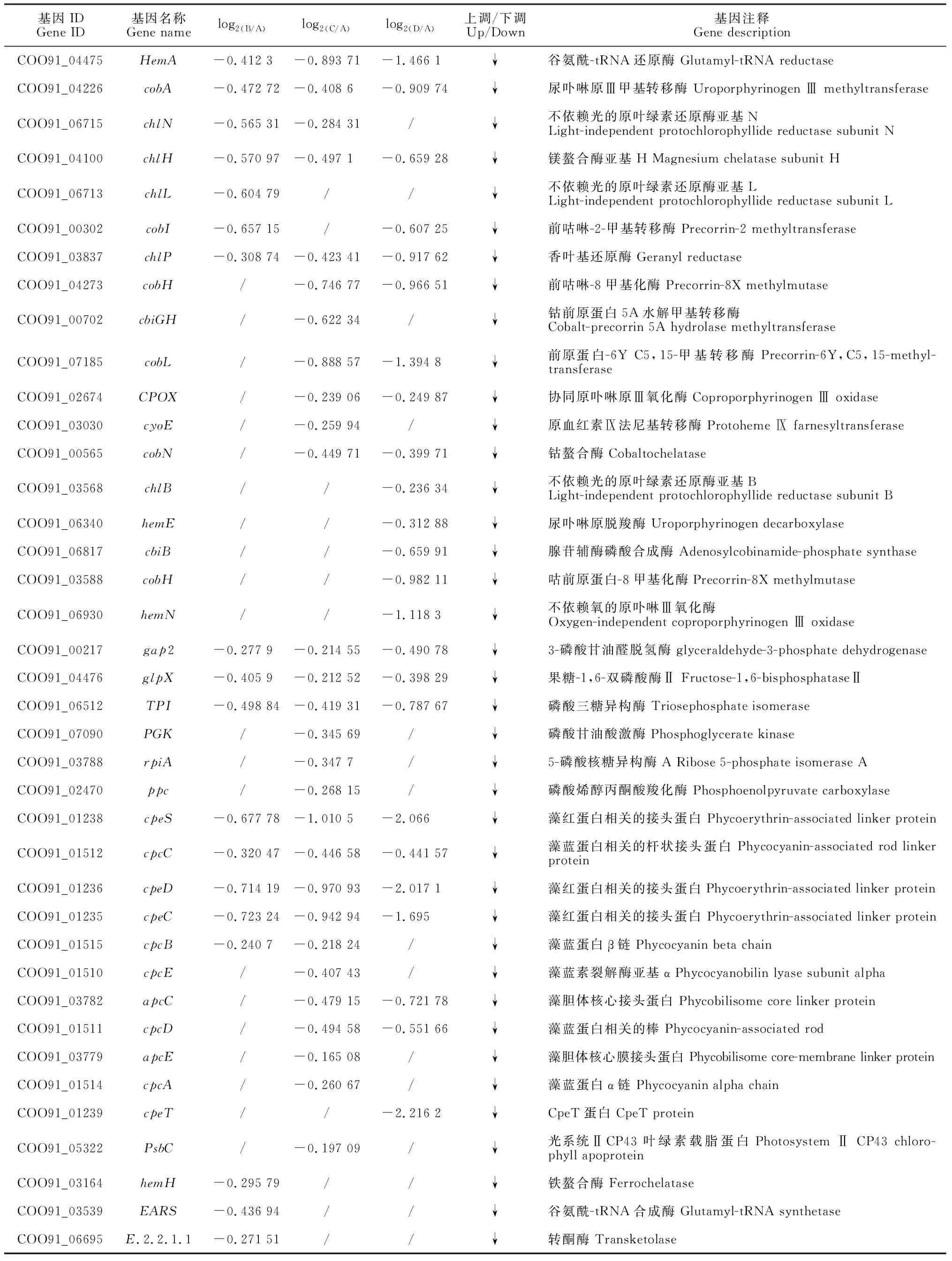
对干旱胁迫下发菜12个光合相关基因进行qRT-PCR分析。结果表明,随着干旱胁迫程度的加深,Psb27、gap2、PsbL、PetE、PsbX、ZDS和PetJ先下降然后上升最后又下降,且都在失水率为75%时表达量最高。PsaK、CrtW、CRTISO5、PetH和PsaB呈现出先上升后下降的趋势,且PsaK、CrtW、CRTISO5基因在失水率为75%时表达量最高,而PetH和PsaB基因在失水率为30%时表达量最高。实时荧光定量反应的结果与RNA-seq数据基本一致,从而证实了发菜干旱胁迫下这些基因的表达模式(图2)。

A. 失水率为0%的样品;B. 失水率为30%的样品;C. 失水率为75%的样品;D. 失水率为100%的样品;vs. 比较;下同图1 干旱胁迫下发菜光合作用相关差异表达基因A. Water loss 0%; B. Water loss 30%; C. Water loss 75%; D. Water loss 100%; vs. Control; the same as belowFig.1 Differential expression genes related to photosynthesis of N. flagelliforme under drought stress
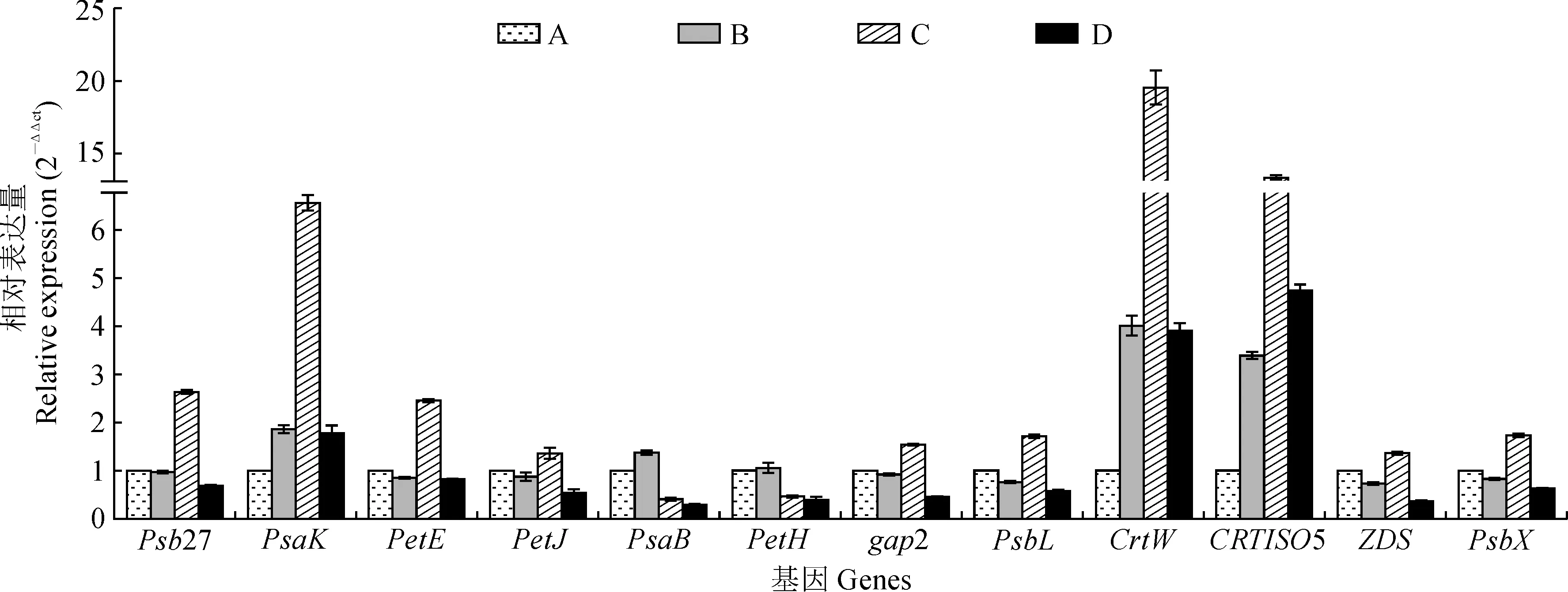
图2 不同干旱胁迫下发菜光合相关基因的qRT-PCR分析Fig.2 Analysis of qRT-PCR data of photosynthesis-related genes from N. flagelliforme under drought stress
2.4 干旱胁迫下发菜光合色素含量及相关酶活性分析
发菜藻蓝素、异藻蓝素、藻红素和藻胆素随着干旱胁迫的加强,其含量呈显著降低的趋势。藻蓝素、异藻蓝素、藻红素和藻胆素含量在失水率为0%时与30%、75%和100%时呈现显著差异,但在失水率为30%、75%和100%时,相互之间没有显著性差异(图3)。
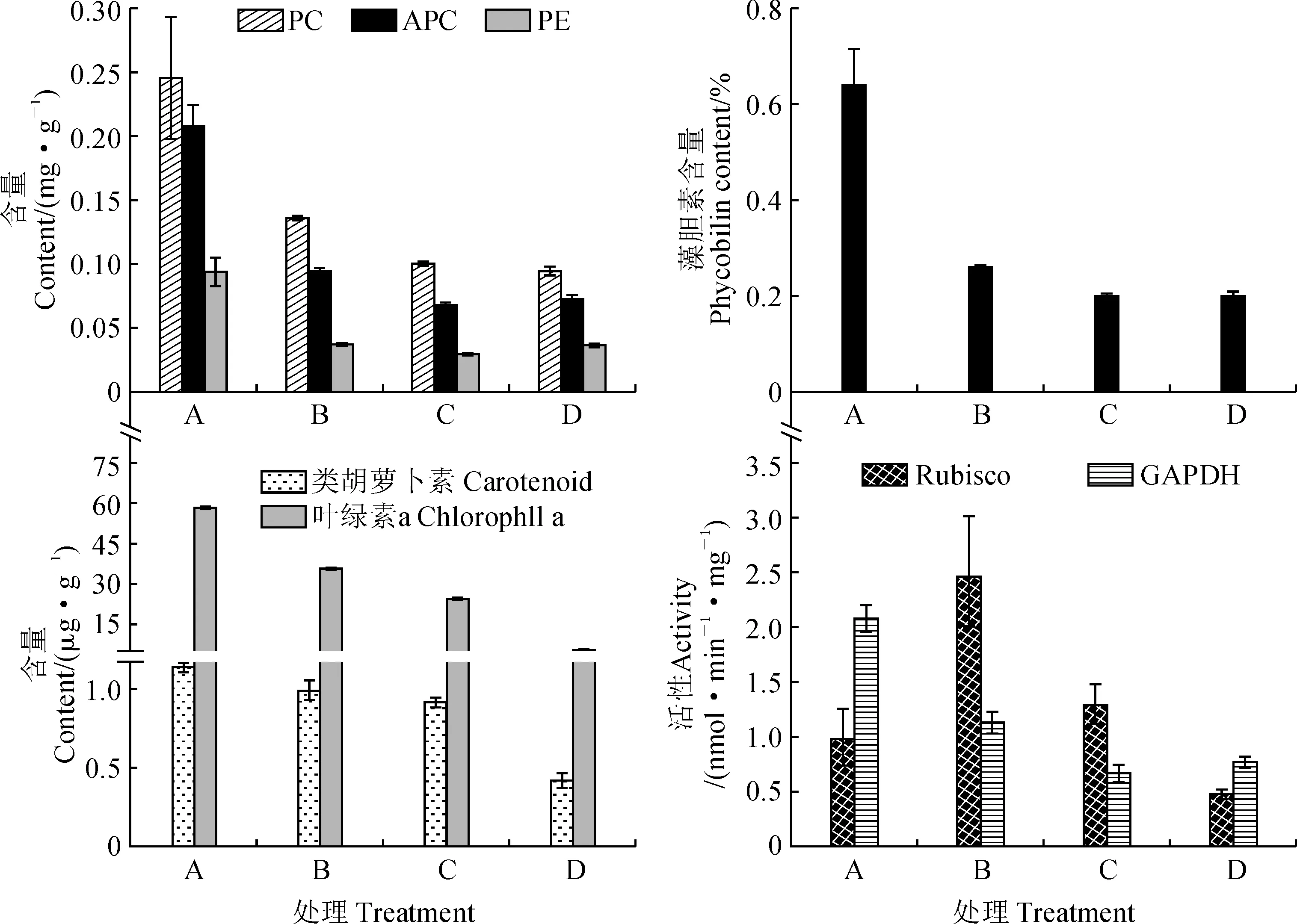
PC.藻蓝素;APC.异藻蓝素;PE.藻红素图3 干旱胁迫下发菜色素含量和酶活性检测PC. Phycocyanin; APC. Allophycocyanin; PE. PhycoerythrinFig.3 Detection of pigment contents and enzyme activities of N. flagelliforme under drought stress
发菜叶绿素a和类胡萝卜素含量随干旱胁迫的增加呈显著下降趋势。失水率为0%时与30%、75%和100%时叶绿素a和类胡萝卜素含量呈现显著差异,但类胡萝卜素含量分别在失水率为0%和30%时及30%和75%时没有显著性差异(图3)。
Rubisco活性随着干旱胁迫的增加呈现先上升后下降的趋势(图3),且失水率为30%的时候Rubisco活性达到最大值,但在失水率为0%、75%和100%时相互之间没有显著性差异。随着干旱胁迫的增加,GAPDH的活性逐渐下降,失水率为0%时与30%、75%和100%时GAPDH的活性差异显著,但在失水率为75%和100%时没有显著性差异(图3)。
3 讨 论
3.1 干旱胁迫对发菜光合色素及相关基因差异表达的影响
光合色素包括叶绿素、反应中心色素和辅助色素等,存在于类囊体膜上,主要参与光能吸收、传递,以及原初光化学反应等过程。与高等植物相比,蓝藻有其特殊的光捕获系统,主要由藻胆体(PBSs)组成,而藻胆体由藻胆蛋白和接头多肽组成。藻胆体主要分为藻蓝素(PC)、异藻蓝素(APC)和藻红素(PE)。PE吸收的光能先迁移到PC,然后转移到APC,最后转移到叶绿素a[14]。本研究发现12个参与光合作用的捕光色素复合体基因显著下调表达,而且随着干旱胁迫的持续增加,发菜藻蓝素、藻红素和异藻蓝素含量有所下降,即藻胆素含量总体下降,同时叶绿素a的含量明显降低。因此,推测干旱胁迫致使大部分发菜光合作用捕光色素复合体基因下调表达,光合色素蛋白减少,捕获光能的能力减弱,光合作用受到抑制,从而降低发菜在干旱胁迫条件下光合系统遭受破坏的风险,这也是发菜适应干旱胁迫的一种光保护调节机制。
类胡萝卜素具有捕获光能并将其传递给叶绿素的功能[15]。由于干旱胁迫会导致水稻叶片中水分缺失,细胞膜被破坏或消失,类囊体膜出现解体,使得叶绿素和类胡萝卜素含量降低,进而影响光合作用的进行[16],而本研究发现发菜叶绿素a和类胡萝卜素含量随干旱胁迫的增加呈显著下降趋势,暗示干旱胁迫会使发菜叶绿素a和类胡萝卜素合成相关蛋白(酶)的基因差异表达,进而导致其含量下降而影响光合作用。目前已经确认,ZDS、crtW和CRTISO基因参与类胡萝卜素生物合成和分解代谢途径。ZDS是类胡萝卜素生物合成途径上游控制β-胡萝卜素生成的关键酶,它催化9,9-双顺-β-胡萝卜素脱氢生成7,9,7,9-四顺式-番茄红素[17],该酶的活性和表达量的多少直接决定了β-胡萝卜素的产量,是调控β-胡萝卜素合成量的关键酶。crtW基因编码crtW型β-胡萝卜素酮醇酶,β-类胡萝卜素经β-胡萝卜素酮醇酶催化形成角黄素[18]。CRTISO是催化番茄红素由顺式结构转变为反式结构的关键异构酶[19],CRTISO的下调表达使果实中β-胡萝卜素的含量提高[20],而且CRTISO表达量的降低抑制了类胡萝卜素降解反应的进行,还可能会导致烟草中类胡萝卜素的积累[21]。在本研究中,随着干旱胁迫的增加,ZDS基因显著下调,crtW和CRTISO5基因显著上调,说明这些基因抑制了干旱胁迫下发菜类胡萝卜素的增加,导致类胡萝卜素捕获光能并将其传递给叶绿素的功能减弱,进而影响光合速率。
3.2 干旱胁迫对发菜光反应与卡尔文循环相关基因差异表达的影响
PsaK和PsaB是光系统I中重要的核心蛋白,且在PSⅠ捕光复合物中起重要作用[22-23]。JIA等[24]发现在盐碱胁迫下,海棠中PsaK等6种与光合作用相关的蛋白显著上调,且这些蛋白可以作为PS Ⅰ修复系统的调节剂。而在镉胁迫下,由于烟草中PsaK和PsaB显著下调而使PSⅠ系统受到严重的光抑制作用[25]。PetE和PetJ是光合作用中电子传递链重要的组成成分,有助于提高光反应的电子传递效率[26]。有研究发现虽然PetE基因失活没有影响藻细胞的生长速率,但影响了光合电子传递链的氧化还原状态[27]。Psb27蛋白是PSⅡ重要的组装修复因子之一,它位于PSⅡ核心复合体的囊腔侧,可使Mn与PSⅡ放氧复合体OEC更容易结合[28]。在低温、高光或干旱等胁迫条件下,对维持PSⅡ的高效组装修复起着重要作用。本研究发现,干旱胁迫下发菜PsaK、PsaB、PetE、PetJ和Psb27均呈上调表达,表明干旱胁迫诱导了这些基因的表达,有利于稳定PSⅡ和PSI的结构以免受到干旱胁迫的破坏,且修复受损的PSⅠ和PSⅡ,稳定光合电子传递链的氧化还原状态,为发菜恢复吸水后快速进入光合作用奠定了结构基础。PsbL参与了PSⅡ中电子转移的调节,在PSⅡ电子转移过程中具有重要作用[29]。另外,PetH是光合电子传递链上的催化酶,可以将电子从PSⅠ传递到NADP+,产生的NADP会参与到CO2的同化,PetH酶活性的降低会影响CO2的同化过程,进而影响植物的光合反应[30]。有研究发现高浓度锌胁迫下,PetH基因显著上调,从而维持了正常的电子传递效率[31]。但本研究发现随着干旱胁迫的增加,PsbL和PetH却显著下调表达。由于发菜在持续失水状态下水分的亏缺会导致光合活性下降[32],推测PetH和PsbL基因显著下调抑制了光合电子传递链的活性,导致光合活性维持在较低水平甚至光合作用停止,这与QIU等[33]的结论一致。
干旱胁迫除了对发菜光反应过程有影响外,对其暗反应过程也产生了影响。Rubisco作为卡尔文循环的关键酶之一,可催化卡尔文循环中RUBP与CO2形成两分子3-磷酸甘油酸(3-PG)[34]。在3-磷酸甘油醛脱氢酶(GAPDH)的催化下三磷酸甘油酸被还原为了三磷酸甘油醛,它不仅是合成核酮糖-5-磷酸的底物,也是光合产物输出的一种途径,GAPDH活性水平与卡尔文循环的运转速率有关[35]。有研究表明,逆境胁迫引起的Rubisco活性下降,并降低核酮糖-1,5-二磷酸和3-磷酸甘油的含量,从而抑制无机磷的再生,进而影响光合作用[36]。此外,Sen等[37]发现随着干旱胁迫的增加,鱼腥藻PCC 7120的Rubisco酶活性下降,从而导致光合活性降低。本研究表明,随着干旱胁迫的增加,GAPDH的活性呈现下降的趋势,Rubisco活性升高后下降,表明随着干旱胁迫的增加,这两种酶活性的下降可能导致光合碳同化效率的降低,进而影响发菜的光合活性。
综上所述,干旱胁迫下发菜有113个光合作用相关基因发生了差异表达,干旱胁迫诱导部分光合相关基因上调表达,而另一些基因下调表达,共同调控发菜响应干旱胁迫,这可能是发菜应对干旱不利环境的一种光保护和光适应机制。研究结果为深入认识发菜耐旱的光合机理奠定了基础,为后续发菜抗性基因的挖掘、筛选以及研究发菜干旱胁迫响应机制提供了重要的参考价值。

