不对称有机催化:化繁为简助力药物研发
——2021年诺贝尔化学奖
李媛媛 冯琦琦 张筱宜 王玉记 赵 明
(首都医科大学药学院药物化学系 内源式预防药物教育部工程研究中心 多肽及小分子药物北京市重点实验室 北京生物医用材料实验室和天然高分子生物医用材料重点实验室, 北京100069)
2021年10月6日,瑞典皇家科学院宣布,将2021年诺贝尔化学奖授予德国化学家本杰明·利斯特(Benjamin List)和美国化学家大卫·W·C·麦克米兰(David W.C. MacMillan),以表彰他们在开发“不对称有机催化”研究中做出的突出贡献。瑞典皇家科学院在官网颁奖声明[1]中写道:“构建分子是一门困难的艺术。Benjamin List和David W.C. MacMillan因开发了一种精确的分子构建新工具——“有机催化”,而被授予2021年诺贝尔化学奖。这对药物研究产生了巨大的影响,使化学和药物合成更环保。”
在化学反应中,催化剂具有重要地位,它们能够改变化学反应的速率。人体中最常见的催化剂是酶,推动着生命必需的化学反应。很多的蛋白酶可以催化生成具有一种手性构型的化合物,这种单一手性的形成在生命体中有着重要意义,例如未分离出不同构型的“沙利度胺”,以外消旋体上市,最终导致了上万例海豹畸婴儿的出生。生命体内这种“不对称催化”的能力也促使科学家寻找和设计能够进行不对称催化的催化剂。20世纪60年代,化学家威廉·诺尔斯(William S.Knowles)、野依良治(Ryoji Noyori)和巴里·夏普莱斯(K.Barry Sharpless)使用金属催化剂成功实现了不对称催化,他们也因此在2001年获得了诺贝尔化学奖。这一突破广泛应用于治疗帕金森病的左旋多巴(L-DOPA)的工业化规模生产。
催化剂虽然是化学家常用的基本工具,但长期以来只有金属和酶供化学家使用,其中能够实现不对称催化的催化剂更为稀少。Benjamin List和David W.C.MacMillan在2000年各自独立开发了第三类催化剂,建立在有机小分子基础上的“不对称有机催化剂”,它们驱动的反应就是“不对称催化反应”,通过这些反应可以有效合成多种分子,包括新药物分子、在太阳能电池中捕获光能的分子等,在扩充催化剂种类的基础上,更是推动了不对称有机催化方法的迅猛发展。本文介绍2021年度诺贝尔化学奖获奖科学家及其成就,以及不对称有机催化对化学、药学等事业的影响。
1 获奖者简介
1.1 本杰明·利斯特(Benjamin List)
Benjamin List(图1),德国有机化学家,德国马普学会煤化所教授。现任马克斯普朗克学会科学会员、科隆大学名誉教授。1968年出生于德国法兰克福,1997年于法兰克福大学获得博士学位,之后在美国Scripps 研究所做博士后研究,并留所任助理教授。2003年入职马克思·普朗克煤炭研究所并任职至今,现任该研究所常务董事兼均相催化系主任。

图1 Benjamin List[2]
Benjamin List主要从事有机催化与合成,是不对称有机催化领域的开创者之一,发展了一种新型不对称催化模式:手性配对阴离子催化(asymmetric counteranion-directed catalysis, ACDC)。目前已发表SCI论文200余篇。近年来获得的主要荣誉有 Otto-Bayer- Prize(2012)、Horst-Pracejus-Prize (2013)、 Mukaiyama Award (2013)、 Arthur C. Cope Scholar Award (2014)、 Gottfried Wilhelm Leibniz-Prize(2016)等。2018年,当选为德国国家科学院(the German Academy of Sciences Leopoldina)院士。Benjamin List教授目前担任Synlett杂志主编,还在NatureCommunications,Synfacts等杂志担任编委。
1.2 大卫·W·C麦克米兰(David W.C. MacMillan)
David W.C.MacMillan(图2),美国有机化学家。1968年出生于英国苏格兰,1990年在加州大学欧文分校师从拉里·奥弗曼(Larry Overman)教授做博士研究,专注于开发形成立体控制双环四氢呋喃的新反应方法。1996年获得博士学位,同年在哈佛大学做博士后研究,1998年在加州大学伯克利分校开始独立研究,2000年在加州理工学院化学系任教,2006年至今担任普林斯顿大学教授,2010年到2015年期间担任普林斯顿化学系系主任。

图2 David W.C. MacMillan[3]
David W.C.MacMillan的课题组一直从事不对称催化、反应方法学以及天然产物全合成的研究,尤其在有机小分子催化、光催化和氧化还原催化方面颇有建树,多次在Nature、Science、JACS等杂志发表高水平文章。MacMillan所获奖项众多,其中包括2017 年的 Ryoji Noyori奖,2015 年获得的Harrison Howe奖,2004 年获得皇家化学研究所 Corday-Morgan奖章。他是英国皇家学会 (FRS)、美国艺术与科学院和美国国家科学院的三院院士。
2 主要科研贡献
2.1 有机小分子催化剂的崛起
19世纪,当化学家开始探索不同化学物质是如何发生反应时,他们有了一些奇异的发现。例如,如果他们将银放入装有过氧化氢(H2O2)的烧杯中,过氧化氢会突然开始分解为水(H2O)和氧气(O2),但触发这一过程的银似乎完全没有受到影响。所以,科学家将在化学反应中能够改变反应物的化学反应速率而不改变化学平衡,且自身的质量和化学性质在化学反应前后都没有发生改变的物质叫做催化剂。
在 21 世纪之前,化学家发现的所有催化剂都分属于两大类,金属和酶。金属通常是很好的催化剂,因为金属的原子核外有未被电子完全占据的空轨道,可以在化学过程中暂时容纳电子,或将电子提供给其他分子。这有助于“松弛”分子中原子之间的键,原本很牢固的化学键可能被轻松破坏,并形成新的化学键。1835年,著名的瑞典化学家雅各布·贝采利乌斯(Jacob Berzelius)发现了其中的规律。在一次瑞典皇家科学院(Royal Swedish Academy of Sciences)的年度报告中,他提出了一种可以“产生化学活性”的新型“力”。他举出一些例子,在这些实例中,一种物质只要“到场”,就能开启化学反应,说明这似乎是一种比此前想象中要普遍得多的现象。他认为该物质具有催化力(catalytic force),并称这种现象本身为催化作用(catalysis)。第二大类的催化剂由酶构成。所有的生物体内都有成千上万种不同的酶,以驱动生命所必需的化学反应。许多酶都可以完成不对称催化。由于酶作为催化剂,高效而精准,20 世纪 90 年代的研究人员试图开发新的酶变体,来驱动人类所需的化学反应。其中一个团队是来自美国加利福尼亚州南部的斯克里普斯研究所,由已故的卡洛斯·F·巴尔巴斯(Carlos F. Barbas III)领导,Benjamin List在读博士后时,就是Carlos F. Barbas III团队中的一员。
在现今的化学反应中,加入催化剂是使反应顺利进行的有效手段,催化剂与反应底物的相互作用可以帮助反应克服固有能垒,从而降低反应所需的条件,使苛刻的反应条件变得温和,使低效的反应变得高效,同时催化剂不会成为最终产品的一部分。
有机催化是继金属和酶之后的第三种催化方法。Benjamin List和David W.C. MacMillan研究的“不对称有机催化”,成功建立了手性有机小分子的合成方法,极大方便了药物、塑料、香精和香水等人类必须品的制造。
有机小分子由碳的骨架组成。当一个碳原子连接4个不同基团时,这个碳称为手性碳(chiral carbon,图3),并且具有一对两个化合物,S构型和R构型,互为镜像,彼此称为对映体(enantiomer)。这两个化合物就像人们的左右手一样,相对可以重合,但是彼此不能重叠(图4),其中可使偏振光向左旋转的称为“左旋异构体”,反之是“右旋异构体”。如果混合两者,可使偏振光互相抵消,所以混合物称为外消旋体。
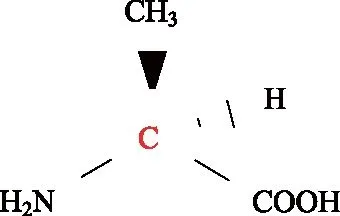
图3 L-丙氨酸

图4 左右手镜像
药物合成中常常遇到这样的情况,一步反应同时得到一对对映体两个化合物,它们彼此互为镜像,不能重叠,普通方法无法分开。这两个化合物如果其中一个的生物活性对人类有益,而另一个有害,制备中必须除去有害的那一个。1953年瑞士诺华制药厂前身CIBA药厂在开发抗生素时合成了沙利度胺(图5),它没有抗菌作用,但可缓解孕妇6~8周的呕吐。然而1960年欧洲新生儿没有臂和腿的比例异常升高,1961年《柳叶刀》中提出造成上万名“海豹儿”的凶手就是沙利度胺[4],这就是著名的“反应停”事件。沙利度胺就是药物合成时的一对对映体,其中右旋异构体可镇静止吐,而左旋异构体就是致畸的元凶。
图5 沙利度胺
“不对称有机催化”可在合成时,诱导其中有益的一个对映体含量增加,使不需要的另一个对映体含量降低至最少,极大提高了合成效率。利用这样的反应,可以有效合成药物,乃至在太阳能电池上获得光能量的分子。诺贝尔化学委员会主席Johan Qvist认为,“这个催化概念简单又巧妙,但很多人都想知道为什么我们没有早点想到。”
相较于在19世纪就被科学家发现的金属和酶这两类价格昂贵又不易保存的催化剂,化学反应中最常见的有机小分子作为催化剂有着更明显的优势。1968-1997年间,有机小分子不对称催化才有个别报道,且仅作为限定的化学反应,没有形成概念性的指引。
到2000年,两篇关于不对称有机催化的文章将这一领域推到了化学家的视野中。由 Benjamin等[5]报道的首例由有机小分子脯氨酸经由烯胺中间体介导的不对称Aldol反应,以小分子模拟酶催化的转化历程(图6)。
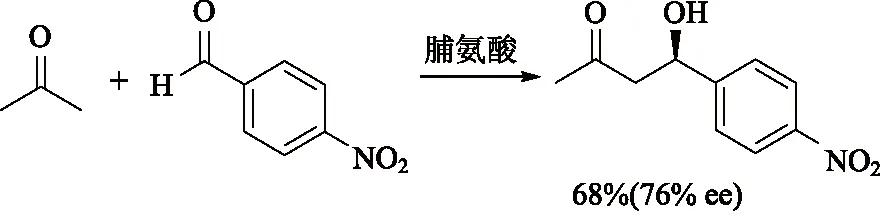
图6 脯氨酸作为催化剂参与的不对称Aldol反应
Benjamin List在做博士后的时候,想到蛋白酶虽然由上百个氨基酸组成,但真正起到催化作用的只是其中的一个或几个氨基酸,这几个氨基酸是否只能在蛋白酶中起效?其他具有类似结构的简单分子是不是也有可能具有催化活性?他在实验中发现,使用脯氨酸能够有效地进行不对称催化反应。与金属和蛋白酶相比,脯氨酸分子结构简单、成本低而且对环境友好,是化学家们较为追捧的试剂类型。
同时,David W.C.MacMillan 将目光放在了简单的有机分子结构上。David W.C.MacMillan利用他的化学知识构建了多种有机分子[6],希望可以找到适用于工业生产的催化剂,并且用实验证明了它们能够高效地进行不对称催化,他将这种催化反应命名为“有机催化”(organocatalysis),指出这是一种新的有机催化策略,它有望将来用于一系列不对称催化。他首次从概念上阐明“有机催化”可通过碳原子经济且环境友好性的途径完成反应。
Benjamin List 和 David W.C. MacMillan各自独立地发现了一个全新的催化概念。自 2000 年以来,该领域的发展日新月异,这两人也一直保持领先地位,他们设计了大量廉价且稳定的有机催化剂,可用于驱动各种各样的化学反应,适用于药物等制备。
2.2 有机小分子催化剂的优势
有机小分子一般对水和氧气不敏感,无论是使用、储存还是放大反应的技术难度都比较低,其催化机理有较大的普适性,在探索合成方法时具有较高的可预测性;有机小分子催化剂的核心骨架一般源于天然的生源途径,衍生应用的成本较金属催化剂和酶更低,可快速大量地构建催化剂库;有机小分子一般毒性较低,拥有与生俱来的环境友好属性,绿色环保且成本较低,能够满足化学家们的实验需求以及工业合成的预算需求。
2.3 不对称有机催化的迅速发展
不对称有机催化自2000年被化学家们大量关注之后,人们逐步投入到对通用催化模式的探索,其中包括对基于二级胺的“Enamine”及“Iminium”催化体系的充实完善,借助烯胺可实现醛、酮α-位的一系列不对称官能团化,并以产物的羰基作为“reaction relay”实现手性骨架信息的传导,扮演关键的化学合成子参与到更为复杂分子的搭建中;借助亚胺离子可实现不饱和醛化合物β-位点的不对称修饰,包括杂原子手性中心的构建以及环化修饰,而在后续的发展中也逐步实现更远距离位点的不对称修饰。目前围绕 “胺”的催化,仍然是整个有机小分子不对称催化领域最具规模且最成体系的分支,至今仍有优秀成果产出,其中也包括作为奠基者及拓展者的David W.C.MacMillan所提出的基于单电子转移的 “SOMO catalysis” 策略[7]。
根据上文提到的二级胺催化体系,脯氨酸并不仅仅扮演二级胺的Lewis base催化功能,侧链的羧酸同时起到Brønsted acid的活化作用,在后来的探索中就形成了围绕手性质子酸的另一个完善的有机小分子催化体系,包括2004年由Takahiko Akiyama利用手性磷酸实现的Mannich-Type反应[8],由Masahiro Terada实现呋喃的Aza-Friedel-Crafts烷基化[9]。这两篇文章一般被认为是手性质子酸催化的开篇之作。
Benjamin List在这一领域也有着重要的贡献,除了进一步拓宽经典手性磷酸的普适性之外,还提出了“手性配对阴离子催化”的概念,开发了质子酸性更强的手性有机酸分子库,不断提高了该机制下的活化阈值上限[10-11]。
3 科学意义
3.1 打破固有的思维模式,提高科研创新能力
几十年前在提起催化剂的时候,人们可以列举出昂贵的稀有金属,也能够想到生命体内看不见摸不到的蛋白酶,但是没有人去坚定地探索这些在化学合成中最常见的有机小分子是否也会达到这种神奇的效果。难以更早地提出这种简单、绿色和廉价的不对称催化概念,或许是因为被“只有金属或酶这一类稀有的物质才能驱动化学反应”的想法限制住了。Benjamin List和David W.C. MacMillan成功地打破了这些固有的思维模式,找到了化学家数十年来一直在努力寻找的巧妙方案。因此,有机催化剂现在正在为人类带来更大的好处。
能够降低反应能垒的物质是否就一定像它强大的功能那样罕见?蛋白酶中的催化结构域也不过是由氨基酸残基围成的空腔,同样可以起到意想不到的效果。这也提示科研工作者,科学研究不仅要有深度,也要考虑广度,才能将思维打开,收获更多的成果。
3.2 合成含有手性的潜药分子,为药物化学提供理论支撑
合成化学作为自然界内源的转化准则之一,在人类文明前进的历程中始终扮演重要的角色,调控且助力于生命健康、工业化技术等方面的革新。
从药物创新的角度而言,核心逻辑在于靶点、作用机制及药物骨架的推陈出新,合成化学家在这一领域辛苦钻研,一方面解析活性天然产物分子的合成途径及方法,一方面结合药物化学及生物学推导官能团的修饰、改造及拼接。
围绕新颖的催化机制,结合催化剂骨架设计改造,化学家探索固有合成模式的延展空间,推导含不同杂原子手性中心的合成方法,并以此为创新能力的索引及支撑,有的放矢地对潜药分子骨架进行特异性修饰,建立起结构多样的潜药分子库,为药物化学的发展提供更加庞大的理论支撑。
3.3 为创新药研发提供绿色、高效和安全的合成工艺
在构建分子时,经常会出现可以形成两种不同的分子的情况,就像人们的手一样,彼此都是对方的镜像。尤其是在生产药品时,化学家往往只想要其中一个。不对称有机催化将分子合成带到了一个全新的水平,它不仅使化学变得更加绿色,还使生产手性分子变得更加容易。
有机催化剂能够连续催化多步化学反应,这可以大幅度减少化合物的合成步骤。以非常复杂的天然分子番木鳖碱为例,在1952年首次合成时,它需要29步不同的化学反应,最终只有0.000 9%的原料能够生成番木鳖碱。到了2011年,小分子催化的不对称Michael加成反应,仅需12步便得到最终的产物,生产效率提高了7 000倍。在药物生产方面,有机催化让研究人员更为简便地生产具有治疗效果的手性分子,避免生产结构镜像对称的分子,它们不但降低生产效率,还可能造成不良反应或者增加患者的代谢负担。大量生物医药公司也已经在使用这一技术简化药物的生产流程,其中包括用于治疗焦虑和抑郁症的帕罗西汀,以及治疗呼吸道感染的抗病毒药物奥司他韦。
自21世纪初起,催化剂在化工、医药等领域的应用有着飞速的发展。为了满足不同药物分子的合成工艺,使用金属、生物酶、有机小分子的催化方法在各合成环节中发挥所长,为全球病患带来了各种创新药物。

