材料处理与切片方法对柑桔叶脉荧光显微观察的影响
牛 英,刘冰浩,范七君,陈传武,娄兵海,蒋海兰
(广西柑桔育种与栽培工程技术研究中心/广西特色作物研究院,广西桂林,541004)
细胞是构成植物体的基本单位,也是植物体生命活动的基本单位,来源相同、结构相似、功能相同、彼此密切联系的细胞群构成功能组织[1]。植物组织细胞形态随植物种类[2-4]、生长环境[5-7]、逆境胁迫[8-10]等不同而异,因此植物组织细胞形态学观察是植物系统分类、遗传演化、抗逆反应等的主要研究方法之一。自然界中荧光现象极为普遍,许多物质被短波谱线照射后发出荧光,这种现象称为物质的自发荧光现象;还有一些物质只有和某种荧光物质结合后才能激发出荧光,这种现象称为物质的诱发荧光现象[11]。荧光显微技术是利用特定波长的光照射被检物体产生荧光进行检测的显微光学观测技术。不同组织细胞理化性质不同,在不同波长的照射下会产生不同颜色或不同强弱的荧光,使用荧光显微镜可以观察到植物组织、细胞在普通光学显微镜下无法呈现的一些特征,有助于更有效地进行观察和鉴别[12-13]。
用于显微观察的切片方法一般为石蜡切片、冷冻切片和徒手切片3种。石蜡切片是显微观察的常规方法,但切片前的脱水、透明、渗蜡、包埋等处理过程复杂冗长[14-15]。冷冻切片不需要脱水、透明等步骤,具有快速、简便、环保、易操作的特点[16-17]。与石蜡切片和冷冻切片相比,徒手切片显微效果较差,但操作更为简单,且不需要切片机等贵重仪器,可以很大程度上降低试验条件,提高工作效率,减少工作量[18-19]。用于显微观察的植物材料一般为新鲜材料和固定材料两种,新鲜材料多用于徒手切片和冷冻切片;固定材料多用于石蜡切片,部分研究中也用于冷冻切片[20-21]。但不同的材料处理和切片方法是否对植物组织细胞的荧光显微观察产生影响尚未见系统报道。
因此,本研究以柑桔叶脉为材料,观察、比较新鲜材料和FAA固定液固定材料在徒手切片和冷冻切片条件下,组织细胞自发荧光和诱发荧光(苯胺蓝染色)的显微观察特点,为柑桔及相似物种的组织细胞形态学荧光显微观察提供技术支持。
1 材料与方法
1.1 新鲜材料徒手切片荧光显微观察取当年生沙糖桔成熟叶片主脉中段0.5 mm左右,用双面剃须刀片横切成若干薄片,分别用3种方法进行荧光显微观察:(1)直接观察,(2)用水浸润后观察;(3)0.1%苯胺蓝染液染色5 min左右后观察。
0.1%苯胺蓝染液:称取苯胺蓝0.1g溶于100 mL 0.1 mol/L K3PO4溶液中,装入棕色试剂瓶避光冷藏保存,下同。
荧光显微观察参数:显微镜(BX51,Olympus),汞灯电源(BH2-RFL-T3,Olympus),100 W高压汞灯(USHIO USH-102D,Olympus),数码摄像头(DP70,Olympus),图像采集软件(Cellsens standard,Olympus),紫外滤光片(NU,Olympus),下同。
1.2 固定材料徒手切片荧光显微观察取当年生沙糖桔成熟叶片主脉中段0.5 mm左右,用FAA固定液固定。固定好的材料,分别用50%乙醇、30%乙醇和蒸馏水各润洗1次,每次30 min。处理好的材料用双面剃须刀片横切成若干薄片,切好的薄片分别用4种方法进行荧光显微观察:(1)直接观察;(2)0.1 mol/L K3PO4或1 mol/L NaOH浸润5 min左右后观察;(3)0.1%苯胺蓝染液染色5 min左右后观察;(4)10% Na2SO3沸水浴20 min软化后,用0.1%苯胺蓝染液染色5 min左右后观察。
1.3 新鲜材料冷冻切片荧光显微观察取当年生沙糖桔成熟叶片主脉中段0.5 mm左右,用徕卡CM1950冷冻切片机进行切片。得力液体胶为冷冻包埋剂,冷冻温度为-11~-13 ℃,把材料包埋于自制的方形包埋盒内0.5~2 h,待冷冻包埋剂充分凝固后开始切片,切片厚度6 μm,于载玻片上用水展片,晾干。晾干后的切片分别用2种方法进行荧光显微观察:(1)直接观察;(2)0.1%苯胺蓝染液染色1 min左右后观察。
1.4 固定材料冷冻切片荧光显微观察
取当年生沙糖桔成熟叶片主脉中段0.5 mm左右,用FAA固定液固定。固定好的材料,分别用50%乙醇、30%乙醇和蒸馏水各润洗1次,每次30 min;再用10%蔗糖溶液浸润过夜。冷冻切片方法同“1.3”。切片分别用3种方法进行荧光显微观察:(1)直接观察;(2)0.1 mol/L K3PO4或1 mol/L NaOH浸润1 min左右后观察;(3)0.1%苯胺蓝染液染色1 min左右后观察。
2 结果与分析
2.1 新鲜材料徒手切片荧光显微观察(1)直接观察:叶主脉各组织细胞清晰可见;木质部厚壁细胞呈较明亮的黄白绿色,韧皮部外围厚壁纤维细胞呈灰蓝色,韧皮部和皮层薄壁细胞呈浅的黄白绿色,表皮蜡质层呈较亮的白绿色(图1上)。此方法优点是制片简单,各组织细胞清晰可见;缺点是切片易失水收缩,需快速观察拍照。
(2)水浸润展片后观察:木质部、韧皮部外围厚壁细胞荧光亮度增强,轮廓清晰;薄壁细胞、韧皮部细胞荧光减弱,轮廊不清晰(图1中)。此方法优点是有较充足的观察时间;缺点是切片在湿润状态下薄壁细胞壁轮廓较暗、不清晰,待切片干燥时同样容易失水收缩。
(3)0.1%苯胺蓝染液染色5 min左右后观察:各组织荧光强度整体增强,薄壁细胞呈亮黄绿色,韧皮部外围厚壁纤维细胞呈亮白蓝色;韧皮部筛管分子胼胝质沉淀呈白绿色亮点,但随着苯胺蓝溶液蒸发、切片变干时,胼胝质呈现的亮白绿色荧光点逐渐变暗,甚至消失(图1 下)。此方法优点是各组织细胞轮廓更加明亮,有较充足的观察时间;但切片较湿润时,切片表面会产生气泡,各组织轮廊不清晰,和方法(2)一样需在切片自然干燥过程中寻找较佳的观察状态。
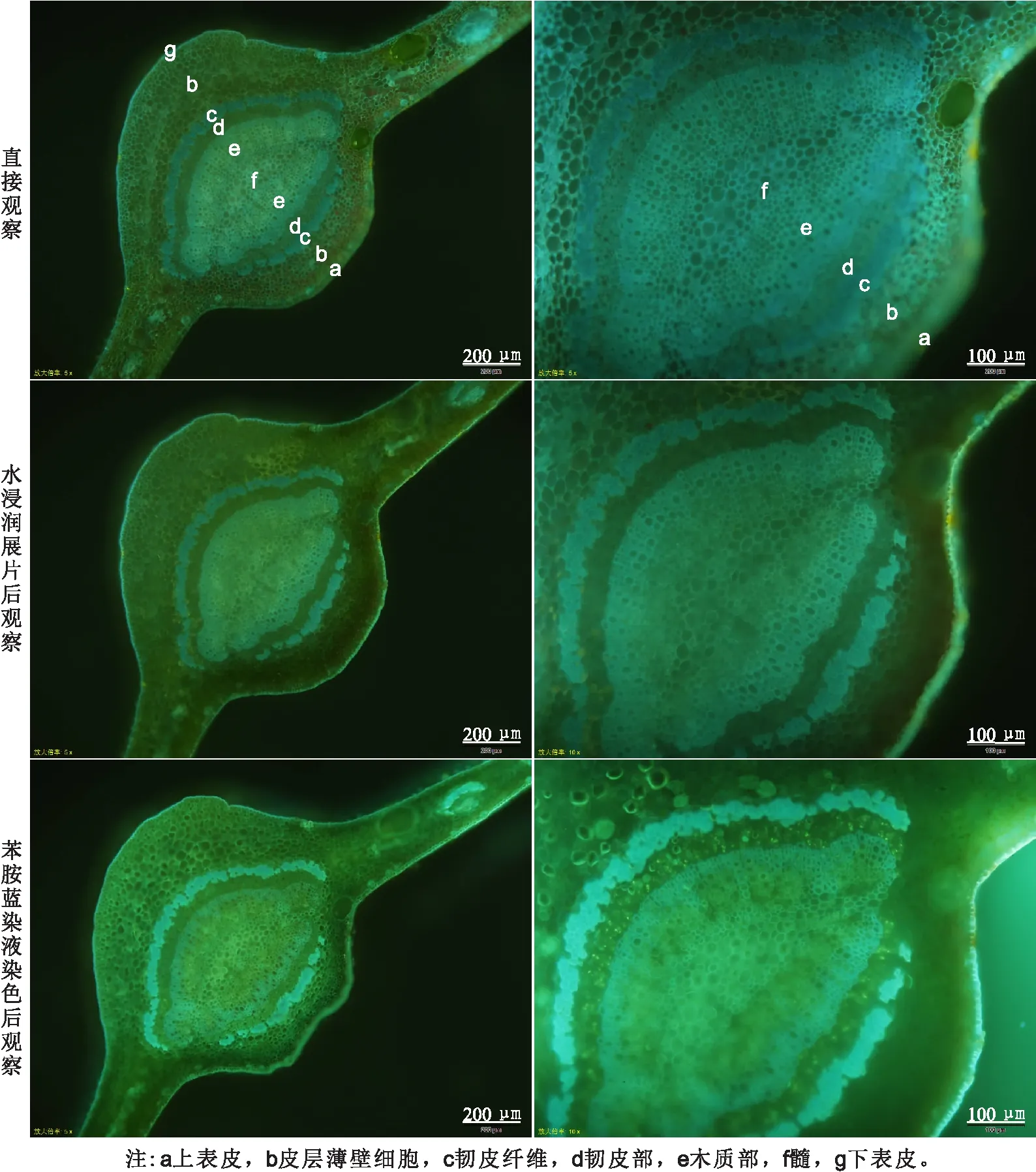
图1 柑桔成熟叶片主脉中段新鲜材料徒手切片不同荧光显微观察方法比较
在条件允许的情况下,新鲜材料徒手切片荧光显微观察可以用来快速地观测植物组织细胞形态发育状况,且效果良好。
2.2 固定材料徒手切片荧光显微观察(1)直接观察:叶主脉各组织轮廓较清晰;木质部、韧皮部外围厚壁细胞呈蓝色,清晰可见;其他组织细胞表面云雾状,细胞壁轮廓不可见;切片上有不同程度的絮状沉淀物遮挡(图2 A1)。
(2)0.1 mol/L K3PO4或1 mol/L NaOH浸润5 min左右后观察:可有效溶解切片上的絮状沉淀物,一定程度上提高切片的整体亮度,但不能改善整个切片的清晰度(图2 A2-A3)。
(3)0.1%苯胺蓝染液染色5 min左右后观察:在去除切片上沉淀物的同时,整体提高切片的荧光亮度和木质部、韧皮部外围厚壁细胞的清晰度(图2 A4)。
(4)10% Na2SO3沸水浴20 min软化后用0.1%苯胺蓝染液染色5 min左右后观察:Na2SO3沸水浴软化处理不能溶解切片表面沉淀物(图2 B1),苯胺蓝染色后效果与不经软化的方法(3)基本一致,没有明显提高(图2 B2)。
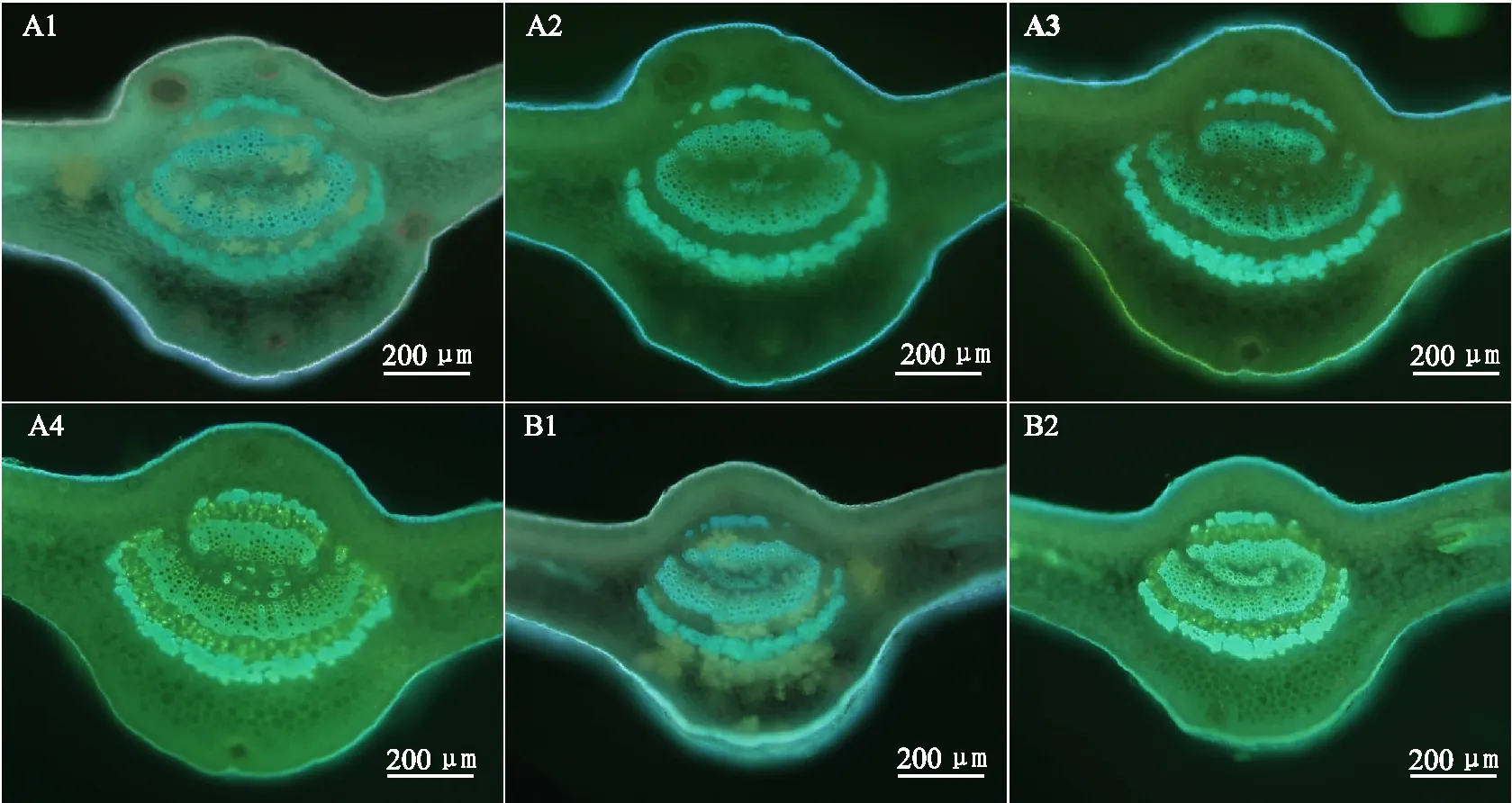
注:A1,直接观察;A2,0.1 mol/L K3PO4浸润后观察;A3,1 mol/L NaOH 浸润后观察;A4,0.1%苯胺蓝染液染色后观察;B1,10% Na2SO3沸水浴后观察;B2,10% Na2SO3沸水浴,0.1%苯胺蓝染液染色后观察。图2 柑桔成熟叶片主脉中段FAA固定材料徒手切片不同荧光显微观察方法比较
固定材料徒手切片荧光显微观察不能细微观测各组织细胞的结构,但可以用来观测木质部、纤维组织细胞及各组织的大小比例等发育状况;与新鲜材料徒手切片相比,试验材料取材固定后,显微观测时间可以灵活安排。
2.3 新鲜材料冷冻切片荧光显微观察(1)直接观察:叶主脉各组织细胞清晰可见;木质部、韧皮部外围厚壁细胞呈明亮的白蓝色,韧皮部和皮层薄壁细胞的细胞壁呈稍暗的黄白绿色,表皮蜡质层呈亮白色(图3 A1-A2)。
(2)0.1%苯胺蓝染液染色1 min左右后观察:各组织荧光强度整体呈亮白绿色,韧皮部筛管分子胼胝质沉淀呈白绿色亮点(图3 B1-B2);同新鲜材料徒手切片一样,随着苯胺蓝染液蒸发,切片变干时,各组织整体呈亮白蓝色,胼胝质呈现的亮白绿色荧光点逐渐变暗、甚至消失(图3 B3-B4)。
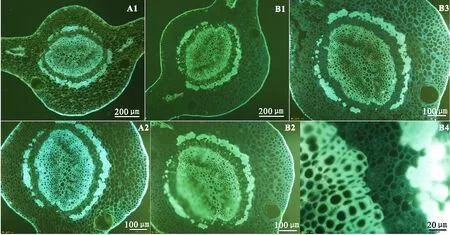
注:A1-A2,直接观察;B1-B2,0.1%苯胺蓝染液染色后湿润状态下观察;B3-B4,0.1%苯胺蓝染液染色后干燥状态下观察。图3 柑桔成熟叶片主脉中段新鲜材料冷冻切片不同荧光显微观察方法比较
在条件允许的情况下,新鲜材料冷冻切片荧光显微观察可以用来观测植物组织的细胞形态发育状况,制好的切片可以在1周或者更长的时间进行反复观测。根据试验条件和试验要求,方法(1)和(2)可以灵活选用。
2.4 固定材料冷冻切片荧光显微观察(1)直接观察:叶主脉各组织细胞清晰可见;同固定材料徒手切片一样,切片上有不同程度的絮状沉淀物;与新鲜材料冷冻切片基本一致,整体荧光亮度比新鲜材料稍暗;木质部、韧皮部外围厚壁细胞呈白蓝色,皮层和韧皮部薄壁细胞呈稍暗的黄绿色(图4 A)。
(2)0.1 mol/L K3PO4或1 mol/L NaOH浸润1 min左右后观察:可有效溶解切片上絮状沉淀物,提高清晰度和完整度(图4 B1-B2)。
(3)0.1%苯胺蓝染液染色1 min左右后观察:各组织荧光整体呈亮白绿色,韧皮部筛管分子胼胝质沉淀呈白绿色亮点(图4 C1);同新鲜材料一样,随着苯胺蓝染液蒸发,切片变干时,各组织荧光强度整体呈亮白蓝色,胼胝质呈现的亮白绿色荧光点逐渐变暗,切片彻底干燥后呈白色(图4 C2-C3)。
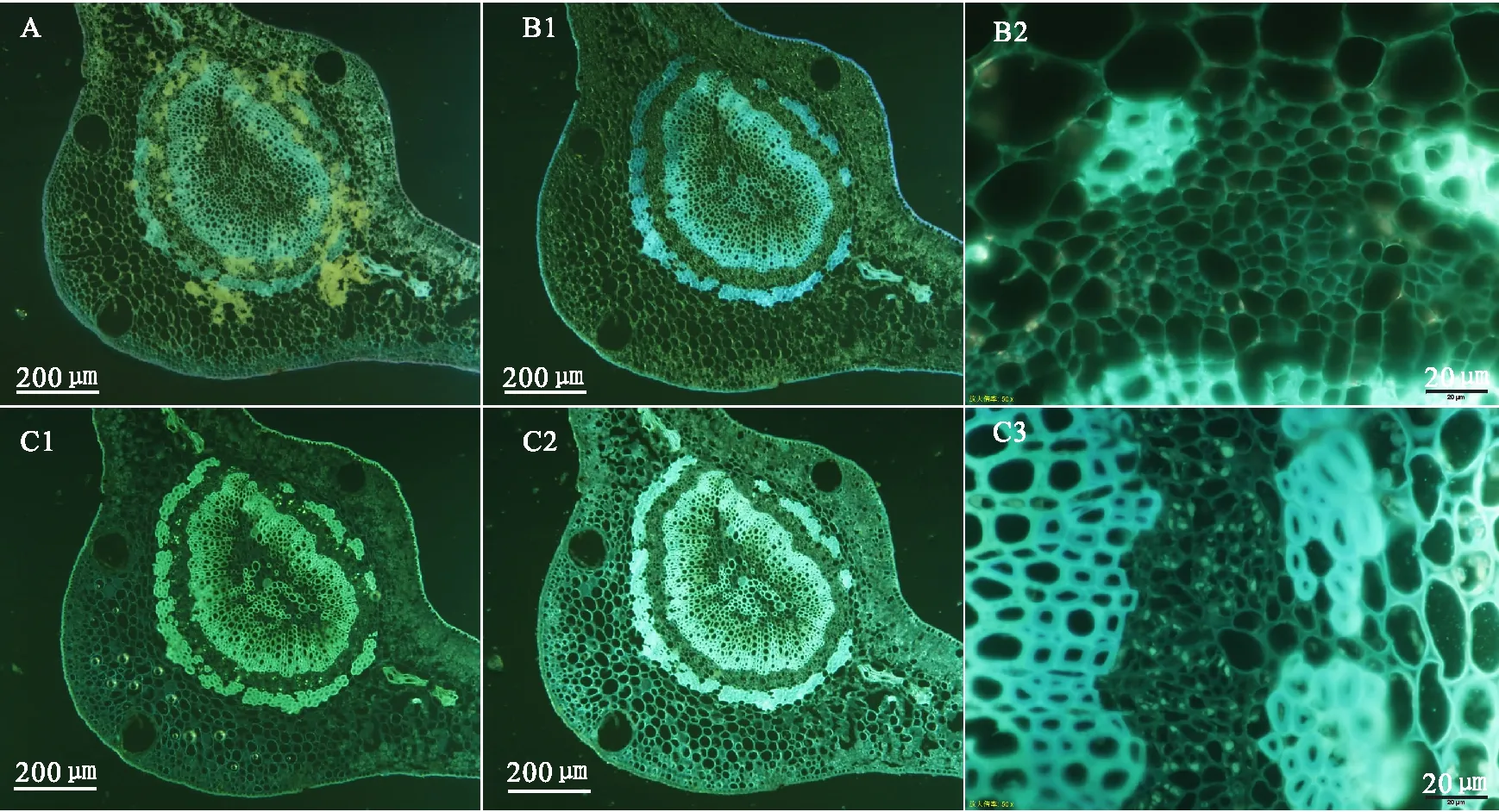
注:A,直接观察;B1-B2,0.1 mol/L K3PO4浸润后观察;C1,0.1%苯胺蓝染液染色后湿润状态下观察;>C2-C3,0.1%苯胺蓝染液染色后干燥状态下观察。图4 柑桔成熟叶片主脉中段FAA固定材料冷冻切片不同荧光显微观察方法比较
固定材料同新鲜材料的冷冻切片荧光显微观察效果基本一致,能细微观测各组织细胞的结构,且试验材料固定后,显微观测时间可以灵活安排,但操作程序要比新鲜材料复杂。根据试验条件和试验要求,方法(2)和方法(3)可以灵活选用。
3 讨论
细胞壁中的木质、酚类化合物、角质、栓质、孢粉素等成分呈现自发荧光[11-22]。藏药夏果贝的叶、茎荧光观察显示,木质部和中柱鞘纤维显明显的荧光,而薄壁细胞和韧皮部基本不显荧光,无需染色即可方便快捷地找到茎叶的木质部和纤维群[13];在黎族药物大青茎粉末荧光显微观察中,晶纤维和木栓细胞明显可见,结构层次感强,不同纤维发出的荧光和亮度不一样,可为鉴别不同种类的生药提供重要的方法[23]。本研究中,柑桔叶脉木质部和韧皮纤维的厚壁细胞及表皮细胞的蜡质层自发荧光强烈,薄壁细胞和韧皮部细胞荧光较弱,但也清晰可见。木质素是植物细胞次生壁的主要成分之一,木质部导管和韧皮纤维细胞为次生壁加厚的厚壁细胞,所以自发荧光强;而薄壁细胞次生壁薄,木质素等次生物质少,所以自发荧光弱。
在有机化合物中,能吸收光量子的化合物不是都能发射荧光的,但平常不能发射荧光的分子在特定条件下也可以发射荧光。pH值、温度、激发光照射时间长短、荧光物质的浓度和相态、淬灭剂的加入、观察时间等都影响荧光的强弱和有无[11]。本研究中,柑桔组织细胞的自发荧光颜色和强度随着处理方法的不同和切片湿润度的不同而有不同程度的改变,切片变干后各组织细胞壁更为明亮,薄壁细胞形态更为清晰,但厚壁纤维细胞由于荧光过于强烈难以观察细胞形态。韧皮部筛管分子细胞壁上的胼胝质无自发荧光,经苯胺蓝染色后呈现的亮白绿色荧光点,在湿润状态下随着观察时间延长荧光强度逐渐变弱,切片变干后荧光变为白色或者消失。因此,进行荧光观测时,要根据观测对象,确定较佳的稳定的观测方法。
本研究中,在荧光显微镜下,新鲜材料的徒手切片可以清楚地看到细胞轮廓和组织结构,固定材料的徒手切片虽然不能看清所有组织的细胞轮廓,但可以很好地区分表皮、皮层、韧皮纤维、韧皮部、木质部、髓等基本的组织结构;新鲜材料和固定材料的冷冻切片细胞轮廓更加清晰,组织结构更加分明。然而,在普通光学显微观察条件下,徒手切片难以看清细胞轮廓和组织结构;未经染色的冷冻切片能清楚地看到细胞轮廓和组织结构,但不同组织细胞间没有色差,难以区分木质部、韧皮部的厚壁细胞与薄壁细胞。与前人研究结果[13,23-24]一致,柑桔叶脉荧光显微观察同样具有制片简单、观察视野洁净、组织细胞结构层次感强等优点,可以根据不同的观测需求,选择不同的材料处理方式和切片方式。
本研究中发现,材料经FAA固定后,切片上会出现沉淀物,导致难以进行细胞形态的直接观察,但经0.1%苯胺蓝染液染色后,切片上的沉淀消失。进一步研究发现,固定材料经苯胺蓝染液中的K3PO4缓冲液或NaOH溶液处理后沉淀也会消失,但经Na2SO3软化处理后沉淀不消失。因此,用K3PO4溶液或NaOH溶液对固定材料进行浸润处理,可以很好的去除沉淀,达到较佳的观测效果。此方法尚未见相关报道,可以为其他植物固定材料的显微观察提供借鉴。

