肠道菌群和血清炎性因子变化及益生菌对肝性脑病的预防作用
范英超,程芳,司海骄
(中国人民解放军北部战区空军医院干部病房,辽宁 沈阳 110042)
亚临床肝性脑病是指慢性肝病患者并未出现神经系统体征和临床精神症状的异常,仅能通过电生理检查或/和智力测验才能判断的一种肝性脑病[1-2]。亚临床肝性脑病具有较高的临床发病率,且存在较大的潜在危害性;现阶段有关该病的发病机制尚不明确。目前,在亚临床肝性脑病发生、发展中,炎症因子水平以及肠道菌群紊乱的影响引起了临床广泛的关注[3]。近年来,相关研究[4]显示,选择益生菌对亚临床肝性脑病患者进行辅助治疗效果显著,但有关其是否能调节炎症因子和肠道菌群的报道较少。基于此,本研究旨在探究肠道菌群、血清炎性因子变化及益生菌对肝性脑病的预防作用,现报道如下。
1 资料与方法
1.1 临床资料 选取本院2017 年3 月至2019 年12 月收治的60 例亚临床肝性脑病患者作为实验组,另选取同期在本院进行健康体者60 名作为对照组。实验组男37 例,女23
例;年龄38~63岁,平均(46.2±6.1)岁。纳入标准:神经系统及精神系统检查均正常,体感诱发电位检查或/和精细智力测检测异常;存在肝硬化病史。排除标准:精神系统及神经系统疾病者;临床型肝性脑病者;入组前8 周接受镇静剂或中枢神经系统抑制剂治疗者。对照组男34名,女26名;年龄40~61岁,平均(46.8±5.5)岁。两组临床资料比较差异无统计学意义,具有可比性。所有研究对象均对本研究知情同意,并自愿签署知情同意书。本研究已通过医院伦理委员会审核批准。
1.2 方法 实验组患者接受护肝降转氨酶以及低盐饮食干预,并给予双歧杆菌三联活菌胶囊(上海上药信谊药厂有限公司,国药准字S10950032)治疗,每次630 mg,每天2 次,采用温开水送服,持续治疗6周。
1.3 观察指标 比较两组血清炎症因子水平以及肠道菌群数量。对照组在入组时检测血清炎症因子水平以及肠道菌群数量。实验组分别于治疗前、治疗后6 周,检测血清炎症因子水平以及肠道菌群数量。①血清炎症因子水平:于清晨空腹状态下,采集研究对象4~6 mL 静脉血,通过离心处理分离血清,置于-20 ℃的冰箱中备用,采用放射免疫法测定血清肿瘤坏死因子-α(TNF-α)水平,采用酶联免疫吸附法测定血清白介素-6(IL-6)和血清白介素-10(IL-10)水平,并选择上海恒远生物科技有限公司生产的试剂盒,严格按照试剂盒说明书开展相关的检测操作。②肠道菌群:严格遵循无菌操作原则,采集所有研究对象2 g新鲜粪便,放置于无菌离心管内,保存于-20 ℃的环境中。选择DNA提取试剂盒提取标准菌株DNA,并检测其浓度,计算标准品PCR片段拷贝数。离心洗涤粪便,选择相同方法提取细菌总DNA,自行设计引物,通过荧光定量PCR测定粪便细菌DNA;按照反应后扩增曲线计算细菌拷贝数[5]。
1.4 统计学方法 采用SPSS 21.0统计软件进行数据分析,计量资料以“±s”表示,比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组肠道菌群数量比较 治疗前,实验组大肠埃希菌数量明显多于对照组,肠道乳杆菌、双歧杆菌数量明显少于对照组(P<0.05);治疗后6周,实验组大肠埃希菌数量明显少于治疗前,肠道乳杆菌、双歧杆菌数量明显多于治疗前(P<0.05),见表1。
表1 两组肠道菌群数量比较(±s,lg CFU/g)Table 1 Comparison of intestinal flora between the two groups(±s,lg CFU/g)
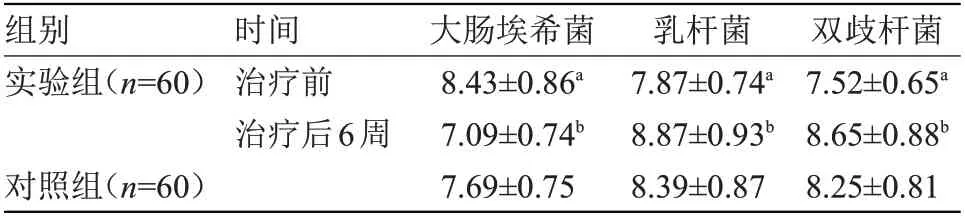
表1 两组肠道菌群数量比较(±s,lg CFU/g)Table 1 Comparison of intestinal flora between the two groups(±s,lg CFU/g)
注:与对照组比较,aP<0.05;与治疗前比较,bP<0.05
组别实验组(n=60)双歧杆菌7.52±0.65a 8.65±0.88b 8.25±0.81时间治疗前治疗后6周对照组(n=60)大肠埃希菌8.43±0.86a 7.09±0.74b 7.69±0.75乳杆菌7.87±0.74a 8.87±0.93b 8.39±0.87
2.2 两组血清炎性因子水平比较 治疗前,实验组TNF-α、IL-6水平均明显高于对照组,IL-10水平明显低于对照组(P<0.05);治疗后6周,实验组TNF-α、IL-6水平均明显低于治疗前,IL-10水平高于治疗前(P<0.05),见表2。
表2 两组血清炎性因子水平比较(±s)Table 2 Comparison of serum inflammatory factors between the two groups(±s)
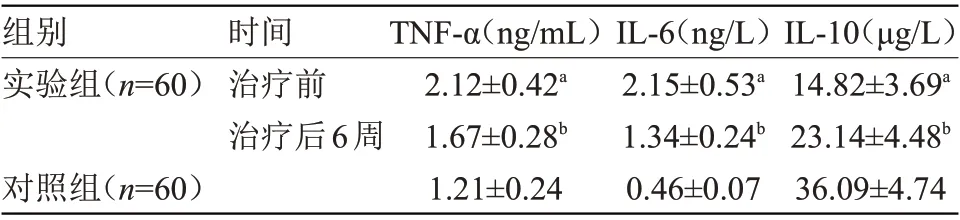
表2 两组血清炎性因子水平比较(±s)Table 2 Comparison of serum inflammatory factors between the two groups(±s)
注:TNF-α,肿瘤坏死因子-α;IL-6,血清白介素-6;IL-10,血清白介素-10
IL-10(μg/L 14.82±3.69a 23.14±4.48b 36.09±4.74组别实验组(n=60)时间治疗前治疗后6周对照组(n=60)TNF-α(ng/mL)2.12±0.42a 1.67±0.28b 1.21±0.24 IL-6(ng/L)2.15±0.53a 1.34±0.24b 0.46±0.07
3 讨论
亚临床肝性脑病发病机制较复杂,目前,尚未完全明确[6]。有研究[7]显示,亚临床肝性脑病患者的消化道淤血水肿、门静脉压等发生率升高,进而增加肠黏膜的通透性;此外,亚临床肝性脑病患者的胃肠道蠕动较缓慢,肠道致病菌清除率较差,致病菌繁殖速度较快,导致内毒素的产生量增加,进而引起内毒素血症,肝细胞受到刺激会导致炎症因子的分泌量增加,肠黏膜屏障被进一步破坏,肠内毒素、细菌、炎症因子出现大量易位,进入门静脉,导致肝功能损伤加重,并形成恶性循环[8-9]。本研究结果表明,治疗前,实验组TNF-α、IL-6 水平明显高于对照组,IL-10 水平明显低于对照组(P<0.05)。治疗后6 周,实验组TNF-α、IL-6 水平明显低于治疗前,IL-10水平明显高于治疗前(P<0.05),表明,亚临床肝性脑病患者的血清炎症因子网络出现紊乱,抗炎症因子(IL-10)水平显著降低,而促炎症因子(TNF-α、IL-6)水平则显著升高。
双歧杆菌三联活菌胶囊是现阶段临床中应用比较广泛的一种口服益生菌,该益生菌能在肠黏膜上皮竞争性粘附,且繁殖速度较快,并在肠黏膜表面形成菌膜,能对致病菌的繁殖和定植进行有效拮抗,使肠道菌群能维持平衡,重建肠道菌膜屏障。此外,益生菌还会对肠黏膜造成刺激,增加炎症因子的释放量,进而有效调节炎症反应,使肠道局部抗感染能力显著提升。本研究结果表明,治疗前,实验组大肠埃希菌数量明显多于对照组,肠道乳杆菌、双歧杆菌数量明显少于对照组(P<0.05)。治疗后6 周,实验组大肠埃希菌数量显著低于治疗前,肠道乳杆菌、双歧杆菌数量显著多于治疗前(P<0.05),表明,选择双歧杆菌三联活菌胶囊对亚临床肝性脑病患者进行辅助治疗,能纠正肠道菌群紊乱,重建肠道菌群屏障进行。
综上所述,应用益生菌治疗亚临床肝性脑病患者,能有效纠正肠道菌群紊乱,重建肠道菌群屏障,且还能有效调节血清炎症因子水平,进而有效控制局部炎症反应。

