过敏性紫癜患儿白三烯B4和25-羟基维生素D3水平与疾病严重程度的相关性研究
王华胜,许超
(宣城市人民医院,安徽 宣城 242000)
过敏性紫瘢(Henoch-Schonlein purpura,HSP)是一种儿童期最常见的自身免疫性血管炎综合征,主要病理改变为全身性小血管炎,临床表现主要包括可触性皮肤紫癜、关节炎或关节痛、肾炎、腹痛及胃肠道出血等[1]。该病易复发,严重影响患儿的身体健康,然而其确切病因及发病机制目前尚未完全清楚。近年来机体免疫功能紊乱在其发病机制中的作用越来越引起研究者的关注,主要包括体液免疫紊乱、细胞免疫失衡及大量炎性因子释放等[2]。白三烯B4(LTB4)是一种重要的炎性介质,在过敏性炎性反应迟发相阶段被大量释放,参与包括哮喘、变态反应性鼻炎、荨麻疹、炎症性肠病等多种炎症性疾病的病理过程[3]。25-羟维生素 D3[25-(OH)D3]是一种在人体内反应维生素D水平的最佳存在形式,可通过多种途径调节免疫功能及炎性反应[4]。研究表明其表达水平的降低与多发性硬化、类风湿性关节炎及系统性红斑狼疮等自身免疫性疾病的发病高度相关,且其活性代谢产物与疾病的发生及发展关系密切[5]。LTB4和25-(OH)D3对于免疫、炎性反应及过敏的治疗都有重要意义,因此本研究初步探讨二者与HSP严重程度的关系,以期为HSP的病因探寻提供新的思路。
1 资料与方法
1.1 一般资料 选择本院2016年1月—2019年12月收治的260例首次诊断为HSP的患儿,其中男 155例,女 105例,平均年龄(6.58±2.84)岁。HSP诊断标准符合2013年中华医学会专家组建议新标准[6],其中第1条为必要条件,并伴有2~5中至少1条:①皮肤出现可触性紫癜;②弥漫性腹痛;③任何部位活检IgA沉积;④关节炎/关节痛;⑤肾脏受累(血尿和/或蛋白尿)。根据HSP患儿是否和合并肾脏受累,分为紫癜性肾炎(HSPN)组(27例)和非紫癜性肾炎(NHSPN)组(233例),根据临床表现将NHSPN组分为单纯组(仅表现皮肤紫癜症状,37例)、消化道组(皮肤紫癜合并消化道症状,49例)、关节组(皮肤紫癜合并关节症状,77例)、混合组(皮肤紫癜同时合并消化道症状和关节症状,70例)等5个亚组。
另选取同期于我院体检中心体检的60例健康儿童为对照组,其中男38例,女22例,平均年龄(7.03±3.15)岁,年龄、性别比与病例组相比差异无统计学意义。
纳入标准:①年龄2~15岁;②患儿家属签署知情同意书并经本院伦理委员会批准。
排除标准:①近3个月内使用维生素D或钙剂;②近3个月内使用糖皮质激素或免疫治疗;③患先天性心肺部疾病、心功能不全等;④伴有钙磷代谢异常、慢性肾脏疾病。
1.2 诊断标准 ①HSPN:诊断标准参照2009年中华医学会儿科学分会肾脏病学组制定的标准[7]在HSP病程6个月内,出现血尿和(或)蛋白尿。②HSP复发:确诊HSP患儿在临床症状完全消失后至少1个月再次出现HSP的典型表现。
1.3 方法
1.3.1 样本采集 所有研究对象均于清晨空腹抽取静脉血2 mL,静置20 min后,2 000 r/min,离心半径50 cm,离心20 min,收集上清,置于-80℃冰箱保存。采用酶联免疫吸附测定(ELISA)法检测血清LTB4和25-(OH)D3水平。
1.3.2 观察指标 收集所有研究对象实验室检查指标:血常规[血白细胞(WBC)计数、血小板(PLT)计数],血生化[三酰甘油(TG)、总胆固醇(TC)],免疫学指标[C 反应蛋白(CRP)、IgG、IgA、IgM、IgE、补体C3、补体 C4]。
1.3.3 随访 通过电话询问、门诊和住院对所有HSP患儿进行随访,随访为期6个月。了解观察期内是否发生皮疹、腹痛、关节炎、关节痛及尿常规异常等症状,以判断HSP复发情况。
1.4 统计学方法 采用SPSS 19.0进行数据分析,符合正态分布的计量资料用均数±标准差表示,2组间比较采用独立样本t检验,多组间比较采用方差分析;不符合正态分布用中位数及四分位数间距表示,组间比较采用秩和检验;计数资料用率表示,组间比较采用χ2检验或Fisher确切概率法。多因素logistic回归模型分析与HSP的相关性,相关性分析采用Pearman相关性分析,受试者工作特征曲线(ROC)分析LTB4和25-(OH)D3对HSP的预测价值,双侧P<0.05为差异有统计学意义。
2 结果
2.1 实验室检查结果比较 比较HSP患儿和健康对照组实验室检查结果。与对照组相比,HSP组患儿 WBC、PLT、CRP、IgA、IgM、IgE、补体 C3 和 LTB4水平显著升高(P<0.05),而 25-(OH)D3 水平则显著降低(P<0.05)。见表1。
表1 患者临床症状及实验室检查结果比较 (±s)
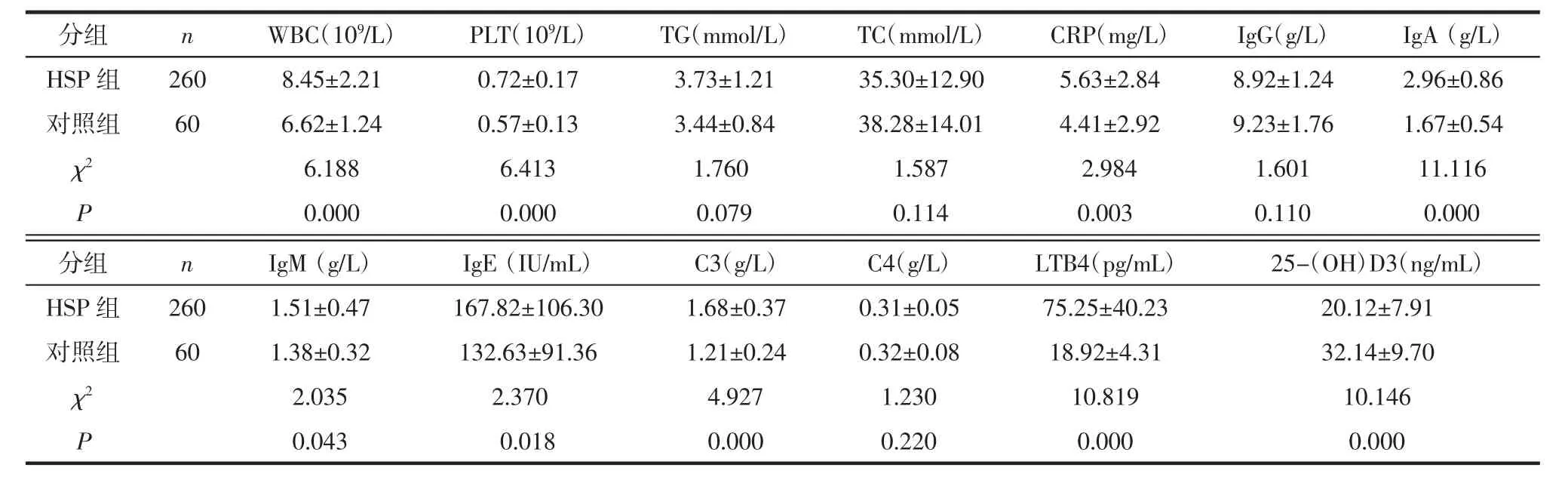
表1 患者临床症状及实验室检查结果比较 (±s)
分组 n WBC(109/L) PLT(109/L) TG(mmol/L) TC(mmol/L) CRP(mg/L) IgG(g/L) IgA(g/L)HSP 组 260 8.45±2.21 0.72±0.17 3.73±1.21 35.30±12.90 5.63±2.84 8.92±1.24 2.96±0.86对照组 60 6.62±1.24 0.57±0.13 3.44±0.84 38.28±14.01 4.41±2.92 9.23±1.76 1.67±0.54 χ2 6.188 6.413 1.760 1.587 2.984 1.601 11.116 P 0.000 0.000 0.079 0.114 0.003 0.110 0.000分组 n IgM(g/L) IgE(IU/mL) C3(g/L) C4(g/L) LTB4(pg/mL) 25-(OH)D3(ng/mL)HSP 组 260 1.51±0.47 167.82±106.30 1.68±0.37 0.31±0.05 75.25±40.23 20.12±7.91对照组 60 1.38±0.32 132.63±91.36 1.21±0.24 0.32±0.08 18.92±4.31 32.14±9.70 χ2 2.035 2.370 4.927 1.230 10.819 10.146 P 0.043 0.018 0.000 0.220 0.000 0.000
2.2 多因素Logistic回归分析 将上述2组患者比较差异有统计学意义的因素纳入多因素Logistic回归分析,IgA、LTB4和 25-(OH)D3水平均为 HSP 的独立危险因素(P<0.05),其他因素未能进入Logistic回归模型中。见表2。
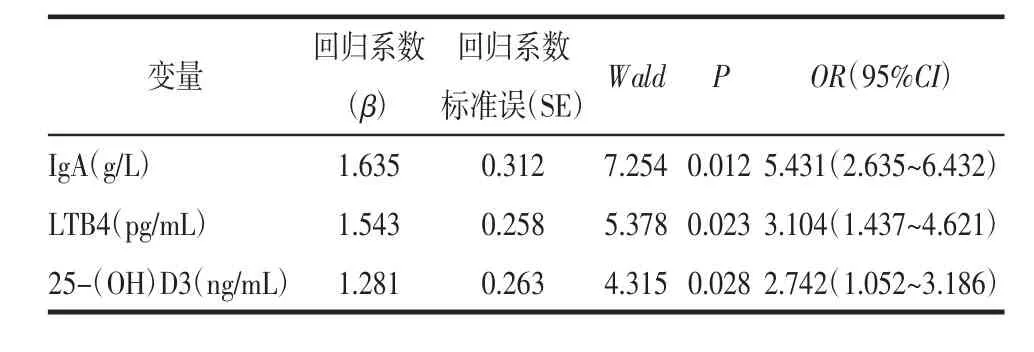
表2 HSP多因素logistic回归分析
2.3 HSP患儿LTB4和25-(OH)D3与免疫球蛋白水平相关性 LTB4与IgA呈显著正相关(P<0.05),25-(OH)D3与 IgA 呈显著负相关(P<0.05),二者与IgE均无明显相关性。提示IgA可能随着LTB4表达水平的升高及25-(OH)D3表达水平的降低而升高。见表3、图1。
表3 HSP患儿LTB4和25-(OH)D3与免疫球蛋白水平相关性 (±s)
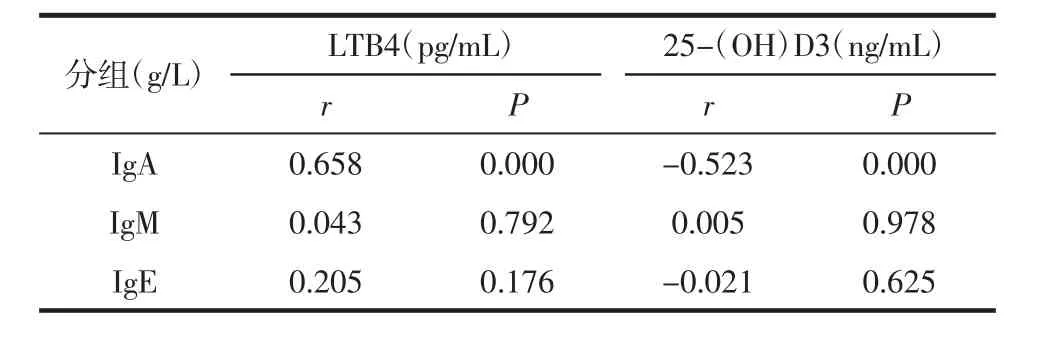
表3 HSP患儿LTB4和25-(OH)D3与免疫球蛋白水平相关性 (±s)
分组(g/L)images/BZ_17_1490_2896_1862_3010.png images/BZ_17_1885_2896_2256_3010.pngIgA 0.658 0.000 -0.523 0.000 IgM 0.043 0.792 0.005 0.978 IgE 0.205 0.176 -0.021 0.625
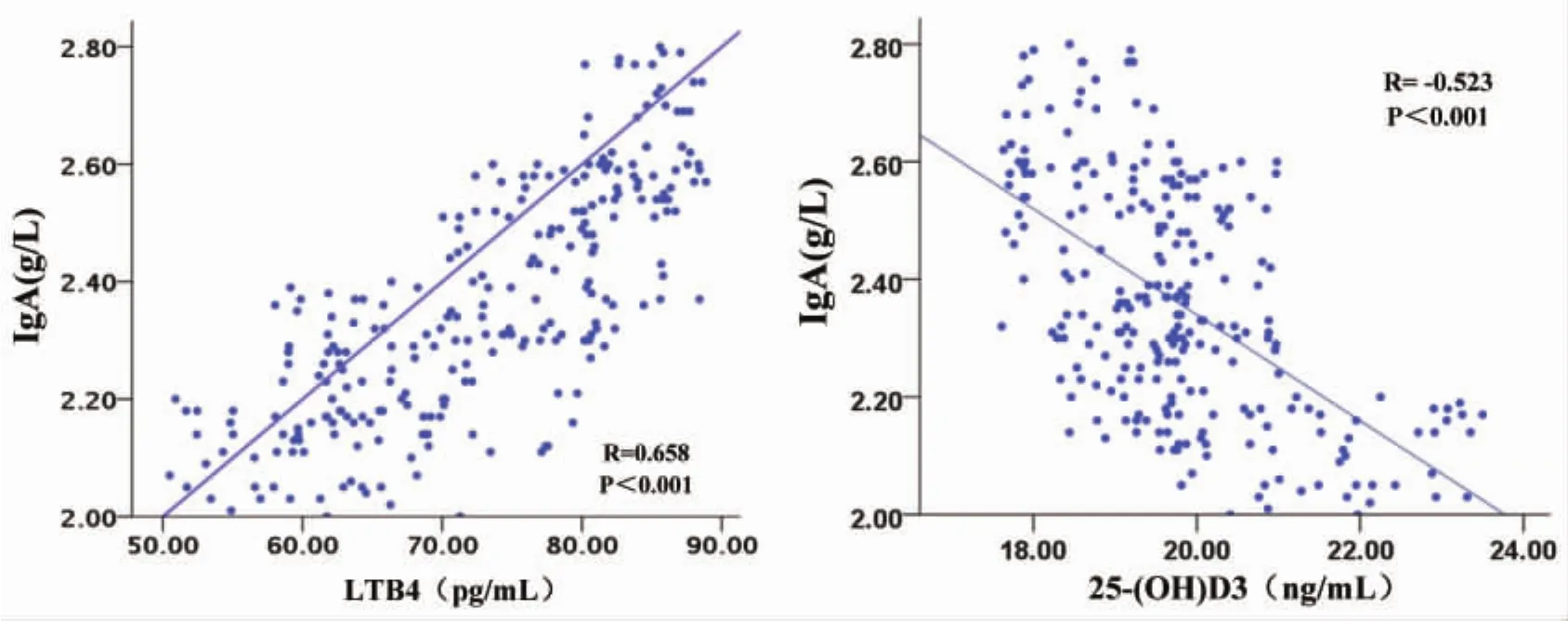
图1 LTB4和25-(OH)D3与IgA水平相关性
2.4 不同亚组HSP患儿LTB4和25-(OH)D3水平比较 HSPN组LTB4显著高于NHSPN组,而25-(OH)D3显著低于NHSPN组(P<0.05);在NHSPN组中,与单纯组相比,LTB4在消化道组、关节炎及混合组均显著升高,而25-(OH)D3在混合组显著降低(P<0.05)。提示在病情更严重、症状更复杂的组别LTB4表达水平相对较高,25-(OH)D3表达水平相对较低。见表4。
表4 不同亚组患儿LTB4和25-(OH)D3水平比较 (±s)
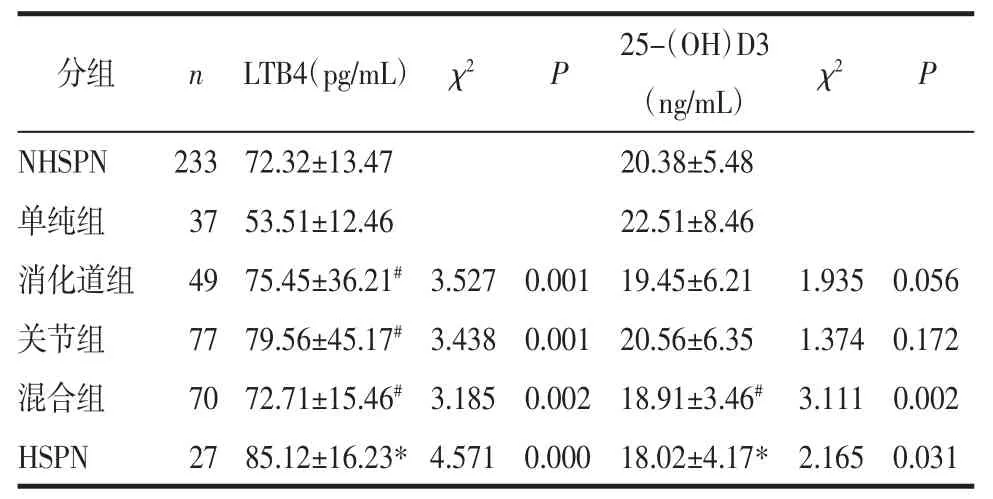
表4 不同亚组患儿LTB4和25-(OH)D3水平比较 (±s)
注:与NHSPN组比较,*P<0.05;与单纯组比较,#P<0.05。
分组 n LTB4(pg/mL) χ2 P 25-(OH)D3(ng/mL) χ2 P NHSPN 233 72.32±13.47 20.38±5.48单纯组 37 53.51±12.46 22.51±8.46消化道组 49 75.45±36.21#3.527 0.001 19.45±6.21 1.935 0.056关节组 77 79.56±45.17#3.438 0.001 20.56±6.35 1.374 0.172混合组 70 72.71±15.46#3.185 0.002 18.91±3.46# 3.111 0.002 HSPN 27 85.12±16.23*4.571 0.000 18.02±4.17* 2.165 0.031
2.5 ROC曲线分析 LTB4和 25-(OH)D3对 HSP的诊断价值 为评价LTB4和25-(OH)D3对HSP患儿的诊断价值,本研究对LTB4和25-(OH)D3进行ROC曲线分析,曲线下面积分别为0.722、0.761,有较高的诊断价值,LTB4和25-(OH)D3的最佳临界值分别为 27.82 pg/mL、22.10 ng/mL。见表5、图2。
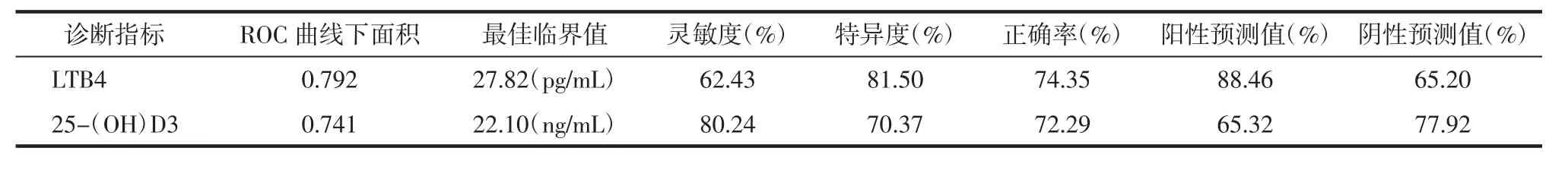
表5 ROC曲线分析LTB4、25-(OH)D3对HSP的诊断价值
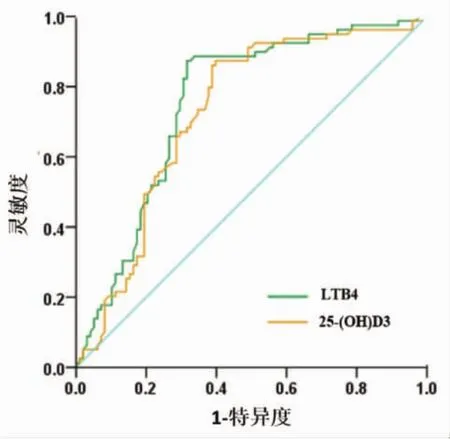
图2 ROC曲线分析LTB4和25-(OH)D3对HSP的诊断价值
2.6 HSP患儿的危险分层及预后评价 根据LTB4和25-(OH)D3的最佳临界值对 HSP患儿进行危险分层,分层标准为:LTB4≤27.82 pg/mL和25-(OH)D3>22.10 ng/mL 为低危组(n=120);LTB4>27.82 pg/mL或者 25-(OH)D3≤22.10 ng/mL为中危组(n=92);LTB4>27.82 pg/mL 和 25-(OH)D3≤22.10 ng/mL为高危组(n=48)。高危组患儿住院时间更长,6个月内共计65例患儿分别出现皮疹、腹痛、关节炎及尿常规异常等复发症状,其中低、中、高危组各占14.2%、31.5%、39.6%,差异有统计学意义,提示以LTB4和25-(OH)D3分层的危险程度高的患儿预后较差。见表6。
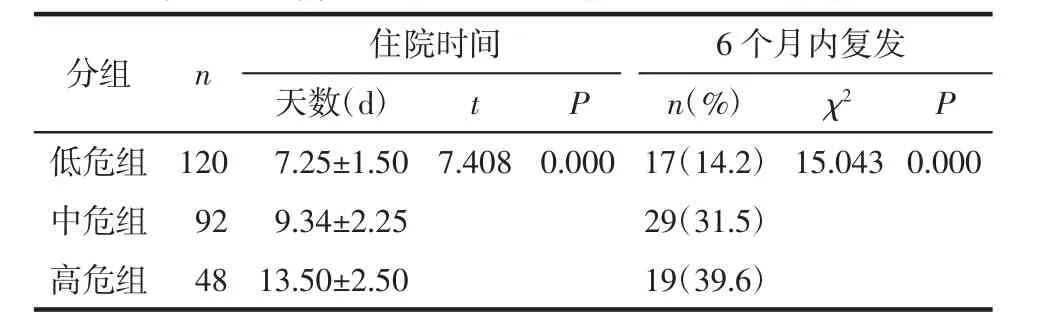
表6 不同危险分层HSP患儿预后情况分析
3 讨论
HSP的发病机制尚未明确,研究表明其发病过程以引起体液免疫异常的免疫反应为主,同时包括细胞免疫、细胞因子及炎性递质的参与,其中IgA介导的免疫反应在其发病过程中发挥重要作用,由于辅助性T淋巴细胞及B淋巴细胞活性增强,大量IgA免疫复合物产生,沉积在小血管壁导致毛细血管及细小动脉炎,引起血液外渗至皮下、黏膜等,根据沉积部位的不同可导致腹痛、消化道出血、血尿等不同症状[8-9]。在免疫复合物形成和沉积过程中常有补体活化,可观察到早期补体C3增高,后期在毛细血管壁可测到有补体C4缺乏,提示C3、C4可作为关键分子激活替代途径[10]。白细胞和血管内皮细胞之间的相互作用也参与HSP的发病,内皮损伤、血管周围白细胞浸润、趋化因子和细胞因子产生是这一过程中的重要因素[11]。此外,HSP还存在血小板升高,进而导致凝血异常[12]。
LTB4是一种强有力的诱导剂和细胞趋附剂,有趋化炎性细胞到炎性反应部位的功能,是参与机体免疫和自身免疫的关键细胞因子。可参与毛细支气管炎、过敏性鼻炎、皮炎及急性肺损伤等一系列与免疫、炎性反应相关的疾病[13]。多种免疫细胞如巨噬细胞、树突细胞、T淋巴细胞及抗原提呈细胞等均可表达25-(OH)D3-1α羟化酶和维生素 D受体,进而调节细胞的正常功能,表明维生素D在炎性疾病中可能发挥一定作用[4]。25-(OH)D3是人体内维生素D的主要储存形式,张远达等[14]表明25-(OH)D3可在HSP发病中表达降低。本研究也发现HSP患儿LTB4水平显著高于健康对照组,而25-(OH)D3水平显著低于对照组。
免疫球蛋白是参与机体特异性体液免疫反应的重要效应分子,是由B细胞在外来抗原刺激下增殖、分化而分泌的一种糖蛋白,可分为IgG、IgA、IgM、IgD 和 IgE 5种类型[15],
其中IgD在体内含量低不易检测到,因此本研究对IgG、IgA、IgM和IgE进行检测,发现HSP患儿中IgA、IgM和IgE水平显著升高,IgG表达无明显变化,目前国内外对IgG、IgM及IgE在HSP血清中的变化尚未取得一致的结果,可能需要扩大样本量进一步研究。本研究中与Purevdorj等[15]结果部分一致。而HSP患儿IgA的升高与国内外众多研究一致[8,15-16],检测血清中IgA的含量对HSP有辅助诊断的作用。本研究进一步分析了LTB4和25-(OH)D3与IgA、IgM和IgE水平的相关性,发现LTB4水平与IgA之间存在显著正相关,而25-(OH)D3水平与IgA存在显著负相关,即LTB4水平越高、25-(OH)D3水平越低,IgA水平越高,表明HSP发病过程中LTB4和25-(OH)D3与IgA存在一定关系。
皮肤紫癜在HSP发病中反复出现,是HSP诊断的必备条件,除此之外,常伴有胃肠、关节、肾脏等其他系统受累,而其中肾脏损害最为严重,HSP所致的肾脏损害称HSPN,对患儿的长期预后起着决定性作用[17]。Tan等[18]研究认为严重的皮肤紫癜与HSPN相关,Jimenez等[19]报道皮疹多次反复与HSPN有关。本研究对比LTB4和25-(OH)D3在HSP不同亚组患儿中的表达水平,发现与NHSPN组相比,HSPN组患儿LTB4水平显著升高,而25-(OH)D3水平显著降低;进一步比较NHSPN各亚组,发现LTB4和25-(OH)D3在多脏器受累时变化水平高于单纯皮肤紫癜症状组。提示LTB4和25-(OH)D3可在一定程度上反应HSP疾病严重程度。
HSP一般预后良好,部分患儿可反复发作,复发间隔时间数周至数月不等。为进一步探讨血清LTB4和25-(OH)D3表达水平对HSP预后的预测价值,本研究通过建立ROC曲线分析发生HSP时LTB4和25-(OH)D3最佳临界值分别为27.82 pg/mL和22.10 ng/mL,以此将患者分为低危、中危和高危3组并比较3组患者预后的差异。结果表明高危组患儿住院时间更长,且6个月内复发比例最高,提示LTB4和25-(OH)D3的表达水平可在一定程度上评估HSP患儿的预后情况。
综上所述,HSP患儿存在LTB4水平上升,同时存在25-(OH)D3水平下降情况,且表达水平与疾病严重程度存在明显关系,因此实验室检测可结合2种指标综合评估HSP患儿的疾病严重程度及预后情况,从而为临床诊断提供更充足的证据。

