增殖细胞核抗原与喉鳞状细胞癌发病及预后相关的Meta分析
王德清 陆文敏 肖锋 徐莹 李霞 顾晓峰
喉癌是头颈部常见的恶性肿瘤之一,95%以上为鳞状细胞癌,男性发病率远多于女性(分别为每10万人中5.8例和每10万人中1.2例)。在美国,每年大约有13430例喉癌新病例被确诊,约有3620例患者死于喉癌。近40年来喉癌的发病率在逐渐下降,随着外科技术及术后放化疗相结合的综合治疗策略的不断优化,喉癌患者的5年生存率从2017年的63%上升到2021年的73%[1,27]。近年来,通过寻找一些与肿瘤发病密切相关的临床标记物来对肿瘤患者的预后进行评估成为研究的热点。其中,增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)作为一种肿瘤标记物被越来越多的研究证明在喉癌、下咽癌、鼻咽癌、鼻腔内翻性乳头状瘤等肿瘤组织中存在过度表达[2]。本研究通过全面检索纳入PCNA与喉鳞癌发病及临床病理特征相关的文献,应用Meta分析的手段进一步明确PCNA与喉鳞癌发病及临床预后的相关性。
1 文献检索策略
资料与方法
全面系统的检索Pubmed、Web of science、Embase、Cochrane Library、维普、知网、万方等数据库上发表的增殖细胞核抗原与喉鳞状细胞癌的发病及预后相关的研究,检索关键词为“喉鳞状细胞癌”、“增殖细胞核抗原”、“Laryngeal squamous cell carcinoma(LSCC)”、“proliferating cell nuclear antigen(PCNA)”。
2 纳入与排除标准
纳入标准:①研究对象为经临床手术及术后病理确诊的喉癌患者,属于病例对照研究。②PCNA检测方式为免疫组化。③如果同一个作者存在多篇类似的文章,则选用最新的文献。④文献提供了较详细的PCNA与喉鳞癌临床病理特征相关的研究数据。排除标准:①排除非论著、动物实验的文献。②排除未设置对照组、检测方法不是免疫组化的文献。③排除非中英文文献。④排除文献质量差(NOS评分小于5分)、未提供所需原始数据的文献。
3 异质性检验
对各研究进行异质性检验(采用Q检验及I2检验)。当I2>50%或P<0.05时,表示有较大的异质性,此时采用随机效应模型;I2<50%且P>0.05时,表示异质性较小,此时采用固定效应模型。
4 统计学分析
采用Stata 12.0统计软件对原始研究数据进行分析,以OR及95%CI评价PCNA与喉鳞状细胞癌患者临床病理特征的相关性。以P<0.05表示差异具有统计学意义。
结果
1 文献概括
参照以上的纳入、排除标准,共有20篇符合标准的文献被纳入本研究[3-22]。其中16篇文献对喉癌组和正常对照组进行比较,13篇文献对有淋巴结转移组和无淋巴结转移组进行比较,12篇文献对临床分期III/IV组和I/II组进行比较,14篇文献对病理分级的中低分化组和高分化组进行比较。
2 喉鳞状细胞癌发病与PCNA的相关性
经异质性检验I2=43.4%,P=0.033<0.05,表明异质性较大,因此该研究选择随机效应模型。Meta分析结果显示:Z=10.07,OR=13.22,95%CI为8.00~21.85,P<0.0001,喉癌组PCNA的阳性率明显高于正常对照组,表明喉鳞癌的发病与PCNA的过度表达密切相关(图1)。

图1 喉癌组与正常对照组PCNA阳性率对比的森林图
3 有淋巴结转移组与无淋巴结转移组中PCNA阳性率的对比
经异质性检验I2=31.9%,P=0.128,表明异质性较小,因此该研究选择固定效应模型。Meta分析结果显示:Z=8.25,OR=5.71,95%CI为3.77~8.64,P<0.0001,有淋巴结转移组PCNA的阳性率明显高于无淋巴结转移组,表明PCNA的过度表达与喉鳞癌的淋巴结转移密切相关(图2)。
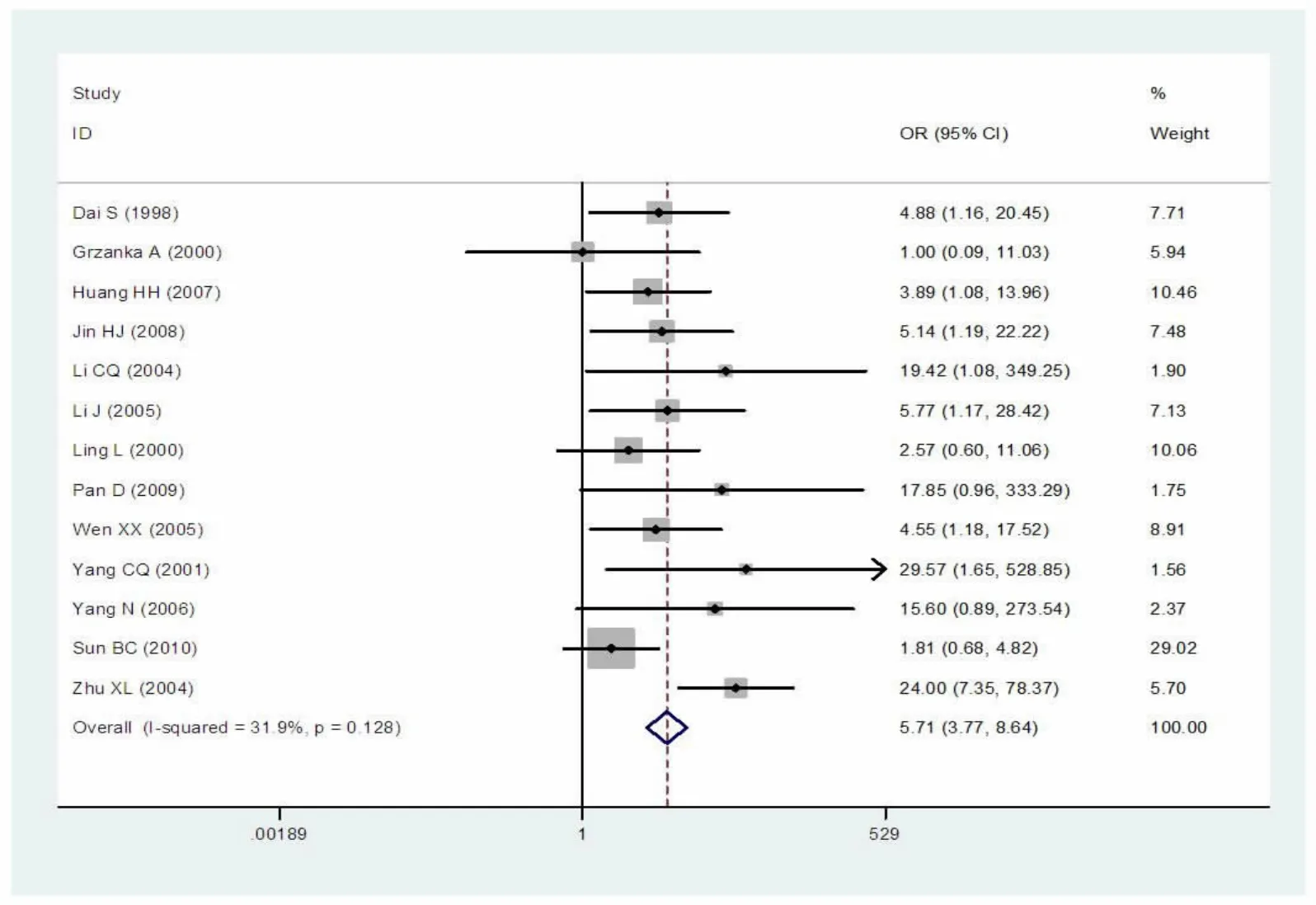
图2 淋巴结转移组与无淋巴结转移组PCNA阳性率对比的森林图
4 临床分期III/IV组与I/II组中PCNA阳性率的对比
经异质性检验I2=25.3%,P=0.195,表明异质性较小,因此该研究选择固定效应模型。Meta分析结果显示:Z=8.17,OR=4.32,95%CI为3.04~6.14,P<0.0001,III/IV组PCNA的阳性率明显高于I/II组,表明PCNA的过度表达与喉鳞癌的预后不良密切相关(图3)。
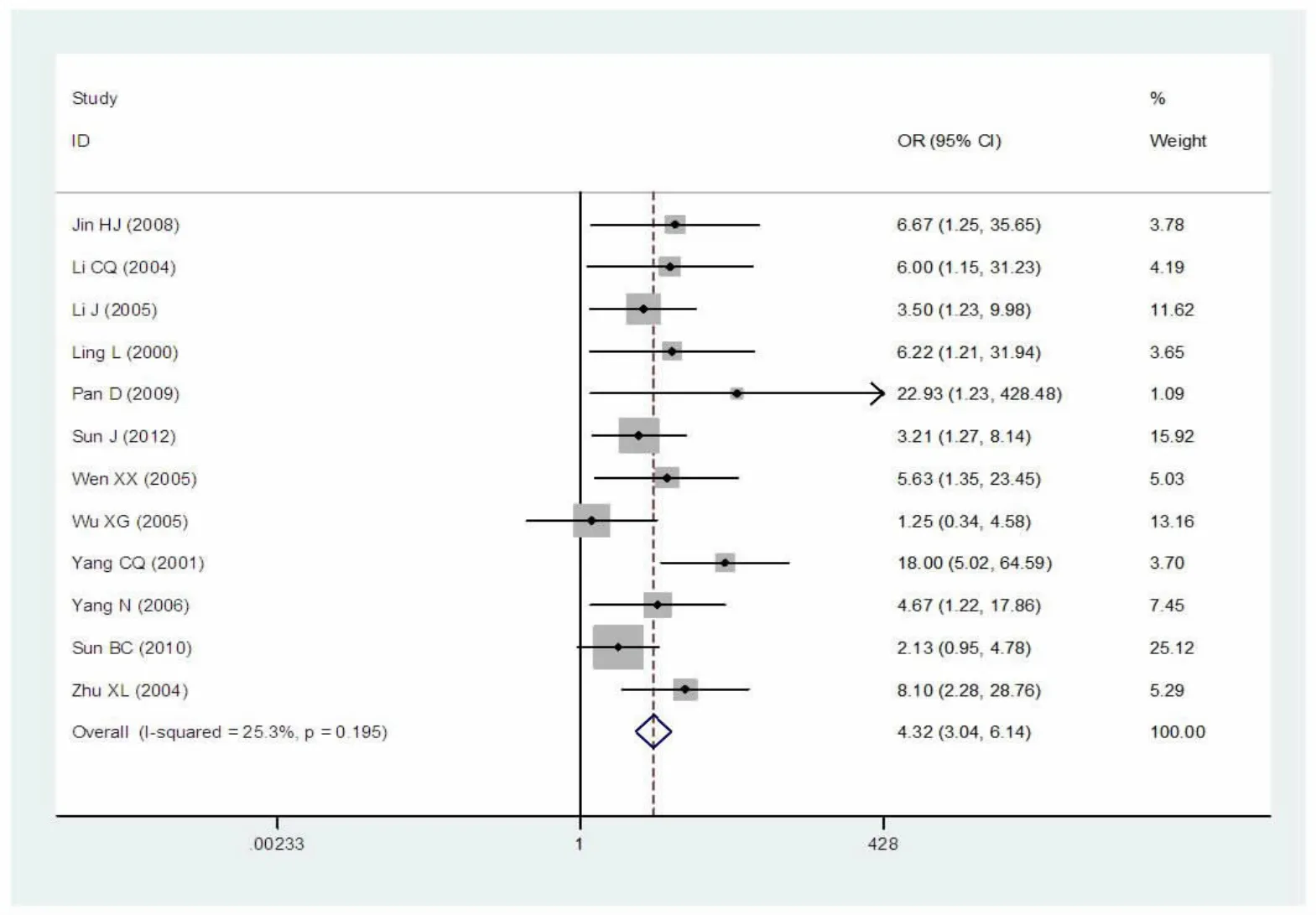
图3 临床分期III/IV组与I/II组PCNA阳性率对比的森林图
5 中低分化组与高分化组中PCNA阳性率的对比
经异质性检验I2=0%,P=0.734,表明不存在异质性,因此该研究选择固定效应模型。Meta分析结果显示:Z=9.13,OR=5.89,95%CI为4.02~8.61,P<0.0001,中低分化组中PCNA的阳性率明显高于高分化组,表明PCNA的过度表达与喉鳞癌组织的恶性程度密切相关(图4)。
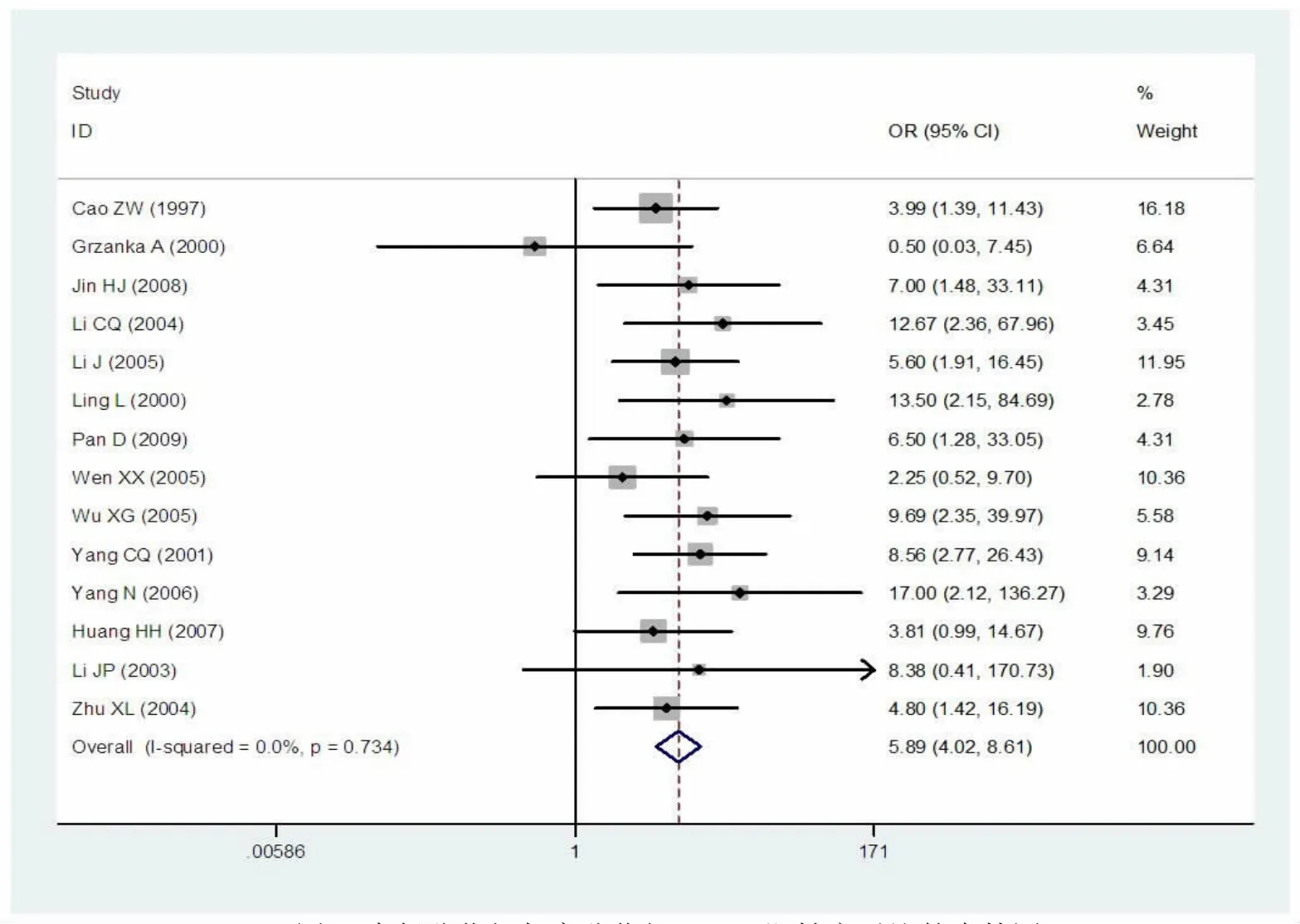
图4 中低分化组与高分化组PCNA阳性率对比的森林图
6 敏感性分析
由于在喉癌组与对照组的研究中存在较大的异质性,因此需要对该研究进行敏感性分析,结果发现该研究meta分析的结论稳定可靠(图5)。
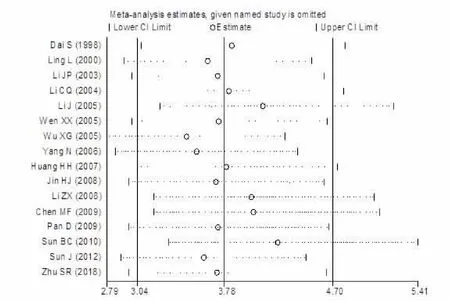
图6 喉癌组与正常对照组PCNA阳性率对比的敏感性分析
讨论
几十年来,增殖细胞核抗原(PCNA)作为参与DNA复制、修复、染色质动力学和细胞周期调控的因子,提供多价相互作用,充当DNA交易的中心协调器[23,24]。PCNA能够参与肿瘤的进展,在某些肿瘤中有高度的表达。一些研究表明PCNA在肿瘤的临床分期和病理分级中有重要作用[25,26]。因此,我们需要进一步了解PCNA在肿瘤患者分期、分级及预后中的作用,为临床制定有效的治疗策略提供依据。
在此基础上,本研究通过应用Meta分析的手段来进一步明确PCNA与喉鳞癌发病及临床病理特征的相关性。Meta分析结果表明:喉鳞癌组中PCNA的阳性率明显高于正常对照组(Z=10.07,OR=13.22,95%CI为8.00~21.85,P<0.0001);有淋巴结转移组中的PCNA阳性率明显高于无淋巴结转移组(Z=8.25,OR=5.71,95%CI为3.77~8.64,P<0.0001);临床分期中,III/IV组的PCNA阳性率明显高于I/II组(Z=8.17,OR=4.32,95%CI为3.04~6.14,P<0.0001);病理分级中,中低分化组的PCNA阳性率明显高于高分化组(Z=9.13,OR=5.89,95%CI为4.02~8.61,P<0.0001)。以上结果均表明PCNA的过度表达在喉鳞状细胞癌的发病过程中发挥了重要作用,且与喉癌患者的预后密切相关,PCNA的表达越高,预后越差,在一定程度上为喉鳞状细胞癌患者的临床治疗及预后的评估提供了循证医学证据。同时,我们对在异质性检验中存在较大异质性的研究进行了敏感性分析,分析发现代表各个纳入文献的圈均在两条边线以内,这表明Meta分析的结论稳定可靠。
同样的,本研究也存在一定的局限性:纳入文献均为回顾性研究,质量没有前瞻性研究高,某些研究的样本量较小,文献质量不高。研究过程中只是纳入了相应组别的数据,而并未将人口及地域差异考虑在内,某种程度上可能会导致偏倚的产生。在设置正常对照组时,某些研究将喉癌旁组织作为对照组,而另一部分研究则将喉正常黏膜作为对照组,其对照基线并不一致。同时,本研究还受制于语言的限制,可能导致纳入的文献不全。总之,在未来我们还需要进行更多高质量多病例多中心的研究来证实本Meta分析的结论。

