二妙散主要成分盐酸小檗碱与白术内酯Ⅲ对脂多糖诱导的BV2小胶质细胞炎性活化的影响
易慧敏,陆韵薇,许孟秋,于顾然
(南京中医药大学附属医院, 江苏 南京 210029)
多发性硬化是最常见的炎症性脱髓鞘疾病之一,是发生于中枢神经系统的一种慢性的自身免疫疾病,主要累及脑室周围白质、视神经、脊髓、脑干及小脑等[1]。多发性硬化常于青壮年起病,影响全球约280万人,患病后反复发作,是成年人致残的原因之一[2-4]。多发性硬化属于中医“痿证”范畴,《素问·生气通天论》:“湿热不攘,大筋软短,小筋弛长,软短为拘,弛长为痿。”提示湿热是痿证主要病机之一。现代医学对于多发性硬化的治疗主要是调节或抑制免疫的疾病修饰治疗,有不错的疗效但多有一定的不良反应[5]。中药治疗多发性硬化的疗效已在诸多实验中得以证明,包括抑制免疫、对抗炎症、保护神经功能等[6-7]。2018年《多发性硬化/视神经脊髓炎中医临床诊疗规范》[8]将以黄柏、苍术为基本药对的二妙散或四妙丸作为治疗多发性硬化或视神经脊髓炎湿热证的推荐用药。其中小檗碱是黄柏的主要入血成分,而苍术的成分白术内酯Ⅱ入血能够转化成白术内酯Ⅲ(苍术内酯Ⅲ)[9-10]。据此,本实验以脂多糖(LPS)激活小鼠BV2小胶质细胞活化产生炎症反应为多发性硬化模型,探讨小檗碱和白术内酯Ⅲ配伍对脑小胶质细胞活化炎症反应的作用及其机制,以揭示二妙散治疗多发性硬化的机制。
1 实验材料与方法
1.1细胞 小鼠脑BV2小胶质细胞株购自上海中乔新舟生物科技有限公司。
1.2试剂 磷酸盐缓冲液(PBS,美国Gibco公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,Sigma公司);二甲基亚砜(DMSO, Sigma公司);DMEM/F12培养液、 胎牛血清;三抗(美国Gibco公司);SDS-PAGE凝胶制备试剂盒、 0.25%胰蛋白酶(碧云天生物科技有限公司);LPS(Sigma公司);环氧化酶-2(COX-2)、诱导型一氧化氮合酶(iNOS)、Toll样受体4(TLR4)、肿瘤坏死因子-α(TNF-α)、髓样分化因子(MyD88)单克隆抗体(Proteintech公司);β-actin单克隆抗体(美国Cell Signaling Technology公司);二抗兔抗及鼠抗(福麦斯生物技术有限公司);ECL超敏发光剂(COOLABER公司);白术内酯Ⅲ(成都曼思特生物科技有限公司,批号:MUST19101114);盐酸小檗碱(成都曼思特生物科技有限公司,批号:MUST19072501);Resatorvid (TAK-242,TLR4信号传导抑制剂,MedChemExpress公司,批号:10568)。
1.3主要仪器 C150型CO2培养箱(德国BINDER);M3型多功能酶标仪(美国BioTek);纯水仪(Thermo);精密天平仪(浙江凯丰集团有限公司);水浴箱;AC2-4S1型生物安全柜(新加坡ESCO);三目倒置显微镜(OLYMPUS,日本);BX43型正置荧光显微镜(日本OLYMPUS);制冰机(日本Panasonic);Western电泳仪(Bio-rad)、ImageLab凝胶成像系统(Bio-rad);96孔细胞培养板、12孔细胞培养板、6孔细胞培养板、细胞培养皿(Corning公司)。
1.4细胞培养 BV2小胶质细胞用内含1%链霉素、两性霉素及青霉素、10%胎牛血清、90%DMEM/F12培养液置于37 ℃、5%CO2培养箱中培养,待细胞长至铺满皿底90%时,用0.25%胰蛋白酶消化并进行传代,选取对数生长期细胞进行实验。
1.5细胞分组及药物处理 将BV2小胶质细胞均匀接种于6孔细胞培养板中,待细胞长至铺满皿底80%时,弃去原培养液,更换新鲜DMEM/F12培养液,参考文献[11-12]相关实验方案,实验分为正常对照组、LPS模型组(LPS 1 μg/L)、盐酸小檗碱组(10 μmol/L盐酸小檗碱+1 μg/L LPS)、白术内酯Ⅲ组(1 μmol/L白术内酯Ⅲ+ 1 μg/L LPS)、盐酸小檗碱+白术内酯Ⅲ组(10 μmol/L盐酸小檗碱+1 μmol/L白术内酯Ⅲ +1 μg/L LPS)、Resatorvid组(10 μmol/L TLR4抑制剂+1 μg/L LPS),各组内加入相应的药物预保护细胞2 h,然后于LPS模型组、盐酸小檗碱组、白术内酯Ⅲ组、盐酸小檗碱+白术内酯Ⅲ组、Resatorvid组内分别加入1 μg/L LPS,于培养箱中孵育24 h后进行各项指标检测。
1.6检测指标及方法
1.6.1MTT法检测BV2小胶质细胞活性 选取培养至对数生长期的BV2小胶质细胞,用胰酶消化,离心重悬计数,重悬后均匀铺于96孔细胞培养板中,每孔目标数取8×103个,每孔加入100 μL培养基+100 μL细胞混悬液,待细胞长至铺满皿底80%时吸弃原培养液,按照“1.5”方法分组及药物处理后,每孔加入20 μL MTT(5 mg/mL)继续培养4 h,弃尽原培养液,加入150 μL DMSO,置振荡仪上避光震荡10 min,使用酶标仪测定490 nm波长的A值,计算各组细胞存活率:细胞存活率(%)=处理组A值/正常对照组A值×100%。
1.6.2Western-blot法检测BV2小胶质细胞中相关蛋白表达情况 取对数生长期的BV2小胶质细胞胰酶消化,离心重悬后均匀接种于6孔细胞培养板中,分组及药物处理同“1.5”,待LPS激活24 h后取出培养皿置冰上,用4 ℃的PBS洗3次,每次均吸尽清洗液,后加入100 μL蛋白裂解液(RIPA原液∶蛋白酶抑制剂∶磷酸酶抑制剂∶PMSF=100∶1∶1∶1)充分裂解15 min,将裂解后的混悬液移至0.5 mL EP管内进行冰上超声裂解3次,每次15 s,两次裂解之间间隔10 s。将装有裂解后混悬液的EP管置于预冷4 ℃的离心机12 000 r/min离心20 min,取上清液并加入5×SDS上样量缓冲液,高温蛋白变性10 min,以BCA法测蛋白浓度。根据蛋白浓度测算蛋白电泳上样体积,进行蛋白电泳并转膜,将PDVF膜在室温下置于5%BSA中摇床封闭1 h,将封闭后的PDVF膜根据蛋白体积需要进行裁剪。将各条带置于一抗中4 ℃孵育过夜,TBST洗膜10 min×3次,室温下摇床孵育二抗1 h,TBST洗膜10 min×3次,采用ECL化学发光法曝光显影,使用Image Lab软件进行图像分析并统计。
1.6.3Griess法检测BV2小胶质细胞中一氧化氮(NO)浓度 按照“1.4”之法培养BV2细胞后均匀接种于6孔板中,细胞贴壁后实验分组及药物处理同“1.5”,分别收集各孔细胞上清液,严格按照NO检测试剂盒说明书进行测定:用BV2小胶质细胞的完全培养基作为稀释液稀释原始浓度为1 mol/L的标准品溶液NaNO2制作标准曲线。按150 μL/孔,在96孔板中加入各浓度的对照品溶液及样品50 μL,Griess Reagent Ⅰ液及Ⅱ液各50 μL,于37 ℃培养箱中孵育10 min。振荡器上震荡5 min 后于酶标仪540 nm 处测定记录各孔OD值,根据标准曲线计算NO浓度。
1.6.4免疫荧光法检测BV2小胶质细胞中NF-κB p65入核情况 取对数生长期的BV2小胶质细胞胰酶消化,离心重悬后以5×104/mL密度均匀接种于预先置入无菌细胞爬片的12孔细胞培养板中,分组同“1.5”,细胞贴壁后以相应的药物预保护12 h后,再给予LPS刺激24 h。弃上清后,用4%多聚甲醛固定 30 min,PBS清洗3遍,0.1%Triton X-100处理15 min,5%BSA室温封闭1 h;于4 ℃p65一抗(1∶500)孵育过夜,次日荧光二抗(1∶1 000)常温孵育1 h;DAPI核染5 min,抗荧光淬灭剂封片后,荧光显微镜下采集图片。

2 结 果
2.1各组BV2小胶质细胞活力比较 LPS模型组、盐酸小檗碱组、白术内酯Ⅲ组、盐酸小檗碱+白术内酯Ⅲ组BV2小胶质细胞活性分别为(113.01±8.36)%、(100.13±8.57)%、(107.13±7.78)%、(99.80±8.06)%,盐酸小檗碱组、白术内酯Ⅲ组、盐酸小檗碱+白术内酯Ⅲ组BV2小胶质细胞活力与正常对照组比较差异均无统计学意义(P均>0.05)。
2.2各组BV2小胶质细胞中TNF-α、iNOS、MyD88、TLR4、COX-2蛋白表达情况比较 LPS模型组BV2小胶质细胞中TNF-α、iNOS、MyD88、TLR4、COX-2蛋白表达水平均明显高于正常对照组(P均<0.05);盐酸小檗碱组、白术内酯Ⅲ组、盐酸小檗碱+白术内酯Ⅲ组、Resatorvid组BV2小胶质细胞中TNF-α、iNOS、MyD88、TLR4、COX-2蛋白表达水平均明显低于LPS模型组(P均<0.05),盐酸小檗碱+白术内酯Ⅲ组和Resatorvid组的水平均明显低于盐酸小檗碱组、白术内酯Ⅲ组(P均<0.05)。见图1及图2。
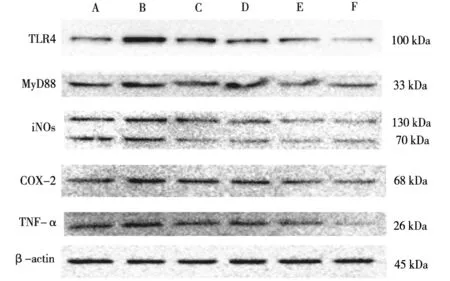
A为正常对照组;B为LPS模型组;C为盐酸小檗碱组;D为白术内酯Ⅲ组;E为盐酸小檗碱+白术内酯Ⅲ组;F为Resatorvid组
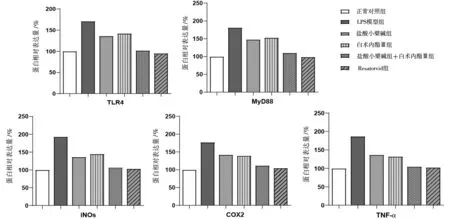
图2 各组BV2小胶质细胞中TNF-α、iNOS、MyD88、TLR4、COX-2蛋白表达情况
2.3各组BV2小胶质细胞中NO浓度比较 LPS模型组BV2小胶质细胞中NO浓度明显高于正常对照组(P<0.05);盐酸小檗碱组、白术内酯Ⅲ组、盐酸小檗碱+白术内酯Ⅲ组、Resatorvid组BV2小胶质细胞中NO浓度明显低于LPS模型组(P均<0.05),盐酸小檗碱+白术内酯Ⅲ组和Resatorvid组的浓度均明显低于盐酸小檗碱组、白术内酯Ⅲ组(P均<0.05)。见图3。
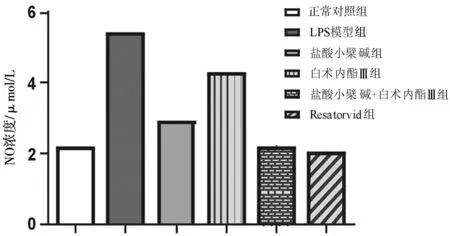
图3 各组BV2小胶质细胞中NO浓度比较
2.4各组BV2小胶质细胞激活后NF-κB p65入核情况比较 LPS模型组NF-κB p65入核率明显高于正常对照组(P<0.05);盐酸小檗碱组、白术内酯Ⅲ组、盐酸小檗碱+白术内酯Ⅲ组、Resatorvid组NF-κB p65入核率明显低于LPS模型组(P均<0.05),盐酸小檗碱+白术内酯Ⅲ组和Resatorvid组的入核率均明显低于盐酸小檗碱组、白术内酯Ⅲ组(P均<0.05)。见图4及图5。

图4 各组BV2小胶质细胞中NF-κB p65入核情况(免疫荧光法)

图5 各组BV2小胶质细胞中NF-κB p65入核率比较
3 讨 论
多发性硬化的发病机制复杂,可能与自身免疫反应、环境、基因遗传、病毒感染、肠道屏障损伤等因素有关。小胶质细胞在多发性硬化的发病中扮演着重要角色,其中极化的外周CD4+T细胞刺激B细胞、CD8+细胞、肥大细胞、粒细胞和单核细胞等免疫细胞及其分泌的促炎细胞因子可穿过血脑屏障激活小胶质细胞,促进脑内炎性因子释放,从而加重脑内炎症[13]。另外反应性T细胞可以通过硬脑膜窦与外周淋巴管相通进入中枢神经系统,激活小胶质细胞[14]。目前研究表明,小胶质细胞遇到LPS或IFN-γ时,受到激活而活化,由细胞的免疫受体(如Toll样受体)识别,通过TLR4/NF-κB、MAPK、JAK/STAT等信号通路产生诱发炎症的细胞因子,如TNF-α、IL-6、COX-2等,并与同样分泌促炎细胞因子的T细胞相互作用,进一步加重炎症,共同促进脱髓鞘形成[15]。
小胶质细胞活化产生的炎症反应在多发性硬化的发病中起着关键性作用,这一过程常用来模拟多发性硬化的发生过程,构建多发性硬化的体外细胞模型。其中TLR4/ NF-κB信号通路是经典的促炎信号通路之一,可被各种致炎因素激活,增加NF-κB在细胞因子、趋化因子和黏附分子等其他促炎基因中的表达[16]。该信号通路的促炎经典途径可由LPS等因素来诱导。小胶质细胞表达的TLR4可特异性识别LPS,激活依赖于MyD88的细胞内信号,进而激活 IKK。IKK可介导Iκb -α在Ser32和36位点上的磷酸化,导致其降解,使p50/p65 NF-κB二聚体进入细胞核,激活炎症相关的基因转录[17]。被此种方式活化的小胶质细胞能量代谢方式发生变化,表达出高水平的iNOS,产生一氧化氮(NO),导致中枢神经系统的细胞损伤[18-19]。故本次实验以LPS激活BV2小胶质细胞模拟多发性硬化患者中枢神经系统脱髓鞘时小胶质细胞激活的情况,来探索二妙散主要成分盐酸小檗碱与白术内酯Ⅲ对小胶质细胞活化产生的炎症反应的影响,并通过TLR4/NF-κB通路研究其可能机制。
本实验通过MTT法证实盐酸小檗碱与白术内酯Ⅲ对BV2小胶质细胞无明显毒性作用;Western-blot法、Greisse法、免疫荧光染色法发现仅有LPS激活的模型组BV2小胶质细胞中TNF-α、iNOS、MyD88、TLR4、COX-2蛋白表达量及NO浓度、NF-κB p65入核率均明显高于正常对照组,提示经LPS孵育后BV2小胶质细胞及细胞中的TLR4/ NF-κB信号通路均被激活;而经盐酸小檗碱与白术内酯Ⅲ预处理后,LPS孵育的BV2小胶质细胞中TNF-α、iNOS、MyD88、TLR4、COX-2蛋白表达量及NO浓度、NF-κB p65入核率均明显降低,其中以两种单体同时使用时降低更明显,用TLR4抑制剂Resatorvid预处理也能产生相似的效果,提示盐酸小檗碱与白术内酯Ⅲ能够抑制LPS诱导BV2小胶质细胞中NF-κB信号通路激活引起的炎症反应及细胞毒作用,且两种单体共同使用时比单独使用效果更佳。
综上所述,二妙散主要成分盐酸小檗碱与白术内酯Ⅲ可通过调控TLR4/NF-κB炎症相关信号通路来减少被LPS激活的BV2小胶质细胞产生的促炎细胞因子及细胞毒性物质,从而抑制炎症反应,减轻中枢神经细胞损伤,阻止中枢神经进一步脱髓鞘,进而延缓多发性硬化的疾病进程,且盐酸小檗碱与白术内酯Ⅲ两种单体合用产生的抑制效果较单用一种单体佳,这为二妙散组方治疗多发性硬化提供了一定的理论依据。
利益冲突:所有作者均声明不存在利益冲突。

