基于网络药理学探讨清肠温中方治疗溃疡性结肠炎的作用机制
王 依,李军祥,刘豫玥
(1. 北京中医药大学,北京 100029;2. 北京中医药大学东方医院,北京 100078)
溃疡性结肠炎(ulcerative colitis,UC)是一种病因未明的炎症性肠病(infIammatory boweI disease,IBD),以局限在结直肠黏膜层的连续性、弥漫性炎症改变为特点,临床表现腹痛、腹泻、黏液脓血便为主,UC发病高峰年龄为15~40岁中青年,病情反复发作,为终身性疾病,严重影响患者生活质量,被世界卫生组织列为现代难治病之一,也是目前消化领域的研究热点[1]。研究发现,亚洲人群中UC患者在10年、20年、30年溃疡性结肠炎相关性结肠癌(ulcerative colitis associated colon cancer,UC-CRC)累积发病率分别为0.02%,4.81%,13.91%,UC-CRC的患病率为0.85%,虽然较西方人群低,但仍高于一般人群结直肠癌发病率[2]。由于UC病因尚不明确,难以根治,越来越多的研究者将目光转向中医药,希望发挥中医药的优势寻找另一条安全、有效的治疗方法。清肠温中方(黄连、炮姜、苦参、青黛、木香、三七、地榆、甘草)是中国中西结合消化协会主席、北京中医药大学东方医院消化内科主任李军祥教授治疗UC的经验方,其在缓解患者临床症状、改善中医证候、提高患者的生活质量、降低疾病的活动度、改善及修复肠黏膜等方面具有良好疗效[3-4]。前期通过动物实验也证实清肠温中方对于葡聚糖硫酸钠(DSS)溶液诱导的UC模型小鼠,可以起到促进机体抗氧化、抑制氧化作用,以减轻小鼠氧化应激反应从而起到治疗作用[5]。从上述各项研究可以看出清肠温中方治疗UC疗效肯定,具有较好的应用和开发前景,但基于以往对清肠温中方的研究多从单个角度进行,缺乏系统的研究,未能反映出中药特别是中药复方所具有的多成分、多靶点、多作用通路协同发挥作用的特点,现为了进一步揭示清肠温中方潜在的作用机制,欲应用网络药理学方法,从整体和系统角度出发探索复方与疾病之间的关系,对清肠温中方治疗UC的机制进行探讨,以期为进一步实验研究及临床用药提供一定理论依据。
1 资料与方法
1.1清肠温中方有效化学成分及靶点查找 通过TCMSP数据库(https://tcmspw.com/)检索清肠温中方组方中药的所有化学成分,由于TCMSP系统及中国天然产物化学成分库未查找到与炮姜有关的成分靶点,以化学成分近似的干姜代替[6],并以口服生物利用度(OB)阈值≥30%,化合物类药性(DL)值≥0.18[7]作为化合物筛选条件,选取有用化学成分及对应靶点。将通过TCMSP数据库检索到的复方化学成分对应的靶点导入UniProt数据库(https://www.uniprot.org/),检索时限定物种为人类,剔除非人类来源的靶点,并将所有靶点名称校正为规范名称,所得到的靶点即为UC对应的人类靶点。
1.2疾病的对应靶点及复方与疾病交集靶点的预测 以“Ulcerative Colitis”为关键词通过GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)数据库检索UC对应的靶点,将2个数据库得到的靶点导出到excel文档,通过制作韦恩图将得到的复方靶点与UC靶点取交集,交集部分即为该复方治疗UC时的有用靶点,而这些有用靶点对应的化学成分即为清肠温中方最终发挥作用的药理基础。
1.3“复方-化学成分-靶点-疾病”交互网络及蛋白互作网络的构建 利用Cytoscape软件将清肠温中方有效化学成分及靶点与UC的关系构建成交互作用网络,并根据cytoHubba App以Closeness、MCC、Degree指标的Top 50 nodes 为筛选条件,对每个点的进行拓扑分析,将相互作用网络进行可视化,得到核心化学成分。将交集靶点输入String数据库(https://string-db.org/),设定物种为“human species”,选定得分score大于0.7(high confidence)绘制蛋白互作图(PPI);将PPI相互作用网络以TSV文件输出,利用R软件对文件进行分析,以各靶点相互作用频次进行计数,出现频率越大则表明靶点与其他靶点之间联系最多、作用越大。
1.4GO生物功能及生物通路富集分析 运用基因注释工具 Metascape(https://metascape.org/)将清肠温中方与UC相关作用靶点进行GO生物功能及KEGG生物通路富集分析,分析时设定物种为“H Sapiens”、P≤0.01,富集结果最多显示前20条(每个群集选取一条关联度最高的通路),预测清肠温中方参与治疗UC时的主要生物功能及信号通路,分析相关作用机制。
2 结 果
2.1清肠温中方有效化学成分及与UC相关靶点通过TCMSP数据库检索清肠温中方全方,以OB、DL指定阈值作为筛选条件,剔除相同重复的化学成分及靶点后得到有效化学成分174个及相对应作用靶点277个,将上述277个靶点导入UniProt进行人类靶点匹配,经过剔除重复数值最终得到靶点124个;通过Genecard及TTD网站查共找到与UC相关靶点4 356个,通过韦恩图将清肠温中方中药复方靶点与UC靶点取交集,得到81个与UC相关的潜在靶点,根据所得到得81个靶点寻找到最终复方发挥作用的有效成分125个。复方最终发挥作用的81个靶点名称为PTGS1、ACHE、RB1、ERBB2、BIRC5、NFE2L2、IGFBP3、GSK3B、IKBKB、ESR1、RELA、IL-6、CYP3A4、DUOX2、NQO1、IGF2、HPSE、CASP1、AR、EGFR、CASP3、CAV1、NOS3、PARP1、IRF1、CD44、PSMG1、PRSS1、VEGFA、NFKBIA、MYC、HSPB1、AHR、ERBB3、MDM2、MAPK8、HTR3A、CCND1、CASP8、CYP1A1、MGAM、CHEK2、PON1、PCNA、MAPK10、NR3C2、BCL2、RAF1、ICAM1、CYP1B1、CRP、NPEPPS、CASP7、FASN、ESR2、FOS、PRKCA、SELE、CCNB1、RUNX2、GSTM1、MCL1、APOB、PPARG、CASP9、HIF1A、VCAM1、ALOX5、RASSF1、CHEK1、TYR、ABCC1、AKR1B1、PLAU、RUNX1T1、PTGER3、GSTP1、CTSD、NR3C1、RXRB、AKR1C1。交集靶点韦恩图见图1。

图1 清肠温中方与溃疡性结肠炎交集靶点韦恩图
2.2复方-化学成分-靶点-疾病网络图 采用Cytoscape软件将中药复方、复方有用的125个化学成分、81个靶点与疾病构建成交互作用网络图。图中红色代表UC,蓝色代表清肠温中方,黄色代表复方成分节点,绿色代表复方与UC相关的作用靶点,即是复方治疗UC的关键靶点,线条代表各因素之间的相互关系。网络图中共涉及208个节点,923条边,节点连接的线条越多表明该节点作用越大,见图2。通过复杂的相关关系网可知,该复方治疗UC时具有多靶点、多环节调节的特点。根据cytoHubba App以Closeness、MCC、Degree指标的Top 50 nodes 为筛选条件,对网络进行可视化,得到复方中主要发挥作用的成分以槲皮素、木犀草素、山柰酚等为主,见表1。
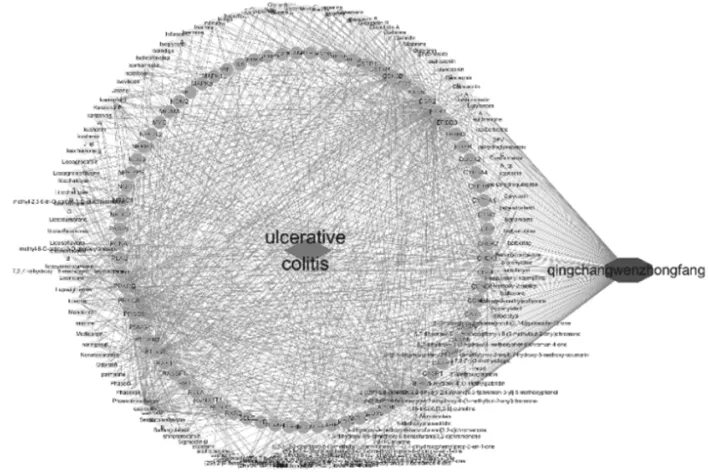
图2 药物-活性成分-靶点-疾病网络图
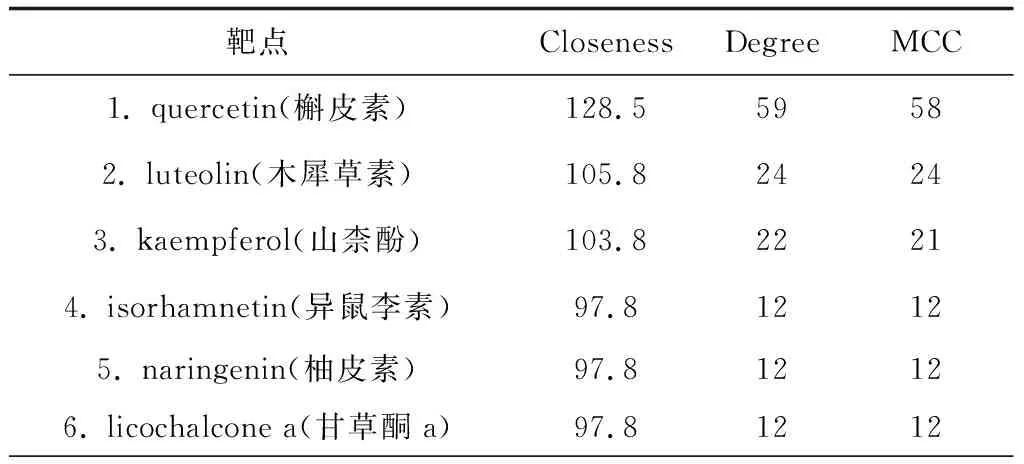
表1 核心化学成分
2.3PPI网络的构建及核心基因的筛选 将复方与UC相关的81个靶点导入String数据库,设定物种查找范围为“人类”,并将阈值设为高置信度(mediumconfidence≥0.7)获取PPI作用网络图(见图3),作用网络中包含81个靶点节点,313条相互作用边,平均作用节点7.73个。将结果输出为TSV文件后,通过R软件对TSV文本进行分析,得到包括CASP3、IL-6、VEGFA、EGFR、MAPK8在内关联性最强的前30位靶点,见图4,其中纵坐标代表靶点名称、横坐标数值代表每个靶点出现的频率。

图3 蛋白靶点相互作用图

图4 清肠温中方与UC密切相关的前30位核心靶点
2.4生物通路富集分析 将清肠温中方潜在的81个靶点进行GO生物功能及KEGG信号通路富集分析。GO分析结果1 182条,包括细胞成分(cellular components)、分子功能(molecular functions)、生物过程(biological processes)3个模块,分析结果显示:细胞成分GO分析条目52条,主要包括膜筏、质膜蛋白复合体、转录因子复合体、丝氨酸/苏氨酸蛋白激酶复合体、囊腔、髓鞘、蛋白-DNA复合体等;分子功能GO分析条目96条,主要包括调节激酶结合转录因子结合体活性、参与凋亡过程的半胱氨酸型内肽酶活性、蛋白激酶活性、氧化还原酶活性、蛋白质同源二聚活性、激酶调节活性以及与泛素样蛋白连接酶结合、蛋白结构域特异性结合、抑制转录因子结合、Hsp90蛋白结合、雌激素受体结合等;生物过程GO分析条目1 034条,主要包括对无机物质、类固醇激素、异种刺激、紫外线、酮、脂多糖、对酸性化学物质、创伤的反应、细胞外刺激、氧水平等的反应及参与凋亡信号通路、细胞因子介导的信号通路、DNA结合的转录因子活性、细胞死亡等过程。与3种模块关系最为密切分析结果见图5~7,图中颜色深浅代表GO条目出现的频率,出现次数越多颜色越深,-log10(P)越大,代表P值越小,表明该条目作用越大。
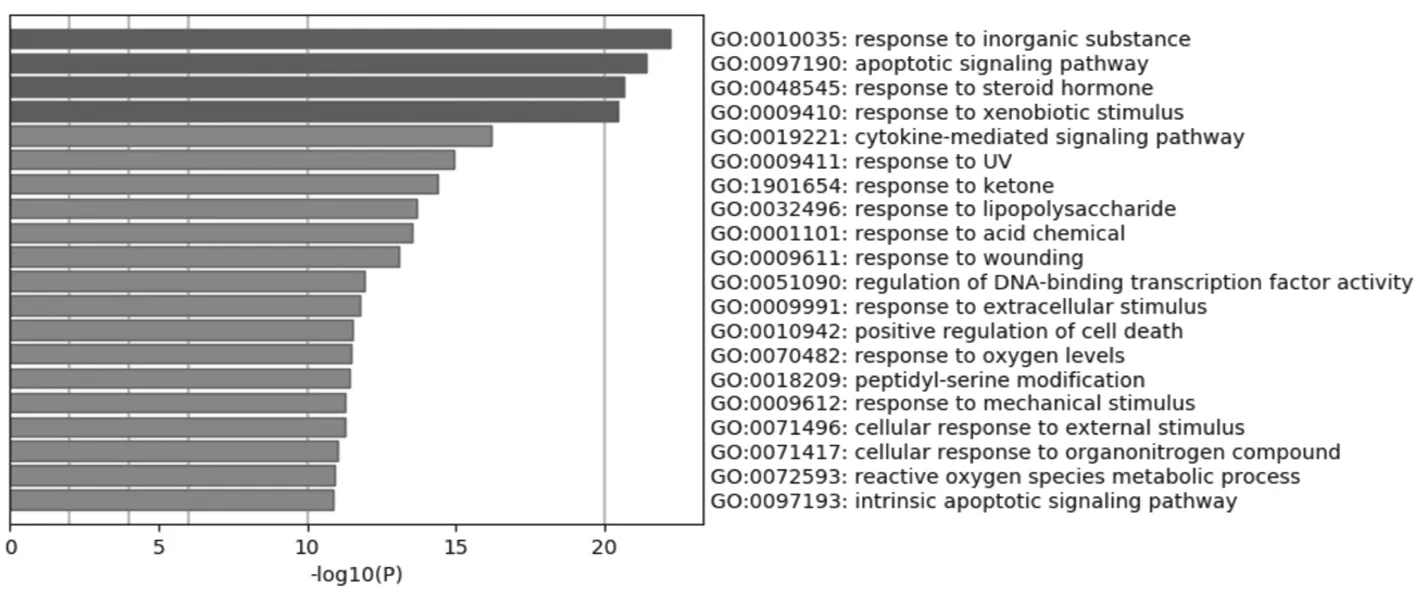
图5 生物过程GO分析

图6 分子功能GO分析
通过KEGG分析得到信号通路117条,将得到的主要生物信号通路根据作用大小及每条通路包含的基因数做成气泡图(见图8),其中颜色代表pvalue(校正后的P值),颜色越深表示P值越小,作用越大,圆形大小代表每条通路中包含的靶点数量,面积越大表示包含的靶点越多。由图中结果可见,KEGG分析的结果表示清肠温中方主要包括参与调控癌症途径、HTLV-I感染、HIF-1信号通路、NF-κB信号通路、VEGF信号通路、细胞色素P450对异生物的代谢、Jak-stat信号通路、胆碱能突触等。这些通路大多与炎症反应相关,表明清肠温中方主要通过影响炎症相关通路进而发挥治疗溃疡性结肠炎的作用。
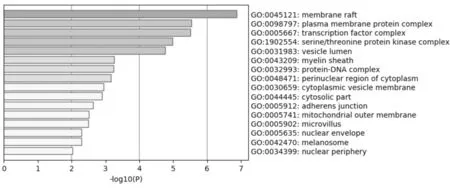
图7 细胞组成GO分析

图8 KEGG通路分析预测药物对治疗溃疡性结肠炎的可能
3 讨 论
本研究筛选出清肠温中方125个活性成分及81个潜在靶点,与清肠温中方关联度较大的化学成分有槲皮素、木犀草素、山柰酚、异鼠李素、柚皮素、甘草酮a等,这些成分可能为清肠温中方治疗UC的主要药效物质基础,其中槲皮素和木犀草素的研究最为广泛。调节炎症是槲皮素最核心最显著的作用之一[8],多项研究表明槲皮素可在体内外通过抑制炎症细胞因子的形成从而发挥抗炎症作用[9-10];且有研究证实,槲皮素可显著抑制IL-6、MCP1、IP-10、TNF-α、LIF、LIX等因子产生发挥抗UC作用[11]。而木犀草素除了调节氧化应激反应、细胞因子外,还能够通过参与花生四烯酸代谢途径、NF-κB信号通路、JAK-STAT 信号通路等多种途径缓解炎症反应[12]。李越等[13]通过使用不同浓度的木犀草素处理经DSS诱导的UC小鼠,发现木犀草素能改善实验性UC小鼠症状,可能与抑制促炎因子TNF-α、IL-6的表达,增强结肠抗氧化活性,调控氧化/抗氧化平衡有关。而大多数通过筛选出来的清肠温中方活性成分在与UC相关的研究中报道较少,且大部分活性成分未见报道,值得深入研究。
通过网络可视化后81个靶点中以CASP3、IL-6、VEGFA、EGFR、MAPK8等发挥主要作用。UC的发生与细胞凋亡密切相关[14-15],肠黏膜细胞大量凋亡可造成肠黏膜通透性增加, 同时伴随着未成熟隐窝的过度增生,均可能导致肠道屏障功能的破坏,并引发肠道炎症、溃疡及肠道功能紊乱[16-17]。CASP3属于Caspase蛋白家族中的一员,是细胞凋亡的关键执行者,当细胞接受凋亡刺激时,它被系列反应激活,进而诱导细胞发生凋亡[18-19]。多项研究表明UC大鼠/小鼠肠黏膜中CASP3含量显著升高,且经有效药物治疗后,CASP3表达水平下调, 结肠细胞凋亡率明显下降[20-21]。IL-6是一种免疫调节细胞因子,在UC的发病过程中也起重要作用,它的过度表达可以改变肠道通透性,诱导肠黏膜屏障功能障碍[22]。研究表明,活动性UC患者的血清IL-6 水平显著高于非活动性UC患者,并且其水平随着疾病严重程度的增加而显著增加[23]。VEGFA是VEGF主要成员之一,与血管生成密切相关。有研究证实UC患者血清和肠黏膜组织中VEGF表达显著增加[24],而VEGF在UC中表达升高可以激活黏膜内血管内皮细胞的增殖,改善患处组织缺氧、缺血状况[25],因此VEGFA可能是UC的一种保护性因子。其他核心靶点如EGFR、MAPK8等也与UC密切相关,EGFR在结肠黏膜保护及修复过程中起重要作用,而且其表达水平与UC复发密切相关[26];MAPK8功能涉及细胞增殖、细胞分化和细胞凋亡等多种生物过程,UC大鼠肠黏膜中MAPK8高表达[27]。基于核心靶点的功能及作用,可推测清肠温中方治疗UC的作用可能是与降低炎症反应和细胞凋亡,提高内皮细胞增殖及黏膜保护而达到平衡有关。
生物通路分析显示清肠温中方主要通过参与调节癌症途径、HTLV-I感染、HIF-1信号通路、NF-κB信号通路、VEGF信号通路、细胞色素P450对异生物的代谢、Jak-stat信号通路、胆碱能突触等。在本次研究所得信号通路中,HIF-1信号通路及NF-κB信号通路与UC关系的研究较多。炎症部位在缺氧的环境下HIF-1通路被激活,而HIF-1α是该通路的主要调节因子。在UC患者疾病的发生、发展过程中,由于肠上皮细胞的凋亡、再生以及淋巴细胞的增生、代谢均可导致肠黏膜处于缺氧状态,随着炎症进一步发展肠黏膜缺氧程度会不断增加,可能会导致局部病灶部位氧消耗以及氧供应失衡,此时局部病灶部位血清HIF-1α含量显著升高[28]。朱建斌等[29]发现HIF-1α在UC患者活动期的表达显著高于正常人 ,HIF-1α参与UC的发病并且与UC的活动性有关。NF-κB在UC的发生和发展中亦起着重要作用,该通路中经信号通路上游分子激活的NF-κB会促进大量的炎症介质表达,从而引起肠黏膜致炎损伤,而这些炎性介质又进一步活化NF-κB,形成一个正反馈循环,使炎症反应不断放大,肠道炎症反应和黏膜的损伤进一步加重。有研究发现清肠温中方可能通过下调NF-κB的表达,降低炎症因子的激活和释放,修复肠黏膜损伤,达到治疗UC的目的[30-31]。除上述两条通路外,值得一提的是本次研究表明清肠温中方癌症通路的作用极大,说明清肠温中方可能在预防UC癌变的方面起重要作用;同时目前关于细胞色素P450对异生物的代谢通路与UC相关联系的研究较少,但相关研究表明异生物可能干扰免疫生态位的组成部分,导致抗炎通路的激活,并抑制一些炎症介质。因此,异生物可以减少与疾病相关的肠道黏膜改变和临床症状[32],异生物代谢有可能为炎症性肠病及其治疗开辟新的视野。此外,本次研究所发现的胆碱能突触通路尚未见到与UC的相关报道,其可能是清肠温中方治疗UC的重要靶点和信号通路,必要时可行进一步研究验证。
综上所述,网络药理学方法通过从作用成分、核心靶点、信号通路等方面表明清肠温中方在治疗UC时主要从调节炎症因子、细胞免疫、细胞凋亡及预防癌变等方面发挥治疗溃疡性结肠炎的作用;其作用机制并非由单一的成分与通路完成,而是多种生物学过程共同参所致,体现了中药复方多功能、多靶点、多层面、多环节、多途径、多通路调节的作用特点,为临床利用清肠温中方治疗UC提供一定依据。本研究探索的核心靶点及通路可为后续进一步研究该复方作用机制在一定程度上提供参考方向及理论基础。值得注意的是,本研究以理论探索为主,而理论探究基于的各个数据库并非十分完善,所得结果有一定指导意义,但可靠程度需要进一步验证,同时理论上中药发挥作用的有效成分是否与临床或动物实验入血成分一致,有待进一步验证;此外通过网络药理学方法研究所得结果倾向于目前已知的成分和靶点,并不代表所有成分和靶点的药理作用,也不能反应中药复方在体内代谢产物对作用机制的影响,因此本研究结果及结论尚有一定局限性。
利益冲突:所有作者均声明不存在利益冲突。

