三种重组乙型肝炎疫苗异常毒性检查对动物影响的比较*
曹春然 刘洪艳 李雪梅 吴 伟 朱春玥 王佳帅
(北京市药品检验所,国家药品监督管理局仿制药研究与评价重点实验室,中药成分分析与生物评价北京市重点实验室,北京 102206)
乙型肝炎疫苗是我国的计划免疫疫苗,新生儿出生当日需要按规定注射的一类疫苗。《中国药典》2015年版中共收载有三种重组乙型肝炎疫苗:重组乙型肝炎疫苗(汉逊酵母Hansenulaploymorpha)、重组乙型肝炎疫苗(酿酒酵母Saccharomycescerevisiae)和重组乙型肝炎疫苗(CHO细胞)。除药典收载的标准外,疫苗的生产企业也向国家药监部门申请各自的质量控制标准用于控制疫苗的质量。异常毒性检查是疫苗的安全性质量控制指标,目前已批准上市的国产疫苗产品的质量标准中均设有该检查项。《英国药典》2020年版和《欧洲药典》10.0已经取消了异常毒性检查实验,但作为疫苗的安全性考察指标,《中国药典》2020年版四部还继续保留该检查项[1]。本文通过比较三种重组乙型肝炎疫苗对异常毒性检查用实验动物的体质量增长的影响,汇总注射疫苗后动物的状态,考察分别由重组汉逊酵母、重组酿酒酵母和重组CHO细胞表达的乙型肝炎病毒表面抗原(HBsAg)经纯化,加入铝佐剂制成的疫苗对异常毒性检查用动物的影响。
1 材料和方法
1.1 实验动物
ICR小鼠(以下简称小鼠),雄性,购自北京维通利华实验动物公司,实验动物生产许可证号:SCXK(京)2012-0001,SCXK(京)2016-0011;Hartley豚鼠(以下简称豚鼠),雄性,购自北京维通利华实验动物公司,实验动物生产许可证号:SCXK(京)2016-0011;Hartley豚鼠,雄性,购自北京科宇实验动物有限公司,实验动物生产许可证号:SCXK(京)2015-0007。
1.2 实验环境
北京市药品检验所(北京市保健食品化妆品检测中心)动物房,实验动物使用许可证号:SYXK(京)2015-0033。
1.3 仪器
电子天平(TE2101-L),购自德国赛多利斯有限公司。
1.4 药物
重组乙型肝炎疫苗(汉逊酵母),由A公司生产,含HBsAg 20 μg/mL,用法用量为基础免疫每剂10 μg;重组乙型肝炎疫苗(酿酒酵母),由B公司生产,含HBsAg 20 μg/mL,用法用量为基础免疫每剂10 μg;重组乙型肝炎疫苗(CHO细胞),由C公司生产,含HBsAg 20 μg/mL,用法用量为基础免疫每剂10 μg,三种乙型肝炎疫苗均为液体。本研究汇总了2016年3月—2018年2月,三种重组乙型肝炎疫苗的异常毒性检查中的体质量数据,其中包含重组乙型肝疫苗(H.ploymorpha)28 批次、重组乙型肝疫苗(S.cerevisiae)45 批次、重组乙型肝炎疫苗(CHO细胞)102批次及空白对照组61批次的小鼠体质量变化情况,以及重组乙型肝疫苗(汉逊酵母)30批次、重组乙型肝疫苗(酿酒酵母)45批次、重组乙型肝炎疫苗(CHO细胞)101批次及空白对照组38批次的豚鼠体质量变化情况。因本研究的主要目的是对每种疫苗用动物的体质量变化值进行分析,每批次疫苗的批号不是分组的因素,故不分别列出。
1.5 给药和观察
按照《中国药典》2015年版四部附录1141中的要求,每批次疫苗均取体质量为18~22 g的小鼠5只和体质量为250 ~350 g的豚鼠2只,腹腔注射疫苗,给药体积为0.5 mL/只(小鼠)和5 mL/只(豚鼠),同时取同批5只小鼠和2只豚鼠作为空白对照组动物,不做处理,给药后连续观察7 d[2]。动物给药前后的状态观察包括给药后的呼吸、自主活动、口鼻颜色、运动、排泄、死亡等,并测定给药前和给药7 d后的动物体质量。在实验中采用健康成年的动物进行实验,考虑到雌性的性周期对体质量的增长速度有影响,在检查中多选择雄性动物作为实验对象,本研究讨论对雄性动物体质量的影响。
1.6 结果分析
三种重组乙型肝炎疫苗的异常毒性检查实验均在同一时间段内完成,所以将该时间段内的空白对照组动物进行合并,作为空白对照组参与统计比较,数据采用IBM SPSS Statistics 23分析软件进行数据分析:①计算体质量增长值(体质量增长值=给药7 d后体质量-给药前体质量);②对给药前及给药7 d后的体质量及增长值进行数据分布情况的Kolmogorov-Smirnov(n>50)检验,根据结果确定统计分析的方法[3];③将三种疫苗的动物体质量数据进行统计分析。给药前动物的体质量有规定的范围,体质量在范围内即可分为一组,分组未按随机分组原则执行,给药7 d后动物的体质量可作为异常毒性中动物体质量的背景数据。本研究着重考察给药7 d后动物体质量的增长情况,并汇总给药后动物的状态。以下内容,采用汉逊酵母、酿酒酵母和CHO细胞分别代指重组乙型肝炎疫苗(汉逊酵母)、重组乙型肝疫苗(酿酒酵母)和重组乙型肝炎疫苗(CHO细胞)。
2 实验结果
三种疫苗的异常毒性检查结果均符合规定,说明成品中不存在不可控制的有毒物质。
2.1 三种重组乙型肝炎疫苗对雄性小鼠的影响
2.1.1对雄性小鼠状态的影响:实验用小鼠为同一种属和同一来源。三种重组乙型肝炎疫苗的异常毒性检查结果均符合规定,有1批疫苗(酿酒酵母给药组)初试时,5只小鼠中有1只小鼠体质量减轻,经复试10只动物均健康存活,体质量增长,实验中动物未见异常状态,实验结束时均健康存活,体质量增加。经分析认为,可能因实验操作的原因导致动物体质量减轻,故在数据统计时将体质量减轻动物的给药前、后及增长值去除。
2.1.2各组雄性小鼠的体质量数据分布情况:采用Kolmogorov-Smirnov检验对各组雄性小鼠的体质量和体质量及增长值进行数据分布情况的分析,结果显示:给药前各组动物的体质量值分布均不服从正态分布(P<0.05);给药7 d后,体质量数据分布检验结果显示含汉逊酵母组动物的体质量值服从正态分布(P>0.05),其他各组动物的体质量值分布均不服从正态分布(P<0.05);体质量增长值的数据分布检验结果显示汉逊酵母给药和酿酒酵母给药组的体质量增长值分布均服从正态分布(P>0.05),其他各组动物的体质量增长值均不服从正态分布(P<0.05)。各组雄性小鼠体质量的描述见图1和表1。
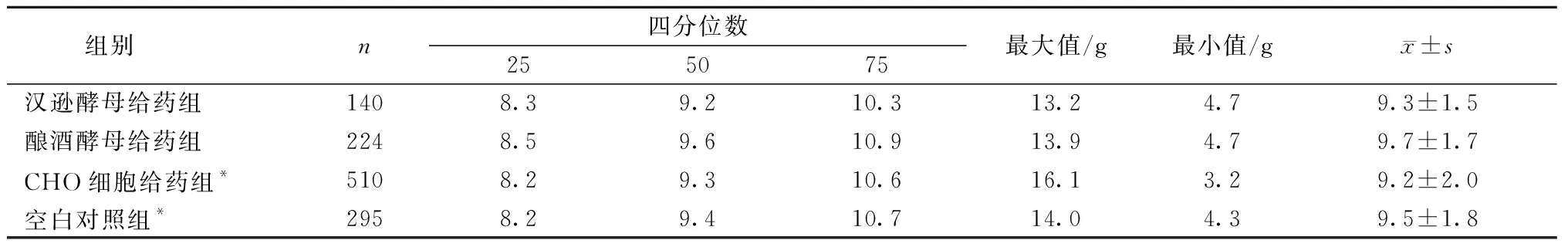
表1 注射7 d后雄性小鼠体质量增长值数据分布情况Table 1 Distribution of weight gain data of male mice 7 days after injection

图1 雄性小鼠给药前和给药7 d后体质量数据分布Fig.1 Distribution of body weight data of male mice before administration and 7 days after administration
2.1.3对小鼠体质量增长值的影响:采用两个独立样本的非参数检验中Mann-Whitney U检验分析三种乙型肝炎疫苗给药组和空白对照组雄性小鼠体质量增长值变化,采用多个独立样本的非参数检验中Kruskal-Wallis检验分析三种乙型肝炎疫苗给药组动物的体质量增长值变化情况,结果显示:比较空白对照组和三种乙型肝炎疫苗给药组动物的体质量增长值,差异没有统计学意义(P>0.05);酿酒酵母给药组动物的体质量增长值与汉逊酵母和CHO细胞给药组动物的体质量增长值比较,差异有统计学意义(P<0.05),结果见表2。

表2 三种乙型肝炎疫苗的给药组雄性小鼠体质量增长值比较Table 2 Comparison of the weight gain of male mice in the 3 hepatitis B vaccine administration groups
2.2 三种重组乙型肝炎疫苗对雄性豚鼠的影响
2.2.1对豚鼠状态的影响:在初试中,CHO细胞给药组有1只豚鼠死亡,1只豚鼠体质量增长值为6.4 g,汉逊酵母和酿酒酵母组各有1只豚鼠的7 d体质量增长值分别为4.4 g和5.5 g,经复试均符合规定,分析认为豚鼠可能在给药过程中受伤,导致死亡或体质量增长缓慢。除此以外,各给药组其他豚鼠状态均未见异常。
2.2.2各组中的不同来源的豚鼠数:2016年3月—2018年2月,本实验室使用的豚鼠购自两个生产厂家,因动物入室后均在同一环境中饲养和观察,注射三种疫苗时未区分豚鼠来源,所以按照疫苗的种类分组。分别处理各组豚鼠的体质量数据,将空白对照组数据合并。在实验过程中为减少雌性豚鼠因激素水平的波动而影响实验,故常选用雄性豚鼠进行异常毒性实验,文中所有的体质量数据均来源于雄性豚鼠。统计两种来源的豚鼠在各组中所占动物数和比重,分别用维通利华和科宇代指不同的来源。统计时剔除上述的异常动物的体质量数据。不同来源豚鼠在各组的分布见表3。
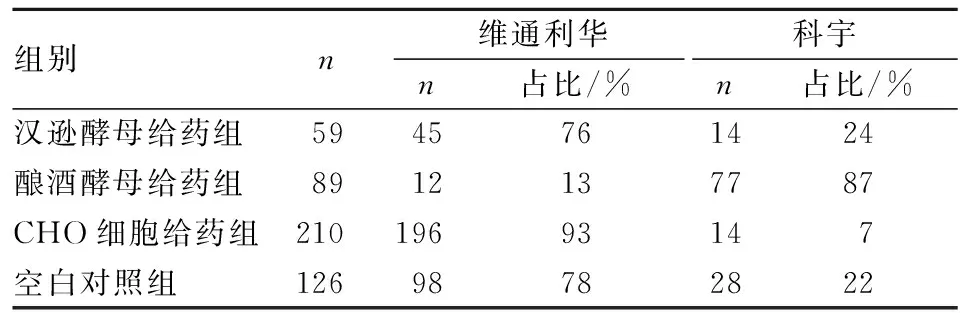
表3 两种来源雄性豚鼠在各组中的分布情况Table 3 Distribution of guinea pigs from 2 sources in each group
2.2.3各组雄性豚鼠的体质量数据分布情况:采用Kolmogorov-Smirnov检验对各组豚鼠的体质量和体质量增长值进行数据分布情况的分析。结果显示:给药前,各组豚鼠的体质量分布均不服从正态分布(P<0.05);给药7 d后体质量数据分布检验结果显示各组豚鼠的体质量均服从正态分布(P>0.05);体质量增长值的数据分布检验结果显示:汉逊酵母给药组和酿酒酵母给药组豚鼠的体质量增长值分布不服从正态分布(P<0.05),其他各组豚鼠的体质量值服从正态分布(P>0.05)。各组雄性豚鼠体质量的描述见图2和表4。

图2 雄性豚鼠给药前和给药7 d后体质量数据分布Fig.2 Distribution of body weight data of male guinea pigs before administration and 7 days after administration
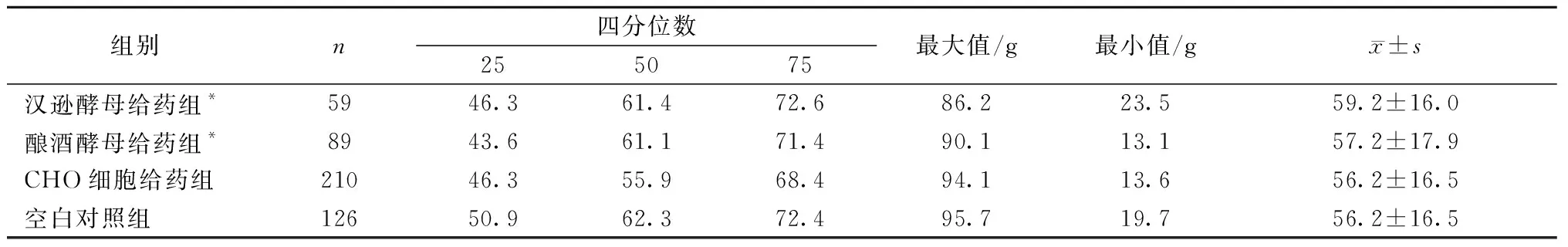
表4 雄性豚鼠体质量增长值数据分布情况Table 4 Distribution of weight gain data of male guines pigs
2.2.4对豚鼠体质量增长值的影响:采用两个独立样本的非参数检验中Mann-Whitney U检验分析三种乙型肝炎疫苗的给药组和空白对照组豚鼠体质量增长值变化情况,采用多个独立样本的非参数检验中Kruskal-Wallis检验分析三种乙型肝炎疫苗给药组豚鼠的体质量增长值变化情况。结果显示:比较空白对照组和三种乙型肝炎疫苗给药组豚鼠的体质量增长值,CHO细胞给药组豚鼠与空白对照组豚鼠的差异有统计学意义(P<0.05),其他两组豚鼠与空白对照组豚鼠的差异无统计学意义(P>0.05),结果见表5。比较三种疫苗的给药组豚鼠,各组豚鼠的体质量增长值差异没有显著性意义(P>0.05),结果见表6。

表5 空白对照组和给药组雄性豚鼠体质量增长值比较Table 5 Comparison of the weight gain of male guinea pigs in the blank group and the administration group

表6 给药组雄性豚鼠体质量增长值比较Table 6 Comparison of weight gain of male guinea pigs in administration groups
3 讨论
3.1三种疫苗在注射后7 d内均未见明显的异常反应,注射过程中造成的动物不适能够在注射完成后1 min内恢复。注射时,由于动物的挣扎造成对动物的伤害例如出血等,可能影响动物体质量的正常增长,日常行为学观察未见异常表现。
3.2三种重组乙型肝炎疫苗分别由重组汉逊酵母、重组酿酒酵母和重组CHO细胞表达的乙型肝炎病毒表面抗原(HBsAg)经纯化,加入铝佐剂制成。在《中国药典》2015年版中,重组汉逊酵母和重组酿酒酵母表达的HBsAg均是将酵母菌破碎后,除去细胞碎片,通过硅胶吸附,柱色谱等适宜的方法纯化,经过除菌过滤获得原液,原液由甲醛灭活处理后,将蛋白质和铝剂以一定比例混合,在一定条件下形成铝吸附产物,然后用生理氯化钠溶液配制为半成品,分装后即为成品。原液的检定合格标准为HBsAg纯度为99.0%,杂蛋白含量不超过总蛋白含量的1%,宿主残留DNA小于10 ng/剂,半成品或成品中游离甲醛含量分别不超过15 μg/mL和20 μg/mL,铝含量分别为0.45~0.60 mg/mL和0.35~0.62 mg/mL;重组CHO细胞表达的HBsAg来源于细胞培养上清液,合并收获物经过澄清过滤、柱色谱纯化、甲醛灭活、超滤、浓缩及除菌过滤后,获得原液。原液加入氢氧化铝佐剂吸附后,即为半成品,然后分装为成品。原液检定合格标准为HBsAg纯度不低于95.0%,支原体检查合格,CHO细胞DNA残留量应不高于10 pg/剂,CHO细胞蛋白质残留量应不高于总蛋白含量的0.05%,成品中游离甲醛含量不高于50 μg/mL,铝应不高于0.43 mg/mL。企业标准中的控制要求应与《中国药典》相同或严于药典标准,三种疫苗的生产过程中均使用铝佐剂为蛋白吸附剂,且含量远高于其它杂质和HBsAg,铝佐剂是疫苗中的主要成分和主要辅料。根据杨赟昀等[4]报道,铝佐剂有可能导致动物出现腹部刺激症状。本研究中涉及的三种疫苗均未见明显的腹部刺激反应,说明铝佐剂作为疫苗制剂中主要的辅料,不同厂家的铝佐剂,质量控制要求和使用要求各不相同。《中国药典》2020年版四部中新增了氢氧化铝佐剂的质量控制通则(通则3650)[1],对制备方法和检定项目进行了说明,该通则可以为疫苗生产用铝佐剂提供质量控制参考和安全保障。
3.3乙型肝炎疫苗为新生儿基础免疫疫苗,疫苗说明书中描述为一般情况下每次免疫剂量为HBsAg10 μg。正常新生儿体质量一般为2 500~4 000 g[5],按新生儿体质量2 500 g计算临床HBsAg给药剂量为4 μg/kg,动物体质量按22 g/只(小鼠)和350 g/只(豚鼠)计算给药剂量为454.5 μg/kg(小鼠)和285.7 μg/kg(豚鼠),分别相当于新生儿临床给药剂量的113倍和71倍,小鼠的给药剂量大于豚鼠的给药剂量。从给药7 d后动物体质量增长值的数据分析可以发现,实验用小鼠在给药后7 d内的体质量增长值疫苗组动物和空白对照组动物无显著性差异,但三种疫苗中酿酒酵母组动物的体质量增加均值大于另外两种疫苗;豚鼠注射7 d后,CHO细胞给药组动物的体质量增加均值小于空白组动物,与另外两种疫苗组动物比较差异没有统计学意义,数据显示不同生产工艺的疫苗对异常毒性实验中小鼠的体质量增长有影响,但对豚鼠的体质量增长未见明显影响。
3.4由于疫苗的生产工艺不断改进,生产过程和所用物料的质量控制日趋完善,部分国家取消了异常毒性检查项,国内学者对异常毒性检查项的适用性产生了不同的意见[6-7]。小鼠具有体型小、饲养管理易于控制、生产繁殖快、有明确的质量控制标准、对各种毒素、病原体和化学物质等敏感的特点[8]。小鼠实验最早作为安全性检查实验也是由于它对制剂中防腐剂苯酚的浓度有高度敏感性[9]。在异常毒性检查实验中,小鼠体质量要求在18~22 g之间,复试时的体质量应为19~21 g。体质量范围控制严格,同批动物的体质量和日龄差异较小,给药剂量较大,通过实验容易表现受试物间的差别。豚鼠有固有特性可用于实验研究,它对很多致病菌和病毒十分敏感[8]。德国从1901年开始采用豚鼠实验进行白喉抗血清的特异性毒性和安全性控制,德国将小鼠的安全性检查实验和豚鼠的特异性毒性检查实验整合,建立生物制品的异常毒性检查[9]。豚鼠体型较大,生产繁殖周期较长,在异常毒性检查实验中豚鼠的体质量要求在250~350 g之间。受试豚鼠的同批动物之间的体质量和日龄存在较大差异,与小鼠相比,给药剂量较小,动物反应不易观察。金先梅[10]和袁文琳等[11]报道,临床有患者接种乙型肝炎疫苗后出现变态反应,疫苗的变态反应与个人的体质相关,虽然豚鼠适用于药物的变态反应实验,但异常毒性检查实验并不是检测抗原的检查方法。
因此,由重组汉逊酵母、重组酿酒酵母和重组CHO细胞表达乙型肝炎病毒表面抗原(HBsAg)经纯化,加入铝佐剂制成的重组乙型肝炎疫苗,在工艺和辅料使用方面均有差异。通过对三种疫苗成品的异常毒性检查所获得的数据进行统计分析,动物的一般状态观察未见明显差别,均没有观察到文献记载的因铝佐剂导致的小鼠腹膜刺激症状。三种重组乙型肝炎疫苗对小鼠给药后7 d内的体质量增长值的影响不同,对豚鼠给药后7 d内的体质量增长值未见明显影响。

