心肌细胞条件性Ppara敲除小鼠模型中他莫昔芬安全有效剂量的筛选*
王晶晶 池亚菲 乔 欣 卢 静
(首都医科大学,北京 100069)
条件性基因敲除技术常用于具有胚胎致死性或具有特定的组织细胞生理学与病理生理学功能的目的基因研究,且基因靶向或转基因小鼠中条件和组织特异性重组系统的出现允许以时间调控和细胞特异性方式评估单个基因的功能。诱导型条件性基因打靶系统的建立,使得对基因在时间和空间上的靶位修饰更加明确,且效果也更加精确可靠。该技术已发展为生物医学领域一个全新且强有力的研究手段。
心肌细胞特异性表达ERT2Cre(Myh6-ERT2Cre)小鼠是Jackson Laboratory构建的心肌细胞特异性表达他莫昔芬(tamoxifen)诱导的Cre重组酶的转基因小鼠,代表了在发育中和成年心脏内,任何loxP靶向基因的时间调控失活或在心脏中特异性指导loxP失活的心脏转基因重组和表达的工具鼠[1]。表达Myh6-ERT2Cre的小鼠心肌细胞在未给予他莫昔芬处理时,并不发挥Cre重组酶的活性,而给予他莫昔芬后,Cre重组酶发生构象改变,并入核与loxP位点特异性结合而发挥基因重组的功能。Hall等[2]研究报道,使用他莫昔芬会造成小鼠短暂性的心脏功能损伤,所以合适且有效的他莫昔芬使用剂量有待探究。
为了得到诱导型心肌细胞特异性Ppara敲除小鼠,同时规避使用他莫昔芬造成心脏功能损伤而影响实验结果,本研究通过给予Pparafl/fl, Myh6-ERT2Cre小鼠不同剂量的他莫昔芬,验证Ppara基因敲除效率及对心脏功能影响,从而成功构建诱导型心肌细胞特异性Ppara基因敲除小鼠。
1 材料和方法
1.1 材料
1.1.1实验动物:Myh6-ERT2Cre小鼠经由北京维通利华实验动物技术有限公司代理购自Jackson Laboratory(005657),实验动物生产许可号:SCXK(京)2016-0006。Pparafl/fl来自于美国Gonzalez教授课题组。实验所需Pparafl/fl和Pparafl/fl, Myh6-ERT2Cre小鼠饲养于首都医科大学SPF级动物房独立送回风净化笼(Individual ventilation cage,IVC)内,相对湿度:50%~60%,温度:22~24 ℃,12 h/12 h明暗交替,自主饮食和饮水。所有实验操作严格遵守动物伦理和动物福利的要求,按照美国国立卫生研究院制定的《实验动物管理和使用指南》和首都医科大学实验动物管理委员会的相关规定进行实验,伦理委员会审批号:AEEI-2018-127。
1.1.2主要试剂:他莫昔芬(T5648)乙醇油溶液(含20%乙醇的他莫昔芬玉米油溶液)及玉米油(C8267),购自Sigma;TRIzol(15596018),购自Invitrogen;反转录试剂盒(A5001),购自Promega;SYBR Green(RR420A),购自Takara;核蛋白提取试剂盒(78835),购自Thermo;丽春红、酸性品红及苯胺蓝,购自国药集团化学试剂有限公司;Nuclear and Cytoplasmic Extraction Reagents(78835),购自Thermo;PVDF膜(ISEQ00010),购自Millipore;脱脂牛奶(P1622),购自普利莱;PPARα一抗(ab97609)和LAMIN B1一抗(ab133741),购自Abcam。
1.1.3主要仪器:小动物超声影像系统(Vevo 2100,Visual Sonics);实时定量荧光PCR仪和Western blot垂直电泳系统(Bio-Rad);倒置(荧光)显微镜(OLYMPUS)。
1.2 方法
1.2.1小鼠模型的建立:6~7周龄的雄性Pparafl/fl, Myh6-ERT2Cre小鼠,随机分为:对照组(腹腔注射含20%乙醇的他莫昔芬玉米油溶液)、A组(单次腹腔注射他莫昔芬2 mg/只)、B组(20 mg/kg,连续注射他莫昔芬5 d)和C组(40 mg/kg, 连续注射他莫昔芬5 d),n=8。注射后继续饲养两周。
1.2.2小鼠心脏超声监测:所有实验小鼠在实验结束当日使用Vevo 2100TM高分辨率小动物超声影像系统进行心脏超声,主要检测心脏横切面,留取1~2个清晰稳定的影像图像进行后期测量统计分析,包括反映心脏功能状态的左心室射血分数(EF%)、左心室短轴缩短率(FS%)等指标。
1.2.3Masson染色:将心脏于4%多聚甲醛中固定24 h后,进行常规组织脱水、石蜡包埋、病理切片及染色。对切片进行Masson染色后,封片及观察。根据METAVIR评分标准按照F0~F4等级进行评分。
1.2.4Real-time qPCR:TRIzol提取组织总RNA,使用Promega GoScript TM反转录系统将2 μg 总RNA反转录为cDNA。 Real-time qPCR使用SYBR Green和Bio-Rad CFX Connect系统进行,反应程序:95 ℃、 3 min,95 ℃、 45 s,60 ℃、40 s进行扩增,共40个循环。熔解曲线:55~90 ℃,每个循环增加0.5 ℃。PCR结束后,将数据导至Excel表,分析结果:以Actb为内参基因,采用公式 2-△△CT计算PparamRNA的相对表达量,并进行组间统计学比较分析。引物序列如下:Ppara5′-CCCTGAACATCGAGTG CGAA-3′,Ppara5′-TTCGCCGAAAGAAGCCCTTA-3′,Actb5′-ATGGAGGGGAATACAGCCC-3′,Actb5′-TTC TTTGCAGCTCCTTCGTT-3′。
1.2.5Western blot:按照Nuclear and Cytoplasmic Extraction Reagents试剂盒的使用说明从心脏组织中提取核蛋白,并进行蛋白浓度的测定、定量及变性。10% SDS-PAGE凝胶电泳分离50 μg核蛋白,使用Trans-Blot Turbo Transfer System转移至PVDF膜在5%脱脂牛奶中封闭,PPARα一抗和LAMIN B1一抗4 ℃孵育过夜。过夜后,进行常规洗涤及孵育HRP二抗,ECL显影。
1.3 统计学分析

2 结果
2.1 小鼠的交配及基因型鉴定
Pparafl/fl, Myh6-ERT2Cre小鼠来源于Pparafl/fl小鼠和Myh6-ERT2Cre小鼠的杂交后代。将Pparafl/fl小鼠和Myh6-ERT2Cre小鼠进行杂交及回交,根据基因型鉴定结果获得Pparafl/fl, Myh6-ERT2Cre小鼠和同窝对照Pparafl/fl小鼠,之后将Pparafl/fl, Myh6-ERT2Cre小鼠和Pparafl/fl小鼠进行交配繁殖以满足实验所需(见图1)。
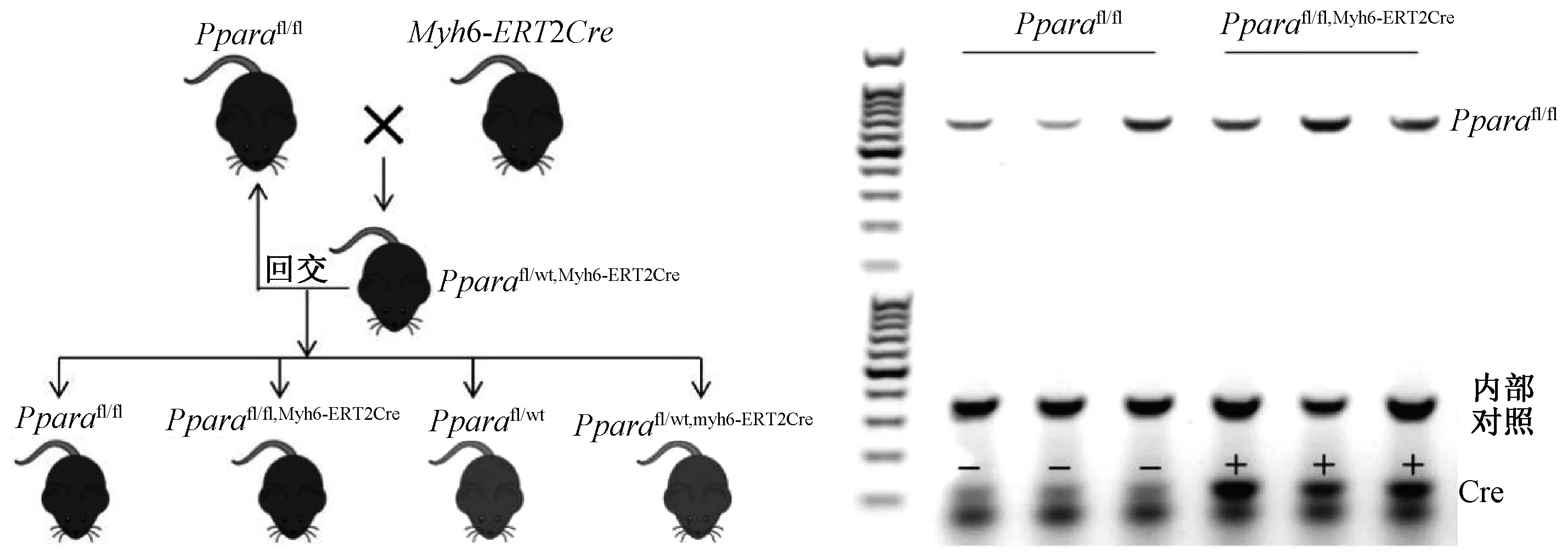
图1 小鼠的交配及基因型鉴定Fig.1 Mating and genotyping of mice
2.2 小鼠注射他莫昔芬后心脏超声结果
Pparafl/fl, Myh6-ERT2Cre小鼠注射他莫昔芬两周后进行心脏超声监测,检测结果显示4组小鼠的室壁厚度(LVST)、心室容积等指标未见改变,而对心脏功能指标EF%和FS%进行统计分析发现:与对照组相比, A组及B组小鼠的心功能均未见有所改变,而C组小鼠的心功能有所下降,但没有统计学意义(P>0.05)。此结果提示C组的注射方式对Pparafl/fl, Myh6-ERT2Cre小鼠的心脏功能产生一定程度的损害(见图2)。
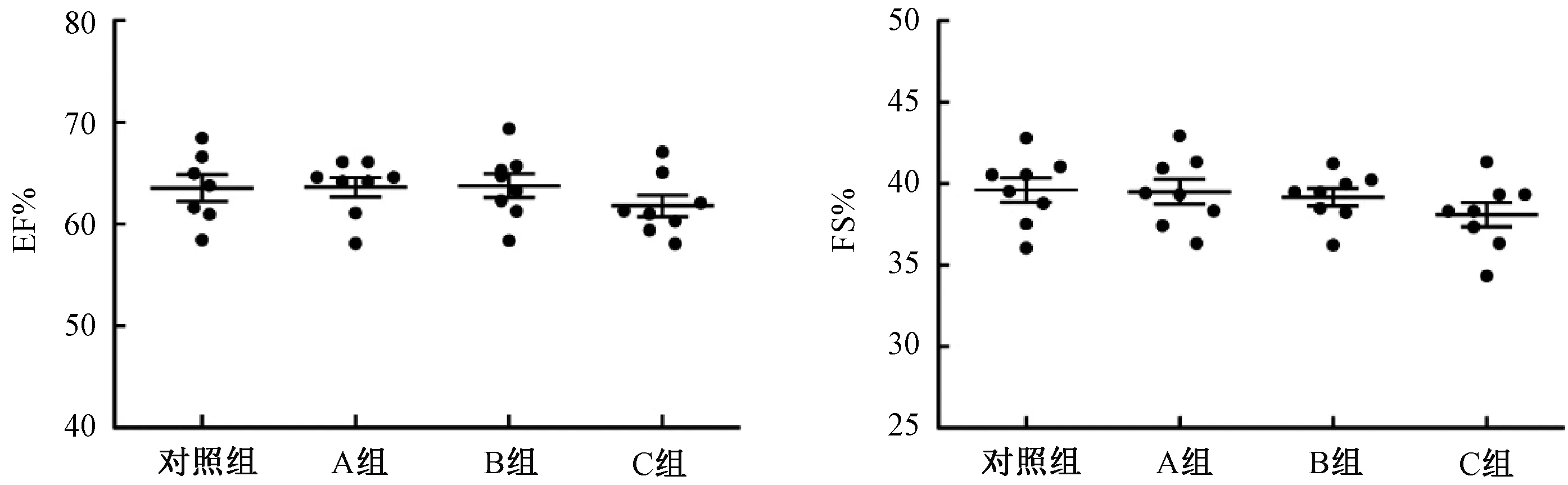
图2 小鼠注射他莫昔芬后EF%和FS%值Fig.2 EF% and FS% of mice after administration with tamoxifen
2.3 注射他莫昔芬后心脏组织中Ppara mRNA的表达水平
Pparafl/fl,Myh6-ERT2Cre小鼠注射他莫昔芬两周后检测其心肌组织中PparamRNA的表达水平。Real-time qPCR结果显示:给予Pparafl/fl, Myh6-ERT2Cre小鼠他莫昔芬两周后心肌组织中PparamRNA的表达水平均会降低,尤其是B组和C组的小鼠心肌组织中PparamRNA的表达水平极低,说明剂量为20 mg/kg或40 mg/kg连续5 d的他莫昔芬注射方法可以达到诱导性敲除心肌细胞中Ppara的效果(见图3)。
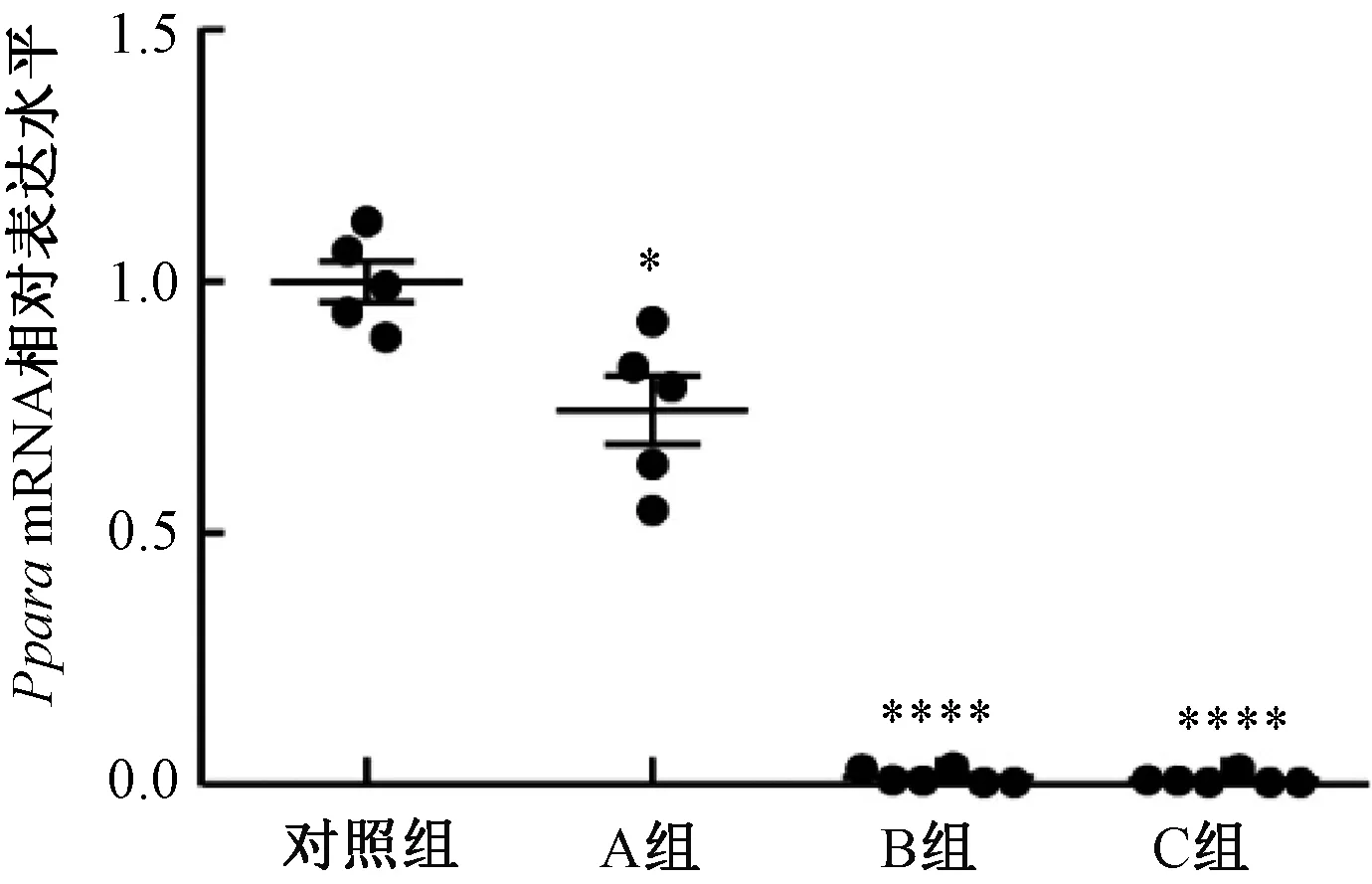
图3 小鼠注射他莫昔芬后心肌组织中Ppara mRNA的表达注:与对照组相比,*P<0.05,****P<0.0001Fig.3 Expression of Ppara mRNA in myocardium after administration with tamoxifenNote: Compared with the vehicle group, *P<0.05,****P<0.0001
2.4 注射他莫昔芬后非心脏组织中Ppara mRNA的表达水平
为了明确给予他莫昔芬两周后是否会影响Pparafl/fl, Myh6-ERT2Cre小鼠除了心肌外的其余组织细胞中PPARα的正常表达,提取了血管、肝脏、肾脏、骨骼肌、肺、白色脂肪和棕色脂肪总RNA,Real-time qPCR检测这些组织中PparamRNA的表达改变,结果显示:给予他莫昔芬不会影响Pparafl/fl, Myh6-ERT2Cre小鼠非心肌组织中PparamRNA的表达水平(见图4)。
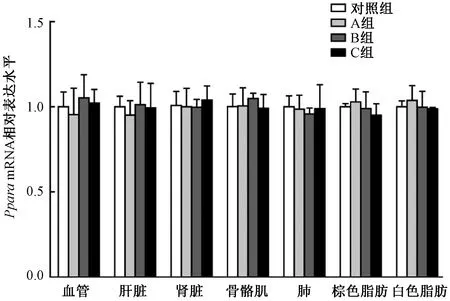
图4 小鼠注射他莫昔芬后非心肌组织中Ppara mRNA的表达改变Fig.4 Expression of Ppara mRNA in non-myocardium after administration with tamoxifen
2.5 注射他莫昔芬后心脏Masson染色结果
Pparafl/fl, Myh6-ERT2Cre小鼠注射他莫昔芬两周进行心脏组织石蜡切片Masson三色染色,观察心肌组织纤维化的改变情况。对Masson三色染色结果进行统计分析显示:与对照组相比,A组和B组小鼠的心肌组织形态未见改变,而C组小鼠的心肌纤维化面积增加,此结果说明高剂量他莫昔芬40 mg/kg注射5 d的给予方式对Pparafl/fl, Myh6-ERT2Cre小鼠的心肌造成了一定程度的损害(见图5)。

图5 他莫昔芬注射后心肌组织Masson染色注:与对照组相比,*P<0.05Fig.5 Masson staining of myocardium after administration with tamoxifenNote: Compared with the vehicle group,*P<0.05
综上所述,连续5 d腹腔注射20 mg/kg他莫昔芬的给药剂量可以达到建立诱导型心肌细胞特异性Ppara敲除(Ppara△CM)小鼠的效果。
2.6 他莫昔芬诱导型心肌细胞特异性Ppara敲除小鼠心肌组织中PPARα蛋白表达水平
为了进一步明确Ppara△CM小鼠的成功建立,给予Pparafl/fl, Myh6-ERT2Cre小鼠连续5 d腹腔注射20 mg/kg他莫昔芬两周后提取心肌组织中核蛋白,检测心肌组织中PPARα的表达改变。Western blot结果显示:连续给予20 mg/kg他莫昔芬5 d,两周后Pparafl/fl, Myh6-ERT2Cre小鼠心肌组织中PPARα的表达殆尽,达到了诱导性敲除心肌细胞中Ppara的效果(见图6)。

图6 Western blot检测Ppara△CM小鼠心肌组织中PPARα的表达Fig.6 Expression of PPARα in myocardium of Ppara△CM mice by Western blot
3 讨论
传统的基因敲除小鼠是在DNA同源重组、胚胎干细胞等技术基础上进行基因打靶制备的,但并不适用于具有胚胎致死性或调控生理与病理生理关键基因的研究。使用Cre-loxP技术控制小鼠基因缺失组织特异性的能力具有极为先进的小鼠遗传学和检测体内单个基因功能的能力[3]。但是,Cre-loxP方法的一个重大局限性是无法暂时控制遗传重组,而利用组织或细胞特异性启动子和药物诱导剂的Cre重组酶的表达可对基因重组事件进行空间和时间限制。Myh6-ERT2Cre小鼠就是可以利用他莫昔芬实现心肌细胞特异性和时间调控的基因重组工具小鼠[1]。
在Myh6-ERT2Cre小鼠中,Cre重组酶与两个突变的雌激素受体域融合,当与雌激素类似物他莫昔芬结合后此融合蛋白便从细胞质穿梭到细胞核中发挥基因重组的功能[4-5]。Myh6-ERT2Cre小鼠在条件性基因敲除实验中得到了广泛的应用[6]。然而,Hall等[2]和Lexow等[7]报道表明,带有心肌细胞特异性Cre重组酶给予他莫昔芬后可造成小鼠剂量依赖性的急性心脏功能障碍、心肌死亡、炎症及纤维化,甚至死亡。Andersson等[8]研究表明,可以利用瞬时效应或减少他莫昔芬的总剂量来最大程度地降低其心脏副作用。因此,本研究根据Gopal等[9]和Liang等[10]报道,对所选择的不同方案从Pparafl/fl, Myh6-ERT2Cre小鼠心脏功能、组织形态学及PPARα的诱导性敲除水平进行综合评估,建立有效稳定的可诱导型心肌细胞特异性Ppara敲除小鼠。研究发现三种他莫昔芬给药剂量均不会造成心脏收缩功能障碍,但单次给予2 mg/只他莫昔芬腹腔注射组不能充分敲低心肌细胞中Ppara的表达。虽然高剂量的40 mg/kg连续给药5 d的方案可以达到心肌细胞中Ppara的敲除效果,却造成了一定程度的心功能影响及心肌纤维化增加。因此,20 mg/kg连续腹腔注射他莫昔芬5 d的给药方案可以充分敲除心肌细胞中的Ppara,并且不会造成小鼠心功能和心肌的损伤,成功构建的Ppara△CM小鼠,这将为研究成年心脏中PPARα的基因调控功能提供了基础。

