SAT法检测人巨细胞病毒pp67 mRNA在人类免疫缺陷病毒合并人巨细胞病毒感染患者临床诊疗中的价值探讨
孟 欢 王 爽 何超男 韩 莹 潘美晨 殷商启 郑 梅 金方方 王雅杰
(首都医科大学附属北京地坛医院检验科,北京 100015)
获得性免疫缺陷综合征是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染引起的严重威胁人类健康的疾病,当疾病进展至晚期常因严重免疫缺陷而合并多种机会性感染[1]。人巨细胞病毒(human cytomegalovirus, HCMV)是双链DNA病毒,属于疱疹病毒β亚科,是疱疹病毒中最大的病毒,人体感染后大多呈现潜伏/无症状感染[2-3],免疫力低下人群如获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)患者感染后易进展为HCMV终末器官疾病,在尸检中大约90%的AIDS患者存在播散性HCMV感染[4]。由于AIDS患者的免疫功能低下,感染HCMV后,早期无明显临床症状,不易诊断。因此,对AIDS患者是否感染HCMV的早期筛查尤为重要。
实时荧光核酸恒温扩增检测技术(simultaneous amplification and testing,SAT)可利用反转录酶以及T7 RNA聚合酶对靶标RNA进行高效扩增,其优势在于靶标是RNA,在感染初期拷贝数大于DNA,灵敏度更高;RNA在病原体死亡后降解快,可以区分活动性感染和非活动性感染,可以用于评估疗效;扩增产物是RNA,易降解,不易造成实验室污染[5]。HCMV基质表层蛋白pp67(phosphoprotein67, pp67) mRNA是晚期mRNA编码的HCMV基质表层蛋白核酸形式,该mRNA是真正晚期mRNA,可反映活动性HCMV感染[6],可作为准确判断活动性HCMV感染的指标,对于降低HCMV病的发生率和病死率都有重要意义。故本研究拟采用SAT技术检测HCMV pp67 mRNA,并评估该方法及该指标在临床应用中的价值。
1 对象与方法
1.1 研究对象
选择2019年7月至2020年2月首都医科大学附属北京地坛医院接受巨细胞病毒DNA定量检测的302例患者,其中HIV阳性HCMV活动性感染患者69例、HIV阳性HCMV非活动性/潜伏感染154例、HIV阴性HCMV 非活动性/潜伏感染 79例。样本类型包括血清、脑脊液、肺泡灌洗液。
入组标准[7-8]:
(1)HIV阳性患者:HIV抗体初筛及确证试验均为阳性的患者。
(2)HIV阴性患者:HIV抗体初筛试验阴性且流行病学调查排除HIV阳性暴露可能性。
(3)HCMV活动性感染:①抗HCMV特异性抗体IgG(immunoglobulin G, IgG)阳性;②抗HCMV特异性抗体IgM(immunoglobulin M, IgM)阳性且有相应器官/部位巨细胞病毒感染的特征性临床表现;③HCMV DNA阳性且有相应器官/部位巨细胞病毒感染的特征性临床表现。同时满足①、②或①、③两点或三点都满足即可诊断为HCMV活动性感染。
(4)HCMV非活动性/潜伏感染:①抗HCMV特异性抗体IgG阳性;②无相应器官/部位巨细胞病毒感染的特征性临床表现。同时满足①、②两点可诊断为HCMV非活动性/潜伏感染。
1.2 SAT 法建立
1.2.1 试剂
标准品、样品稀释液、酶反应液(M-MLV反转录酶、T7 RNA聚合酶)、样品提取液均由上海仁度公司提供。
1.2.2 SAT法反应条件
PCR循环设置:42 ℃ 1 min,40个循环。仪器为上海仁度全自动核酸分析系统(Auto SAT)。
1.2.3 结果判读
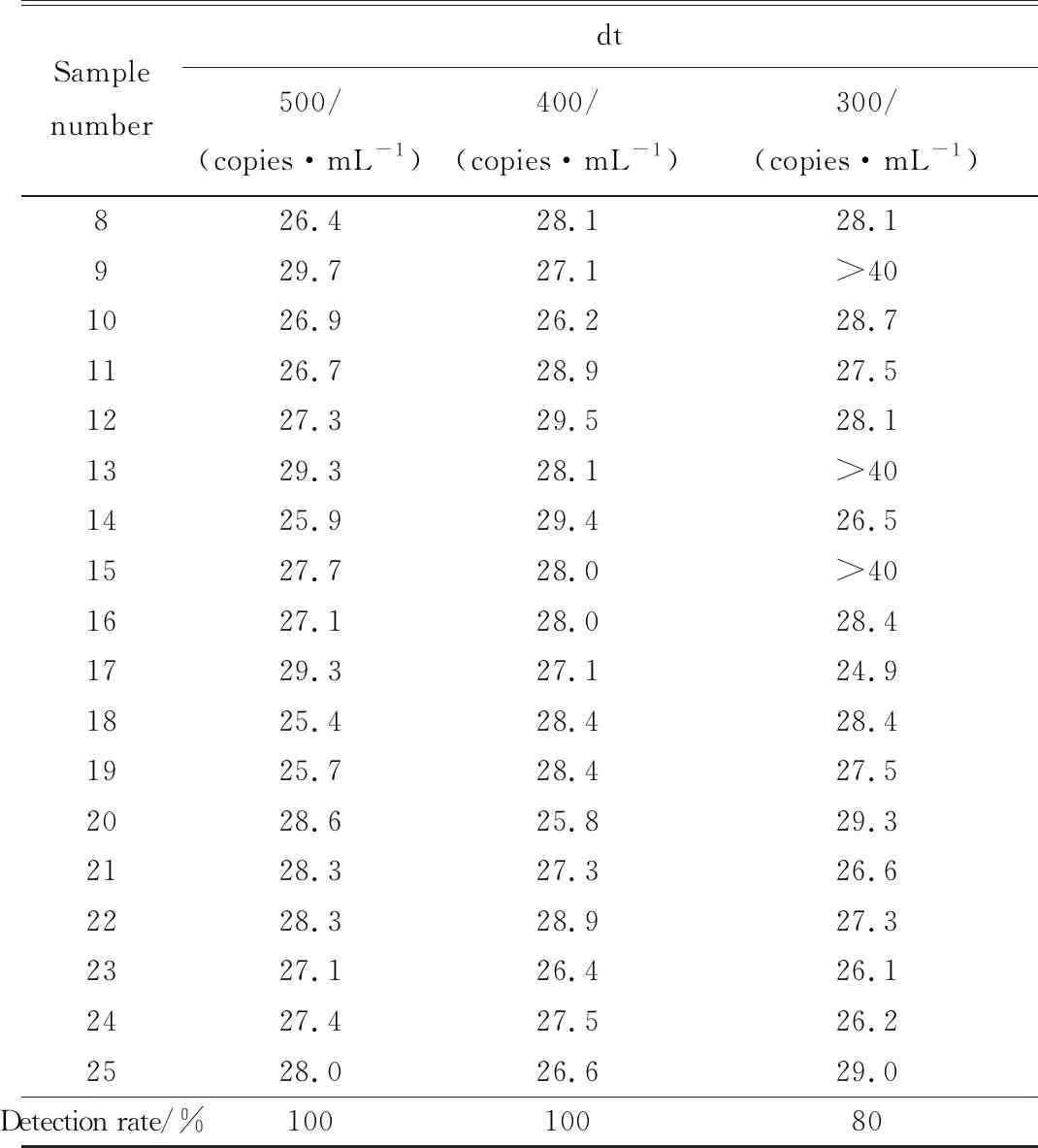
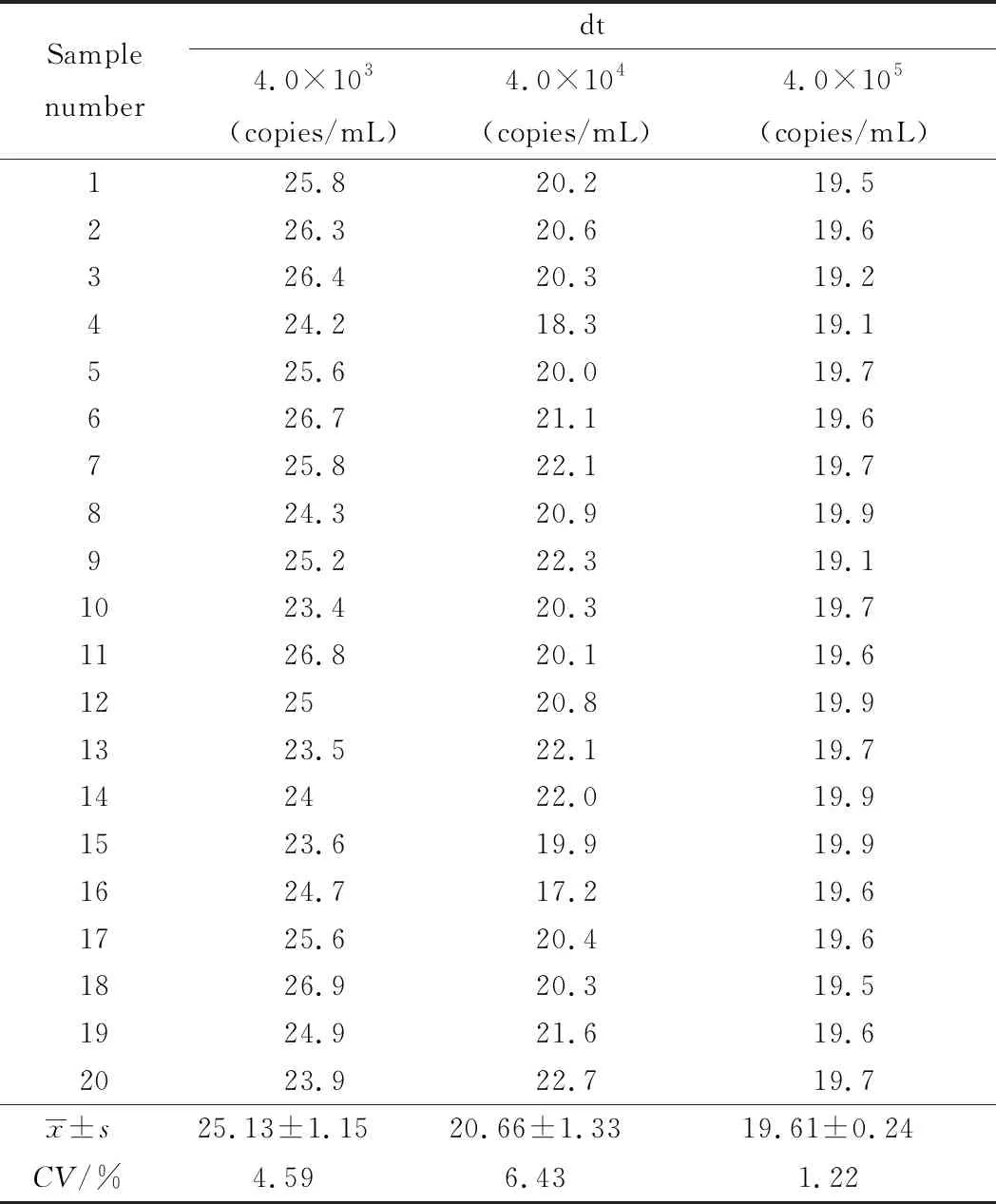
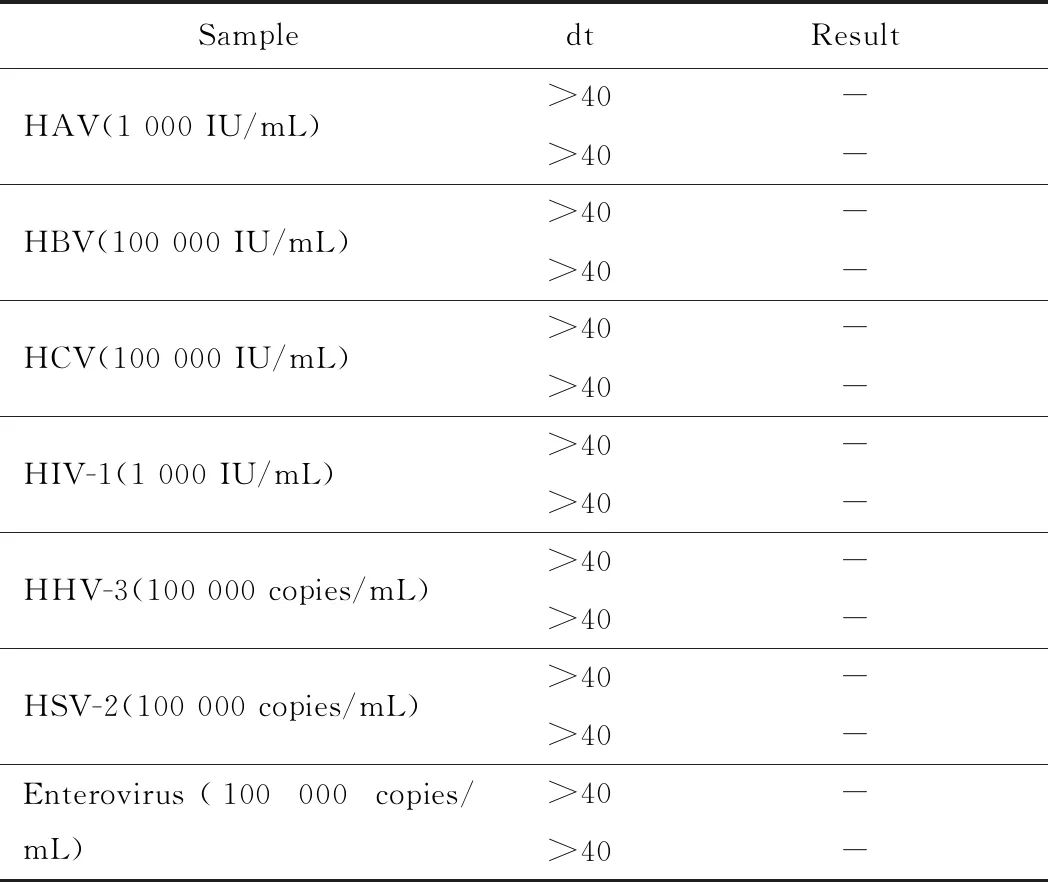
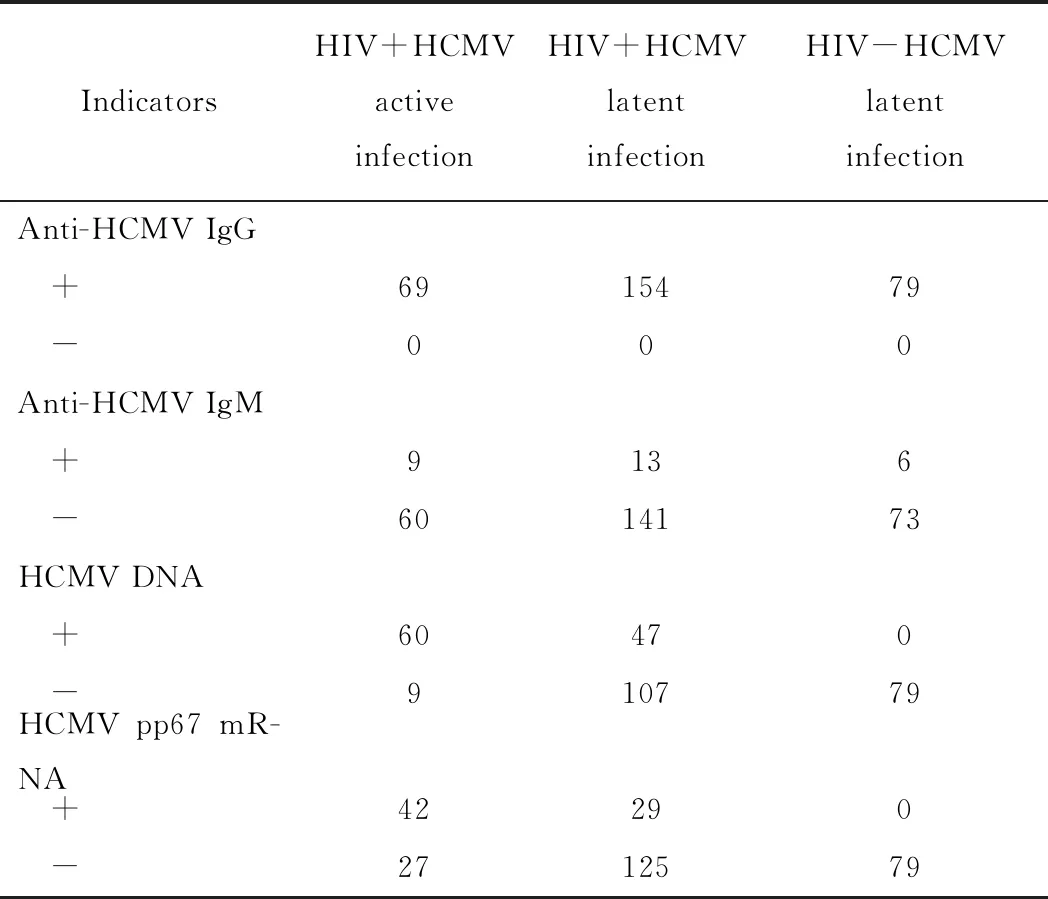
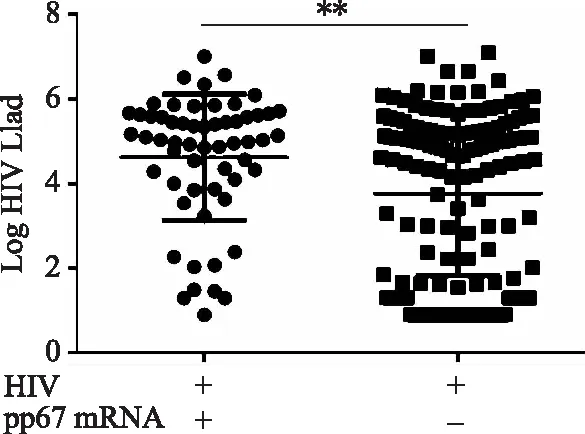
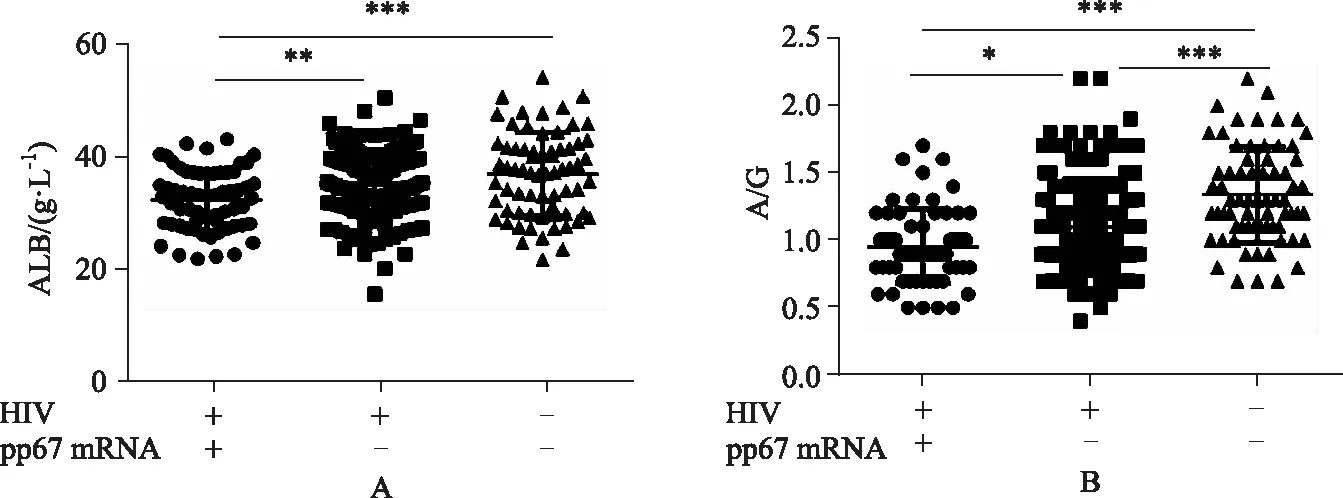
dt(detection time)为样本曲线与阈值交点的横坐标读数。阳性(0 1.2.4 SAT法检测HCMV pp67 mRNA性能评估 分析性能评估:检出限、重复性、特异性的评估均参照2019年《分子诊断检验程序性能验证指南》[9]、《临床检验定量测定项目精密度与正确度性能验证》[10]和2019年《临床化学定量检验程序性能验证指南》[11]中要求设计。 (1)检测下限评估:将浓度为1010copies/mL的HCMV 标准液稀释成500、400、300 copies/mL,每个浓度重复检测25次,计算阳性检出率。阳性检出率=(实际检出次数/重复检测总次数)×100%,0 (2)重复性评估:将浓度为1010copies/mL的HCMV 标准液稀释至4.0×103、4.0×104、4.0×105copies/mL 3个浓度后,每个浓度重复测量20次,计算变异系数(coefficient of variance,CV)值。判定标准:满足试剂厂家性能标准,CV<10%。 (3)特异性评估:收集甲型肝炎病毒(hepatitis A virus, HAV)阳性血浆样本、HIV-1阳性血浆样本、乙型肝炎病毒(hepatitis B virus, HBV)阳性血清样本、丙型肝炎病毒(hepatitis C virus, HCV)阳性血清样本、人类疱疹病毒3型(human herpes virus-3, HHV-3)阳性全血样本、单纯疱疹病毒2型(herpes simplex virus-2, HSV-2)阳性阴道拭子样本、肠道病毒阳性肛拭子样本;对样本进行病毒定量,定量后稀释至如下浓度:HAV1 000 IU/mL、HBV 100 000 IU/mL、HCV 100 000 IU/mL、HIV-1 1 000 IU/mL、HHV-3 100 000 copies/mL、HSV-2 100 000 copies/mL和肠道病毒 100 000 copies/mL,将稀释后的样本加入到HCMV阴性样本中,进行HCMV pp67 mRNA检测,每个样本检测2次。检测结果均为阴性则判定为特异性符合临床要求。 (1)HCMV DNA定量检测:采用PCR-荧光定量方法检测试剂盒(中山大学达安基因)检测血清、肺泡灌洗液、脑脊液样本中的HCMV DNA,仪器为Applied Biosystems 7500型定量PCR仪(美国应用生物系统公司);检测结果≥500 copies/mL为阳性,<500 copies/mL为未检测到。 (2)抗HCMV IgG、 IgM特异性抗体检测:采用电化学发光法检测患者血清中抗HCMV IgG(人巨细胞病毒IgG抗体检测试剂盒购自德国Roche公司)和IgM(人巨细胞病毒IgM抗体检测试剂盒购自德国Roche公司)特异性抗体,Cobas E602 电化学发光分析仪购自德国罗氏公司。 (3)HIV-1核糖核酸 (RNA)定量检测:采用聚合酶链反应荧光法检测HIV (Ⅰ型) 核酸[HIV(Ⅰ型) 核酸定量检测试剂盒购自瑞士Roche公司], 仪器为瑞士罗氏cobasAmpliPrep/cobas TaqMan病毒载量检测系统。 (4)T淋巴细胞亚群绝对计数:采用美国BD公司FACSCantoTMⅡ流式细胞仪及其配套试剂检测。 (5)总蛋白、白蛋白检测:采用日本HITACHI 7600全自动生化分析仪及北京利德曼生化股份有限公司试剂进行测定。 在302例患者中,HIV阳性HCMV活动性感染组、HIV阳性HCMV非活动性/潜伏感染组以及HIV阴性HCMV 非活动性/潜伏感染组的平均年龄和性别分布,差异无统计学意义(P>0.05),详见表1。 表1 研究对象的临床特征 2.2.1 检测下限评估 表2结果显示,500、400 copies/mL的HCMV 标准品的检出率均为100%,而300 copies/mL的HCMV标准品的检出率为80%,故检出下限为400 copies/mL。 表2 检出下限性能验证结果 续表2 2.2.2 重复性评估 3个浓度的重复性评估CV值均小于10%,详见表3。 表3 重复性验证结果 2.2.3 特异性评估 表4检测结果显示均为阴性,证明该试剂的特异性符合标准。 表4 特异性验证结果 2.3.1 不同指标检测HCMV结果 将302例患者的血清样本分别用于检测抗HCMV特异性IgG抗体、抗HCMV特异性IgM抗体;血清、肺泡灌洗液、脑脊液样本用于HCMV DNA和HCMV pp67 mRNA的检测,其中同一患者在同一时间段内(样本送检间隔时间小于7 d)的不同类型样本,只要当中某一种样本检测出阳性结果,则视该患者为HCMV DNA阳性病例或HCMV pp67 mRNA阳性病例。3组患者中,抗HCMV特异性IgG抗体阳性率为100%,HIV+HCMV活动性感染组、HIV+ HCMV非活动性/潜伏感染组和HIV- HCMV非活动性/潜伏感染组的抗HCMV特异性IgM抗体阳性率分别为13.04%、0.08%和0.07%;HCMV DNA阳性率分别为86.96%、30.52%和0%;HCMV pp67 mRNA阳性率分别为60.87%、18.83%和0%。结果详见表5。 表5 不同指标检测HCMV结果Tab.5 Results of different indicators used in HCMV detection 2.3.2 3种检测指标的检验效能比较 根据入组标准,将3组人群合并为两大组分别为HCMV活动性感染组、HCMV非活动性/潜伏感染组,计算HCMV DNA、HCMV pp67 mRNA、抗HCMV 特异性IgM抗体3种指标的特异度、灵敏度、阳性预测值(positive predictive value, PPV)、阴性预测值(negative predictive value, NPV),正确率以及约登指数(Youden index, YI)。3种检测指标中,抗HCMV 特异性IgM抗体特异度最高为91.85%,HCMV DNA灵敏度最高为86.96%,HCMV DNA和HCMV pp67 mRNA的PPV接近,分别为0.56和0.59,3种指标的NPV由高到低分别为HCMV DNA 0.95, HCMV pp67 mRNA 0.88以及抗HCMV IgM 0.78;HCMV DNA和HCMV pp67 mRNA的正确率相同都为81.46%,抗HCMV IgM的正确率稍低为73.84%;3种检测指标中HCMV DNA的约登指数最高为0.67,其次为HCMV pp67 mRNA 0.48, 而抗HCMV IgM的约登指数仅为0.04。检验效能HCMV DNA大于HCMV pp67 mRNA大于抗HCMV IgM。结果详见表6。 表6 不同指标诊断HCMV活动性感染的检验效能 2.3.3 SAT法与临床诊断阳性检出率比较 将HCMV pp67 mRNA的阳性检出率与临床诊断结果作比较,结果显示SAT法检测HCMV pp67 mRNA的阳性检出率与临床诊断的阳性检出率相比,P=0.894, 两者之间差异无统计学意义,结果表明两者的阳性检出率相近。详见表7。 表7 STA法HCMV pp67 mRNA阳性检出率与临床诊断结果比较 从2.3的结果显示出SAT法检测HCMV pp67 mRNA的检验效能适中,阳性检出率与临床诊断差异无统计学意义。根据HCMV pp67 mRNA结果阳性与否,HIV阳性与否,将患者重新分为HIV+ HCMV pp67 mRNA+组、HIV+ HCMV pp67 mRNA-组以及HIV- HCMV pp67 mRNA-组,分别比较3组患者的T淋巴细胞亚群和生物化学指标,以及HIV+的两组患者的HIV载量。 2.4.1 HIV+患者HCMV pp67 mRNA阳性组与阴性组HIV载量(log值)比较 根据表8、图1结果可知,HCMV pp67 mRNA阳性组患者的HIV载量要高于HCMV pp67 mRNA阴性组(P=0.003),血中HIV载量高的患者HCMV活动性感染的概率更大。 图1 HIV+患者中HCMV pp67 mRNA阳性组与HCMV pp67 mRNA阴性组HIV载量比较Fig.1 Comparison of HIV load between HCMV pp67 mRNA positive group and HCMV pp67 mRNA negative group in HIV+patients** P<0.01; HIV: human immunodeficiency virus; HCMV: human cytomegalovirus; pp67: phosphoprotein67. 表8 HIV+患者中HCMV pp67 mRNA阳性组与HCMV pp67 mRNA阴性组HIV载量比较 2.4.2 3组患者T淋巴细胞亚群计数的差异比较 经过比较,三组患者的CD45+淋巴细胞(CD45+lymphocyte, CD45+)计数、CD3+T淋巴细胞(CD3+T lymphocyte, CD3+)计数、CD3+CD8+T淋巴细胞(CD3+CD8+T lymphocyte, CD3+CD8+)计数、CD3+CD4+T淋巴细胞与CD45+淋巴细胞的比值(CD3+CD4+lymphocyte/CD45+lymphocyte,CD3+CD4+/CD45+)、CD3+CD4+T淋巴细胞(CD3+CD4+T lymphocyte, CD3+CD4+)计数、CD3+CD4+T淋巴细胞与CD3+CD8+T淋巴细胞的比(CD3+CD4+/CD3+CD8+),差异均有统计学意义(P<0.05)。结果详见表9。组间两两比较可知,表中各指标除CD3+CD8+ T淋巴细胞计数外,HIV+组均低于HIV-组;表中各指标组间两两比较结果中,HIV+ HCMV pp67 mRNA+组均要低于HIV+ HCMV pp67mRNA-组,结果提示免疫能力越差,HCMV活动性感染的可能性越高。组间比较结果详见图2。 图2 3组患者T淋巴细胞亚群计数差异比较Fig.2 The difference of T lymphocyte subsets count in the three groupsA:CD45+ lymphocyte counts; B:CD3+ T lymphocyte counts; C: CD3+CD4+T lymphocyte counts; D:CD3+CD8+ T lymphocyte counts; E:CD3+CD4+ T lympocyte to CD3+CD8+ T lymphocyte ratio;F: CD3+CD4+ T lymphocyte to CD45+ lymphocyte ratio; *P<0.05, **P<0.01, *** P<0.001; HIV: human immunodeficiency virus; pp67: phosphoprotein67. 表9 不同组之间T淋巴细胞亚群计数的差异 2.4.3 3组患者血浆白蛋白、白球比的差异比较 3组患者中,HIV+ HCMV pp67 mRNA+组患者血浆白蛋白数量以及白球比均要低于其他两组,差异有统计学意义(P<0.05)。详见表10和图3。 表10 不同组之间ALB和A/G的差异 图3 3组患者血浆白蛋白、白球比的差异比较Fig.3 Comparison of plasma albumin, albumin globule ratio in the three groupA: albumin quantity; B: albumin to globulin ratio;*P<0.05, ** P<0.01,***P<0.001; ALB: albumin; A/G: albumin globule ratio; HIV: human immunodeficiency virus; pp67: phosphoprotein67. HIV患者共感染HCMV后,因其自身免疫低下,体内潜伏感染的HCMV易发展为活动性感染,导致HCMV终末器官疾病,主要表现为巨细胞病毒视网膜炎,还可累及肺、肠道、肾上腺、脑等器官,HCMV也可通过血液造成播散性感染[12]。因此,良好的指标和方法辅助诊断HCMV活动性感染对于HIV患者的预后和免疫重建有重要意义。 SAT法检测HCMV pp67 mRNA的各项性能验证结果均达到临床检测要求,该方法可以用于临床样本的检测;在检验效能比较中,HCMV DNA的灵敏度、正确诊断指数(即约登指数)在3个指标中最高,但HCMV DNA检测存在局限性,HCMV DNA阳性不能用于辨别患者是否处于活动性感染[13];抗HCMV特异性IgM抗体的特异度虽达到91.85%,但这可能是由于HIV患者免疫低下,患者无法产生足量的抗体,从而导致抗HCMV特异性IgM抗体结果假阴性[14]。SAT法检测HCMV pp67 mRNA的检验效能适中,且与临床诊断结果比较,能较好地分辨患者是否处于现症感染,有良好的辅助诊断价值。 HCMV pp67 mRNA阳性的HIV患者其自身的免疫功能较差,HIV载量较高;和其他两组比,HCMV pp67 mRNA阳性组血浆白蛋白更少,有研究[15-16]显示白蛋白可以与抗反转录病毒的药物非特异性结合,对于维持血药浓度以及药物作用时间有一定意义,低白蛋白血症可能与抗病毒治疗失败有关。从以上两点可得,免疫重建失败,抗病毒治疗失败的HIV患者更易使HCMV潜伏感染激活或重新感染HCMV;此外,也有研究[17]表明,HCMV感染人体后会引起免疫抑制,这也可能进一步导致HIV患者免疫重建困难,从而更易诱发机会性感染。 综上,SAT法检测HCMV pp67 mRNA可以用于临床辅助诊断HCMV活动性感染,也可辅助评估HIV患者免疫重建、抗病毒治疗的效果;HCMV pp67 mRNA阳性患者建议监测白蛋白浓度以及免疫重建、抗病毒治疗的疗效。1.3 实验室检测指标及方法
1.4 统计学方法
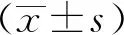
2 结果
2.1 研究对象的临床特征
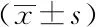
2.2 SAT法性能评估结果

2.3 不同指标检测HCMV结果及检验效能评价


2.4 HCMV pp67 mRNA结果与其他临床指标的关联




3 讨论

