生长分化因子-11活性域对老年小鼠认知水平的影响
黄 策, 王祎龙, 刘海亮,2
(1. 同济大学医学院,上海 200092; 2. 同济大学附属东方医院再生医学研究所,上海 200123)
哺乳动物的衰老是一个复杂的包含细胞和组织多层次的系统性退化过程,在衰老的过程中多个组织器官表现出不可逆的类似熵增的功能性下降和结构改变[1],如与年龄相关的心肌细胞损伤导致的心脏组织纤维化,是心衰临床病理的重要标志[2];伴随年龄出现的中枢神经系统神经元数量下降,则是导致阿尔茨海默病和其他神经退行性疾病发生的危险因素[3],也因如此,衰老被认为是人类死亡的最大风险元素。关于衰老的分子机制,目前存在多种假说,包括“端粒假说”“自由基假说”“基因组不稳定”“干细胞枯竭”“表观遗传学说”等[4],针对不同的衰老假说发现的分子调控通路,研究人员致力于寻找靶向关键分子的抗衰老药物,以期延缓衰老或减少年龄相关疾病的发生。目前陆续发现了包括“二甲双胍”“白藜芦醇”“β-烟酰胺单核苷酸”等多种具有潜在抗衰老效果的药物[5]。
而随着联体共生(parabiosis)实验的进展,研究人员开始关注血浆内源性分子在抗衰老中的作用[6]。2013年,哈佛大学Loffredo等[7]首次发现在小鼠血浆中,TGF-β超家族成员中的循环因子生长分化因子11(growth differentiation factor-11,GDF11),随着年龄的增长出现显著下降,通过给老年小鼠补充GDF11至年轻小鼠水平,不仅逆转了衰老相关的心肌肥大,同时增加了中枢神经系统的神经发生[8],这显示GDF11在多种组织器官中具有靶向修饰衰老的潜能,为血液循环因子抗衰老带来了曙光。之后多个研究小组通过ELISA发现在小鼠与人体血液循环系统中的GDF11随年龄增加出现相关性下降。而在2015年,Egerman等[9]开始质疑Loffredo等[7]在实验中使用的GDF11抗体的特异性,他们开发了一种新的GDF11特异性免疫测定法,发现该测定法与肌生长抑制素(又称生长分化因子8)(growth differentiation factor-8, GDF8)没有交叉反应。使用这种方法,随着年龄的增长,血液循环中的GDF11并不会减少。在2016年,Schafer等[10]使用LC-MS/MS对160名22~93岁健康人的血浆进行检测,也发现GDF11分子前结构域和GDF11的成熟蛋白与年龄呈正相关。
因此,在衰老过程中GDF11的真实作用尚且存疑。目前GDF11的治疗性作用主要使用GDF11的重组蛋白来进行实验,而GDF11重组蛋白能否发挥正常的功能目前依然存在争议。像TGF-β超家族其他成员一样,GDF11蛋白在合成过程中,首先被翻译为无活性的前体蛋白同型二聚体,包括信号肽、N端前肽和C端成熟结构域三部分。之后GDF11前体蛋白同型二聚体被弗林蛋白酶(Furin)进行初始蛋白水解,从C端成熟域切割N端前肽。之后由BMP1/TLD蛋白酶介导第二步蛋白水解,切割N-末端前肽并释放成熟的GDF11二聚体[11]。尽管GDF与GDF8的成熟体高度同源,这是众多研究存在争议的地方,但是他们的前肽在蛋白序列中仅有49%的同源性,究竟哪一部分具有延缓衰老的作用目前尚未可知。本研究分别构建了包含C端成熟结构域、N端结构域和GDF11前体的质粒,通过过表达相关结构域,结合转录组测序和莫里斯水迷宫实验(Morris water maze, MWM),分别从细胞和动物水平来探索GDF11是否有延缓衰老,提高认知水平的能力。
1 材料与方法
1.1 细胞培养
293T细胞来自本实验室;胎牛血清(FBS),DMEM培养基、0.25%胰蛋白酶购自美国Gibco公司,于含10% FBS、100 U/mL青霉素、100 μg/mL链霉素和DMEM/F12的培养基中培养293T细胞,置于37 ℃、5%CO2细胞培养箱中培养。根据细胞生长情况,每2~3天更换培养基。
1.2 质粒构建与转染
将GDF11-C端活性结构域、N端结构域和GDF11前体构建于AAVS1 Donor载体上。使用LipoFiterTM3.0脂质体转染试剂(汉恒生物科技有限公司)进行转染。
1.3 RNA提取与RT-qPCR
使用TRIzol试剂(Invitrogen公司)分离细胞总RNA,之后通过DNA酶处理和去除试剂盒(Ambion公司)进一步纯化RNA。使用SuperScript Ⅲ First-Strand Synthesis试剂盒(Invitrogen公司),将RNA样品(每个1 μg)反转录为cDNA。使用SYBR Premix Ex Taq和ROX(Bio-Rad公司)在7500或Q7实时PCR系统(Applied Biosystems公司)上进行RT-qPCR。引物信息如下。GDF11-N(5′→3′): ACAGTGGACTTT-GAGGCTTTC(正向),TAAGAGCAGCCACAGC-GAT(反向);GDF-C(5′→3′): GCCTTTGATC-CCAGTGGCACAGAC(正向),AGTCCCAGCCGA-AAGCCTCAAAGT(反向)。
1.4 流式细胞仪检测细胞周期
收集对数生长期的细胞以1×104/孔接种于6孔板,每组设置3个复孔,贴壁培养过夜后转染48 h后,终止培养,用0.25% Trypsin EDTA消化细胞,离心(300×g,5 min),之后弃上清液,预冷PBS洗涤细胞3次。用预冷的70%无水乙醇固定过夜,再加入碘化丙啶染色液200 μL,避光染色30 min,之后用流式细胞仪检测。用FlowJo软件分析细胞周期。该实验进行3次以上统计分析。
1.5 实验动物及尾静脉高压注射
C57BL/6 SPF小鼠(8月龄)从上海斯莱克实验动物有限公司获得。每个笼子中饲养5只小鼠,按12 h光照/黑暗时间表饲养,并自由进食和饮水,饲养至15月龄。动物实验方案经同济大学医学院动物研究委员会批准。将小鼠按每组5只分为4组,通过尾静脉高压注射的方式注射质粒,按小鼠体重10%计算质粒注射溶液的体积,于5~7 s将100 μg/mL的质粒快速推入小鼠体内。
1.6 MWM
MWM用于测量基于海马的空间记忆和学习功能。MWM设备由一个圆形池(直径为1.2 m)组成,水温保持在24~26 ℃。一个干净的圆形逃生平台(直径11 cm)浸没在水面以下约1.5 cm处。为了从水中逃生,小鼠不得不找到隐藏的逃生平台。每次采集试验都是通过将小鼠放在面对水箱壁的水中进行。培训方案为期5 d(每天进行4次试验)。对于每个试验,将动物放在4个可能位置之一附近的迷宫中: 北、南、东南或西北。每个试验均随机确定位置。在每次试验期间,给动物60 s以定位浸没平台。如果小鼠没有找到平台,它将被轻轻地带到平台上。找到或被引导到平台后,将动物留在平台上20 s,以熟悉其在视觉提示方面的位置。在5只小鼠的小队中对动物进行测试,每个测试小队中均代表所有治疗组。每只小鼠的审判间隔大约为20 min。训练后24 h,对小鼠进行试验。在探测试验期间,将平台移开,让小鼠在水池中游泳60 s。游泳池中央天花板上安装了一个摄像头,用于跟踪小鼠的游泳路线。使用计算机化的动物跟踪系统(Etho Vision XT Base;英国诺丁汉Noldus公司)收集数据,该系统记录了路径长度,游泳速度,在池的每个象限中花费的时间,以及到达平台所花费的时间,在平台区停留的时间。试验始终在下午1~5点进行。
1.7 RNA测序和数据分析
用TRIzol(Invitrogen公司)从细胞中提取总RNA,并用分光光度计(NanoDrop 1000; Thermo Fisher Scientific公司)进行定量,使用(260/280 nm>1.8)的样品。本研究使用DNBSEQ平台对样本进行测序,在数据分析前首先去除低质量、位置碱基N含量过高的reads,以此保证结果的可靠性。使用Bowtie v2.0.6(bowtie-bio.sourceforge.net/bowtie2)构建参考基因组的索引,并使用TopHatv2.0.9(ccb.jhu.edu/software/tophat)将配对末端的干净读数与参考基因组进行比对。基于基因长度和映射到该基因的阅读计数,并考虑测序深度和基因长度对同时进行的阅读计数的影响,计算出每千个转录本的读数。使用R(R-project.org)进行WGCNA和KEGG富集分析,P<0.05具有显著性。其他数据均采用统计软件SPSS 2.0进行分析,两组数据之间的比较采用双侧t检验,单因素方差分析比较3组或3组以上之间的差异,P<0.05为差异有统计学意义(测序数据可以根据需要联系通信作者,将予以提供)。
2 结 果
2.1 GDF11C端成熟结构域、N端前肽和GDF11前体质粒构建
如图1A所示,GDF11蛋白在合成过程中,首先被翻译为无活性的前体蛋白同型二聚体,包括信号肽、N端前肽和C端活性结构域三部分。之后GDF11前体蛋白同型二聚体被弗林蛋白酶(Furin)进行初始蛋白水解,从C端活性域切割N端前肽。之后由BMP1/TLD蛋白酶介导第二步蛋白水解,切割N-末端前肽并释放出成熟的GDF11二聚体。因此,分别构建了含有完整的GDF11序列的GDF11前体质粒(GDF-FL),只编码C端活性结构域(GDF11-C)和N端结构域(GDF-N)的序列的质粒载体。之后将3种质粒以及空载质粒(Vec)转染到293T细胞中,从而实现在细胞中过表达的目的。如图1B所示,在转染质粒后,GDF11-FL和GDF11-N组相较于Vec组的GDF-N(P<0.001)表达水平显著升高;GDF11-F和GDF11-C组相较于Vec组的GDF-C(P<0.001)表达水平也出现了显著升高,以上结果说明质粒转染效率极高,可用于之后的转录组测序以及小鼠尾静脉高压注射实验。
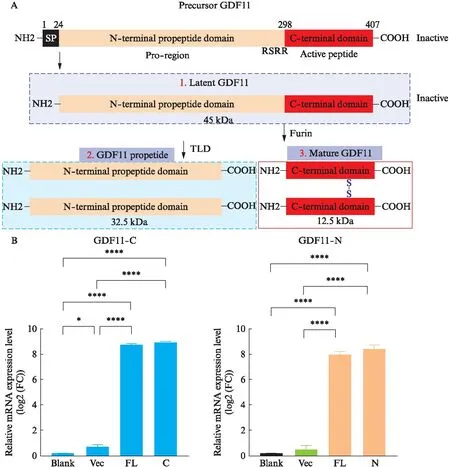
图1 质粒转染细胞效率检测Fig.1 The efficiency of cell transfection of plasmidsA: GDF11蛋白在合成过程示意图;B: 293T细胞转染质粒后GDF11-FL、GDF11-N和GDF11-C的表达;*P<0.05,***P<0.01,****P<0.001
2.2 GDF11-C端成熟域增强细胞的氧化磷酸化
为了研究3种不同结构域的GDF11对细胞的调控机制,对转染了3种质粒的293T细胞进行转录组测序,并进行了加权基因共表达网络分析(WGCNA)。根据分层聚类树(图2A),共得到6个非灰基因模块,从图中可以看出转染GDF11前体序列质粒的细胞与空白对照组和空载组表达模式相近,而转染C、N两种结构域的质粒与空白和空载组存在明显差异。通过计算模块与样本间的相关系数(图2B),发现Green(R2=0.99,P<0.01)、Blue(R2=0.62,P<0.05)模块基因的表达与GDF11-C(C.GDF11)组表现出极高的正相关性,Brown(R2=0.88,P<0.01)和Red(R2=0.64,P<0.05)模块与GDF11-N(N.GDF11)组表现出极高的正相关性。如图2C所示,该相关性在各组样品间具有很好的一致性。为了进一步寻找GDF11-C(C.GDF11)和GDF11-N(N.GDF11)参与的信号通路,对Green、Blue、Brown和Red等4个模块进行了富集通路分析(图2D),发现两种不同的GDF11结构域都参与了氧化磷酸化通路和细胞周期信号通路。

图2 GDF11调控机制分析Fig.2 Analysis of the regulatory mechanism of GDF11A: WGCNA分析;B: WGCNA模块与不同类型GDF11的相关性分析;C: 各样本在不同模块中的相关性分析;D: 各模块富集到的通路以及关键调控基因
2.3 GDF11-C端成熟域可以促进细胞增殖
根据本研究2.2部分,GDF11-C和GDF11-N与Brown模块都有正相关性,而Brown模块富集到了细胞周期信号通路,所以接下来对转染了GDF11-C、GDF11-N和Vec质粒的293T细胞进行细胞周期检测。流式细胞结果(图3)显示,与Vec组比较,GDF11-C组的G1期细胞比例下降(P<0.05),S期细胞比例出现上调,但差异无统计学意义(P=0.36);而GDF11-N组与Vec组相比,各个时期皆无显著差异。由此可以看出,GDF11-C具有促进细胞增殖能力。

图3 GDF11-C和GDF11-N对293T细胞周期的影响Fig.3 Effects of GDF11-C and GDF11-N on 293T cell cycle每组两个样本,*P<0.05,***P<0.01
2.4 GDF11-C端成熟域可改善老年小鼠认知水平
在细胞水平确定了GDF11-C对细胞增殖的影响,接下来为了确定不同前肽对老年小鼠认知的影响,通过尾静脉高压注射质粒过表达相关结构域的基因来确定GDF11-C对老年小鼠的空间学习和记忆的影响。对15个月大的小鼠每5天用尾静脉高压注射Vec、GDF11-C、GDF11-N和GDF11-FL等4种质粒,共4次。随后,使用MWM测试来检查小鼠对空间学习和记忆能力。首先使用隐藏平台进行了5 d的训练试验,然后在24 h内测试了短期记忆力保持力。结果显示,在训练期间GDF11-C和GDF11-FL组的小鼠寻找到平台时间缩短较明显(图3A)。此外在正式测试中,通过首次上平台时间(图4B),GDF11-C组到达虚拟平台的能力显著增强(P<0.05)。根据穿越平台次数的数据(图4C),GDF11-C组也表现出一定程度的提高。而且4组之间的游泳速度并无显著差异(图4D),表明各组之间存在可比性。综上所述,GDF11-C端成熟域可以增强老年小鼠空间学习和记忆能力。
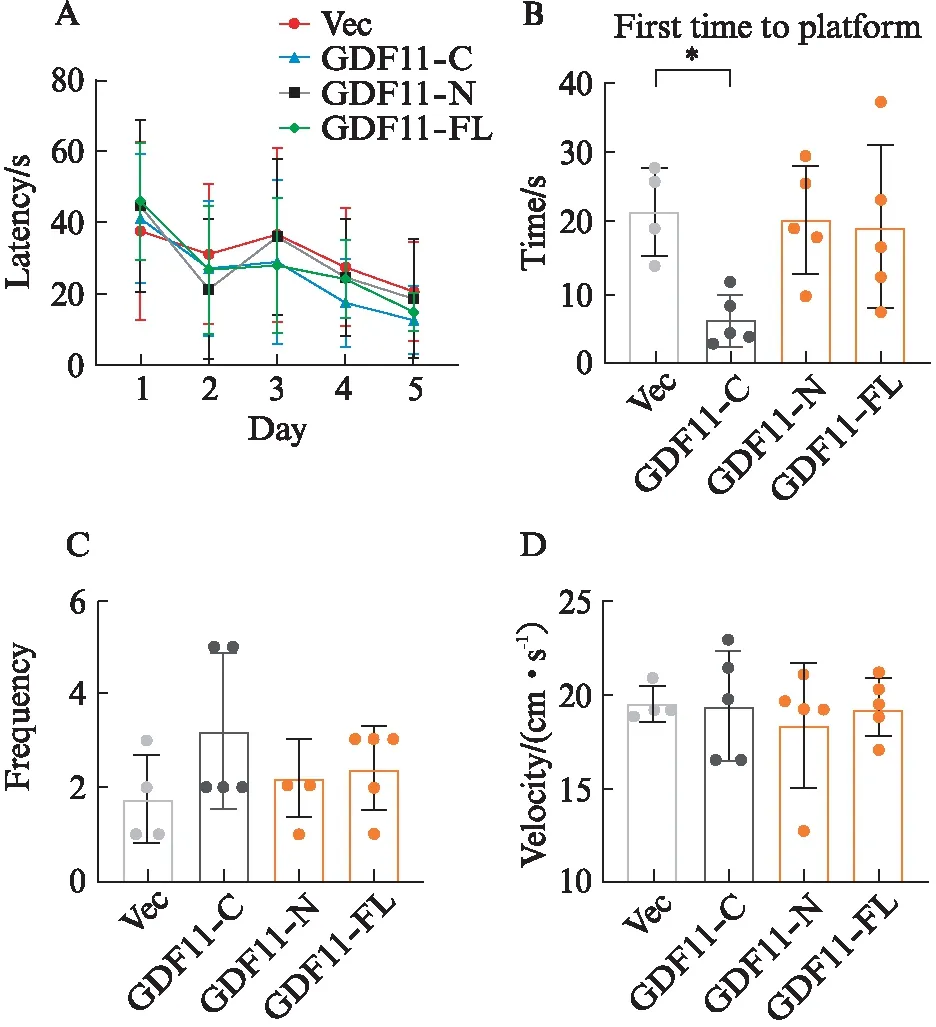
图4 GDF11-C改善了老年小鼠的空间学习和记忆能力Fig.4 GDF11-C improved spatial learning and memory in elderly miceA: 训练期间小鼠寻找到平台所用时间;B: 小鼠在测试中第1次找到平台区域的时间;C: 测试时小鼠穿越平台区域的频率;D: 测试中小鼠游泳速度;*P<0.05
3 讨 论
之前关于GDF11对延缓衰老的研究都是通过使用GDF11重组蛋白来进,研究发现GDF11可以改善衰老小鼠的神经发生和肌肉增殖[8,12-13],其中多个研究发现GDF11可以增加老年小鼠SVZ中神经干细胞的数量和血管密度,具有增加老年小鼠海马中的突触可塑性提高认知的潜力[13-14]。然而这些研究一直受到挑战,研究发现GDF8与GDF11在各自的活性域高度相似,所以部分学者认为研究人员混淆了GDF8和GDF11,GDF11并不是一个伴随着年龄下降的循环因子,随年龄下降是GDF8,这导致之后使用GDF11重组蛋白做的研究存在着争议[15]。因此,使用GDF11的活性结构域能否延缓衰老还需要进一步的研究。
在本研究中,为了避免使用常见的GDF11活性结构域重组蛋白引起的争议,分别构建了包含C端成熟结构域、N端结构域和GDF11前体的质粒,以探索GDF11的成熟结构域能否发挥延缓衰老的作用,或者是否其他的结构域和蛋白前体存在着延缓衰老的功能。通过转录组测序,结果显示,过表达GDF11-C端活性结构域后,在转录调控水平中GDF-C和GDF-N两种结构域存在着相似的共表达模式,共同激活了氧化磷酸化和细胞周期通路,但两者也存在着不同,这些不同可能是导致其功能差异的关键。有研究报道TGF-β家族活性域可以通过TGF-β-ActRⅡ-Smad 2/3信号轴起到调控作用[16-20],在本研究中未发现此通路。
本研究通过过表达GDF11-C端活性结构域,证明了GDF11活性结构域具有延缓衰老的能力。在细胞水平中,细胞周期与细胞衰老密切相关[21],GDF11-C端活性域可以减少细胞周期中G1期细胞的比例(P<0.05),增加S期细胞比例,具有促进细胞增殖的潜力。而在动物水平中,通过MWM,发现GDF11-C端活性域可以显著提高老年小鼠的空间记忆和学习能力(P<0.05),延缓衰老引起的记忆力下降。同时,通过MWM中的游泳速度数据,发现老年小鼠的运动能力并没有提高,这与前人研究不同[11,22],说明GDF11-C端活性域并没有改善老年小鼠肌肉强度的能力。
虽然本研究通过使用非重组蛋白的方法证明了GDF11活性域具有提高老年小鼠认知能力的潜力,但是依然无法解决重组蛋白GDF11和GDF8高度同源的问题,通过构建载体过表达GDF11活性域并不是一种可行性高的的临床干预手段。其次,与前人相似,本研究没有对GDF11活性域提高认知的调控机制进行深入研究,这依然是一个黑箱结果,具有大量的研究空白。因此,GDF11在延缓衰老等领域依然需要广泛而深远入的研究。
——一道江苏高考题的奥秘解读和拓展

