吡虫啉单克隆抗体的制备及其间接竞争化学发光酶联免疫分析方法的建立
谢 波,柳心梅,卢迪莎,程勇健,罗 林,肖治理
(广东省食品质量安全重点实验室 华南农业大学食品学院,广东 广州 510642)
吡虫啉(Imidacloprid,IMI),又名1-(6-氯吡啶-3-吡啶基甲基)-N-硝基亚咪唑烷-2-基胺,是使用最普遍的烟碱类农药之一[1],主要用于防治水稻、蔬菜、棉花等作物上的刺吸式口器害虫,如蚜虫、叶蝉、白粉虱等[2]。吡虫啉通过作用于昆虫的乙酰胆碱受体而使害虫麻痹,最终死亡[3-4]。已有研究表明,吡虫啉可大量在地表水、土壤、湿地等多种环境介质中聚集,也会富聚在食物表面[5-6]。大剂量的吡虫啉会引起动物胸腺、胰腺、骨髓的退行性改变,长期食用含有吡虫啉残留的农产品,还会对人体胃粘膜造成一定的损伤[7-8]。我国对吡虫啉制定的限量标准中水果蔬菜的最大残留限量最低为0.05 mg/kg[9]。因此,对食品中的吡虫啉残留加强检测监控显得十分必要。
吡虫啉的检测方法主要有仪器法和免疫分析方法,仪器法主要包括气相色谱法(GC)[10]、高效液相色谱法(HPLC)等[11-12]。这些方法虽然能准确检测吡虫啉残留,但样品前处理和操作复杂,设备昂贵,且需要配备专业的技术人员,成本较高,不适用于大批量样品的筛选和现场检测。基于抗原抗体特异性反应的免疫分析方法因具有灵敏度高、特异性好、方便快速等优势,成为研究的热点。常用的免疫分析方法有胶体金免疫层析法[13-14]、酶联免疫分析法(ELISA)[15-16]等。与其它免疫分析法相比,胶体金免疫层析法灵敏度较低,通常只能实现半定量检测。ELISA法采用辣根过氧化物酶(HRP)等标记抗原或抗体,通过酶催化底物的显色反应进行定量,但常规ELISA方法采用四甲基联苯胺和过氧化氢作为底物,其灵敏度有限,有时不能满足检测限量低的药物的检测要求。
化学发光酶联免疫分析法(CLEIA)基于酶联免疫分析的基本原理,采用具有化学发光特性的鲁米诺、异鲁米诺、吖啶酯等为底物,通过测定其化学发光信号的强弱间接测定目标抗原或抗体的浓度。该方法将高特异性的免疫反应与高灵敏度的化学发光反应相结合,灵敏度更高,稳定性好[17-18]。
目前基于吡虫啉单克隆抗体的间接竞争酶联免疫分析(ic-CLEIA)方法尚未见报道。本研究在成功合成吡虫啉半抗原的基础上制备出特异性高的单克隆抗体,基于该单克隆抗体建立了ic-CLEIA 方法,可实现吡虫啉残留的快速、灵敏检测。
1 实验部分
1.1 试剂与材料
RPMI-1640 基础培养基、HAT 培养基、HT 培养基、新生胎牛血清、聚乙二醇(PEG 4000)(美国Gibco 公司);冻存液(新赛美生物科技有限公司);钥孔血蓝蛋白(KLH)、牛血清白蛋白(BSA)、弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)、辣根过氧化物酶标记的羊抗鼠IgG(IgG-HRP)(美国Sigma公司);3-巯基丙酸、二甲基亚砜(DMSO)、N-羟基琥珀酰亚胺(NHS)、碳二亚胺(EDC)、乙酸乙酯、无水硫酸钠、N,N-二甲基甲酰胺均为分析纯,购自广州化学试剂厂;TMB 显色液(北京索莱宝科技有限公司);化学发光底物液A 和B(鲁米诺化学发光底物液,湖州英创生物科技有限公司);鼠源单克隆抗体亚型检测试剂盒(美国Sigma公司);吡虫啉标准品、呋虫胺标准品、啶虫脒标准品、噻虫胺标准品、噻虫啉标准品、噻虫嗪标准品(美国Sigma公司);ProteinIsoTMProtein G亲和层析介质(美国Sigma公司);其他化学试剂均为国产分析纯。
1.2 仪器设备
SpectraMax L 化学发光读板器(美国Molecular Devices 公司);NanoDrop 紫外分光光度计(美国Thermo 公司);磁力搅拌器(金坛市恒丰仪器厂);微量振荡器(常州澳华有限公司);高速离心机、微量可调移液器(i国Eppendorf公司);电子分析天平(梅特勒公司);96孔酶标板、96孔白色发光板(深圳金灿华实业有限公司);DEM-3型自动洗板机(美国Thermo公司);Agilent(1290-6470)型高效液相色谱仪(美国Agilent公司);蛋白电泳仪(SDS-PAGE,美国BIO-RAD公司)。
1.3 实验方法
1.3.1 半抗原的合成与鉴定 吡虫啉半抗原的合成参考文献[19]方法,合成路线如图1所示,将吡虫啉原药与3-巯基丙酸通过取代反应获得吡虫啉半抗原{1-[6-(2-羧基乙硫基)-3-吡啶基甲基]-N-硝基亚咪唑烷-2-叉胺}(IMPA),柱层析法纯化后,采用质谱法(MS-ESI)鉴定。
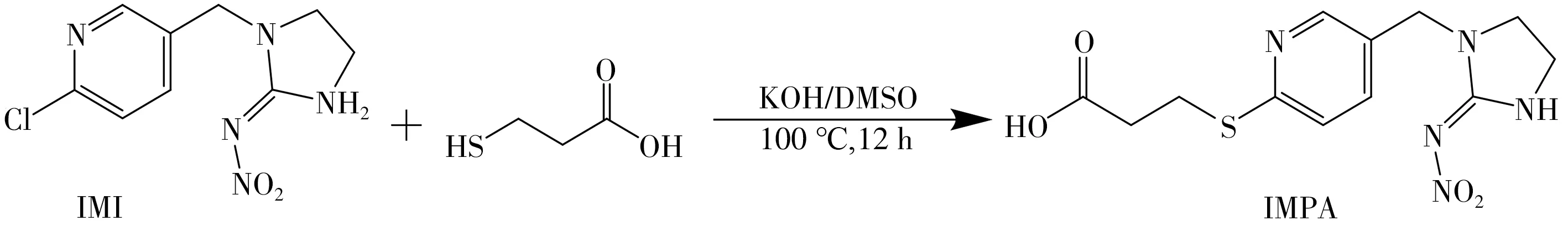
图1 吡虫啉半抗原合成路线Fig.1 Synthetic route of imidacloprid hapten
1.3.2 完全抗原的合成与鉴定 通过活泼酯法[20]将半抗原与载体蛋白KLH 和BSA 偶联,获得完全抗原IMPA-KLH、IMPA-BSA,其中IMPA-KLH 作为免疫原,IMPA-BSA 作为包被原。合成路线如图2所示,采用紫外扫描法进行鉴定[21]。
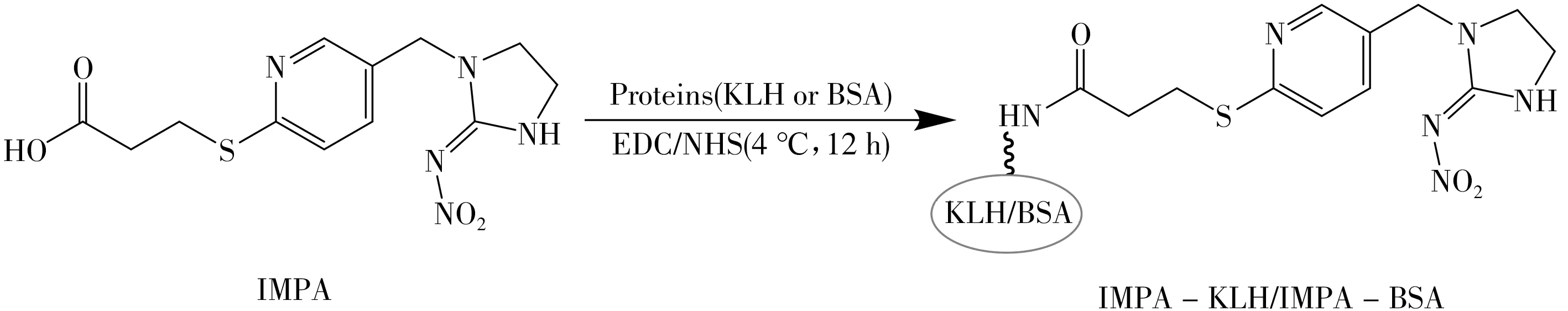
图2 完全抗原合成路线图Fig.2 Synthetic route of complete antigens
1.3.3 单克隆抗体的制备、纯化及鉴定 取7 ~8 周龄的Balb/c 雌性小鼠,将500 μL 完全抗原IMPAKLH(1 mg/mL)与500 μL佐剂乳化,免疫5只小鼠,每只小鼠每次免疫200 μL。在小鼠腹腔、背部、皮下等进行多点注射,每隔2 周加强免疫1 次[22]。从第3 次免疫开始,每次免疫1 周后于小鼠尾部取血,以ELISA 检测效价,ic-ELISA 测定抑制率[23]。选取血清效果最好的小鼠获取脾细胞与sp2/0细胞,并在PEG4000 的作用下融合[24],用ic-ELISA 方法筛选能特异性识别吡虫啉药物的阳性孔。通过有限稀释法对阳性孔进行筛选,筛出能稳定分泌吡虫啉抗体的细胞株。将细胞注入小鼠腹腔以诱导腹水,腹水通过Protein G 柱[25]纯化得到单克隆抗体,采用SDS-PAGE凝胶电泳[26]验证纯化效果,以鼠源单克隆抗体亚型试剂盒[27]鉴定抗体亚型。
1.3.4 ic-CLEIA 方法操作步骤 用包被液将包被原IMPA-BSA 稀释至一定浓度,加至化学发光酶标板孔中,每孔100 μL,37 ℃孵育过夜。洗板机洗涤2 次,甩干,每孔加入封闭液(含2%BSA 的磷酸盐吐温缓冲液(PBST))130 μL,37℃温育箱中温育3 h,甩干孔中封闭液,置37 ℃烘箱中烘1 h,备用;用磷酸盐(PBS)缓冲液将吡虫啉稀释至系列浓度,抗体稀释至系列梯度,每孔分别加入不同浓度的吡虫啉标准液和抗体稀释液各50 μL,轻摇混合,37 ℃恒温箱中孵育30 min。洗板机洗涤5次,拍干,加入5 000 倍稀释的IgG-HRP,37 ℃温育箱中温育30 min,洗板机洗涤5 次,甩干;加入等体积混合的化学发光A 液和B 液100 μL,立即用化学发光仪测定其相对发光值(RLU)。以吡虫啉标准物药物浓度的对数为横坐标,RLU/RLUmax为纵坐标(RLUmax表示药物浓度为0时的发光值),应用Origin 软件拟合标准曲线。
1.3.5 ic-CLEIA 方法条件优化 采用棋盘滴定法,将包被原IMPA-BSA(初始质量浓度为1 mg/mL)进行倍比稀释,稀释倍数分别为4 000、8 000、16 000、32 000、64 000;将吡虫啉单克隆抗体(初始质量浓度为6.6 mg/mL)进行倍比稀释,稀释倍数与IMPA-BSA 相同。按照“1.3.4”步骤进行实验,根据RLU7/RLUmax>0.8 且RLU1/RLUmax<0.2 的原则[28]筛选出包被原和抗体稀释倍数范围,其中RLU1表示加入最大药物浓度对应的发光值,RLU7表示加入最小药物浓度对应的发光值。在此基础上进行包被原和抗体最适工作浓度优化。按照“1.3.4”步骤进行实验,建立标准曲线,选择IC50(半抑制浓度)较低、RLUmax/IC50较高,RLUmax适中的条件作为最佳反应条件[29]。
在最佳包被原和抗体浓度下进行ic-CLEIA 实验,考察缓冲体系(PBS、PBST、Tris-HCl)、缓冲液的pH 值(5.4、6.4、7.4、8.4)、一抗反应时间(20、30、40、50 min)、酶标二抗稀释倍数(4 000、5 000、6 000、7 000倍)对ic-CLEIA 方法的影响。同样以RLUmax/IC50较高、IC50较低、RLUmax适中的条件为ic-CLEIA最佳反应条件。
1.3.6 ic-CLEIA 特异性实验 单克隆抗体识别吡虫啉的特异性用交叉反应率(CR)表示,即吡虫啉的IC50与结构类似物IC50比值的百分数。对吡虫啉结构类似物的CR 越小,表明该方法的特异性越高。其计算公式如下:

1.3.7 样品前处理 参考文献[30]进行样品前处理:称取约10 g样品于50 mL离心管中,加入10 mL饱和氯化钠(三级水中饱和)浸泡5 min,在涡旋式振荡器上振荡1 min,然后超声10 min,加入9 mL混合有机溶剂(乙腈∶二氯甲烷=16∶2,体积比)及4 mL 正己烷,振荡1 min,超声5 min,4 000 r/min 离心5 min,将中层液移至15 mL离心管中,样品残渣继续加入6 mL乙腈-二氯甲烷(16∶2)混合溶剂,以4 mL正己烷提取2次,合并提取液。在氮吹仪中(45 ℃水浴)吹干,用PBS溶液复溶,放入4 ℃冰箱保存,待测。
黄瓜和苹果样品参考以上方法前处理后用PBS 缓冲液分别稀释适当倍数,以稀释后的溶液作为缓冲液,进行ic-CLEIA实验,建立标准曲线,考察基质效应消除条件。
1.3.8 加标回收实验 根据ic-CLEIA 方法检测范围,在空白样品中添加低、中、高(5、10、20 ng/g)3个水平的吡虫啉标准品,经“1.3.7”样品前处理后获得提取液。提取液经ic-CLEIA 方法检测,每个浓度重复测定3次,计算加标回收率和相对标准偏差(RSD)。
1.3.9 实际样品检测 从周边市场上分别购买黄瓜和苹果样品各5 个,经“1.3.7”样品前处理后分别用ic-CLEIA方法和高效液相色谱法(HPLC)[30]检测,对比分析两种方法的检测结果。
HPLC 法条件如下:色谱柱为UG 120-C18柱(250 mm × 4.6 mm,0.5 μm);柱温:30 ℃,流速:1.0 mL/min,进样量:20 μL。流动相由水(A)和乙腈溶液(B)组成,梯度洗脱条件为:0 ~15 min,5% B,15 ~17 min,30%B,17 ~20 min,10%B,20 ~30 min,5%B。
2 结果与分析
2.1 半抗原的鉴定
半抗原采用质谱法(MS-ESI)进行鉴定,结果如图3所示。半抗原IMPA 的相对分子质量为325,质谱图中m/z326.2 处有一个超强信号峰,在氢离子的正离子模式下,比设计的IMPA 相对分子质量大1,符合预期分子量。说明IMPA成功合成。
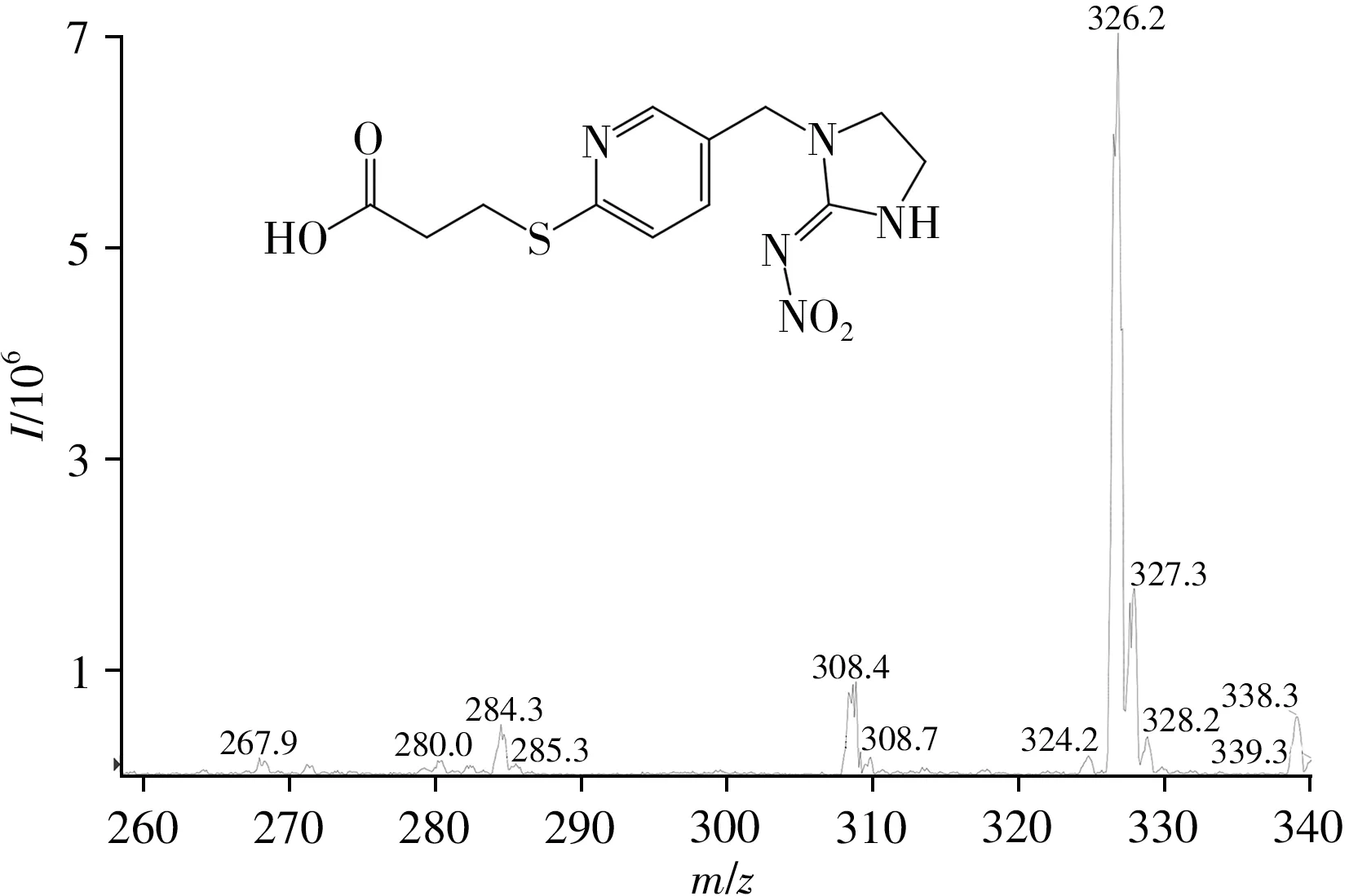
图3 IMPA的MS-ESI鉴定图谱Fig.3 Identification result of IMPA by MS-ESI
2.2 完全抗原的鉴定
半抗原、载体蛋白和完全抗原具有不同的紫外特征吸收峰,当完全抗原的吸收峰中含有半抗原、载体蛋白的特征吸收峰或其最大吸收峰相对于载体蛋白有明显偏移时,证明完全抗原偶联成功。如图4 所示,完全抗原的紫外吸收峰与半抗原、载体蛋白的紫外吸收峰相比均有明显偏移,不相互重叠,表明完全抗原偶联成功。
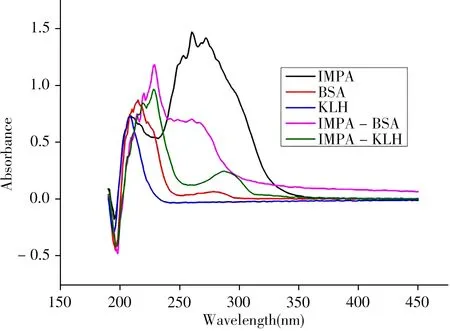
图4 吡虫啉半抗原IMPA与完全抗原的紫外扫描图谱Fig.4 UV spectra of imidacloprid hapten IMPA and complete antigens
2.3 单克隆抗体的制备、纯化及鉴定
(1)细胞株的建立:小鼠在第4 次免疫后进行细胞融合获得杂交瘤细胞,经3 ~4轮有限稀释后,最终筛选得到稳定分泌吡虫啉单克隆抗体的细胞一株,命名为IMPA-X。
(2)抗体的制备:将杂交瘤细胞注入小鼠腹腔,7 d后小鼠腹腔因诱导出腹水而明显胀大,此时取出腹水并离心去掉脂肪和杂质,4 ℃冰箱保存,备用。
(3)抗体的纯化及鉴定:采用Protein G 柱纯化小鼠腹水,得到吡虫啉单克隆抗体。纯化后的抗体经紫外分光光度计测得质量浓度为6.6 mg/mL。通过SDS-PAGE凝胶电泳验证纯化效果,其电泳图如图5所示。纯化后的抗体在未还原的情况下只有一个条带,约为150 kDa,即标记为“2”的条带;高温还原后因抗体二硫键断裂,会出现两个条带,一条为重链,约为50 kDa;一条为轻链,约为25 kDa,即标记为“3”中的两个条带,表明抗体纯化成功。
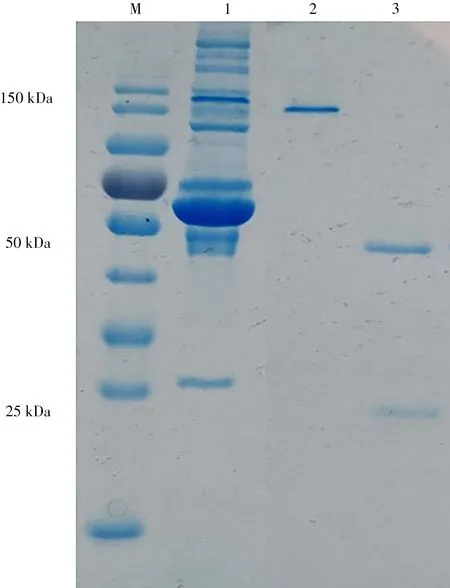
图5 吡虫啉单克隆抗体的SDS-PAGE凝胶电泳图Fig.5 SDS-PAGE electropherogram of imidacloprid monoclonal antibody
2.4 ic-CLEIA条件的优化
2.4.1 包被原、抗体最适工作浓度的确定 根据RLU7/RLUmax>0.8 且RLU1/RLUmax<0.2 的原则,结合棋盘法的测定结果,确定包被原和抗体的稀释倍数均在1∶4 000 ~1∶64 000之间。
在此基础上进行包被原和抗体最适工作浓度优化。按照“1.3.4”的步骤进行ic-CLEIA 实验。结果表明,当包被原稀释倍数为1∶16 000,抗体稀释倍数为1∶64 000 时,其IC50较低,RLUmax/IC50较高,此时包被原和抗体的工作质量浓度分别为62.50 ng/mL和103.12 ng/mL。
2.4.2 最佳缓冲溶液、缓冲溶液pH 值、一抗反应时间及酶标二抗稀释倍数的优化 依据RLUmax、IC50和RLUmax/IC503 个指标,确定最佳反应缓冲溶液为0.01 mol/L 的PBS,缓冲溶液的最佳pH 值为7.4,最佳一抗反应时间为30 min,酶标二抗稀释倍数为1∶7 000。
2.4.3 ic-CLEIA标准曲线 优化后的最佳条件为:包被原质量浓度62.50 ng/mL,抗体质量浓度103.12 ng/mL,缓冲液PBS(pH 7.4),一抗竞争反应时间30 min,酶标二抗稀释倍数1∶7 000。根据ic-CLEIA 优化条件进行实验并绘制标准曲线,结果如图6 所示。该方法线性范围(IC20~IC80)为0.083 ~3.99 ng/mL,IC50为0.57 ng/mL,检出限IC10为0.03 ng/mL。
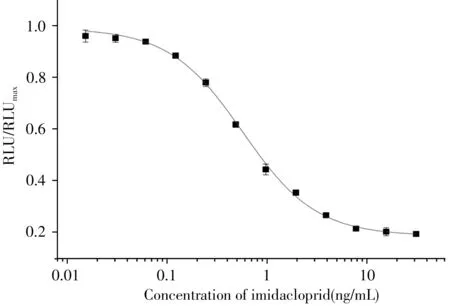
图6 检测吡虫啉的ic-CLEIA标准曲线Fig.6 Standard curve of ic-CLEIA method for imidacloprid detection
2.5 ic-CLEIA特异性分析
选择氯噻啉、噻虫胺、呋虫胺、啶虫脒、噻虫啉、噻虫嗪6 种吡虫啉结构类似物,用ic-CLEIA 测定其IC50,以验证该方法的特异性。结果如表1 所示,方法与氯噻啉的交叉反应率为2.2%,与噻虫胺等5种吡虫啉结构类似物无明显交叉反应,表明建立的ic-CLEIA方法特异性较好。
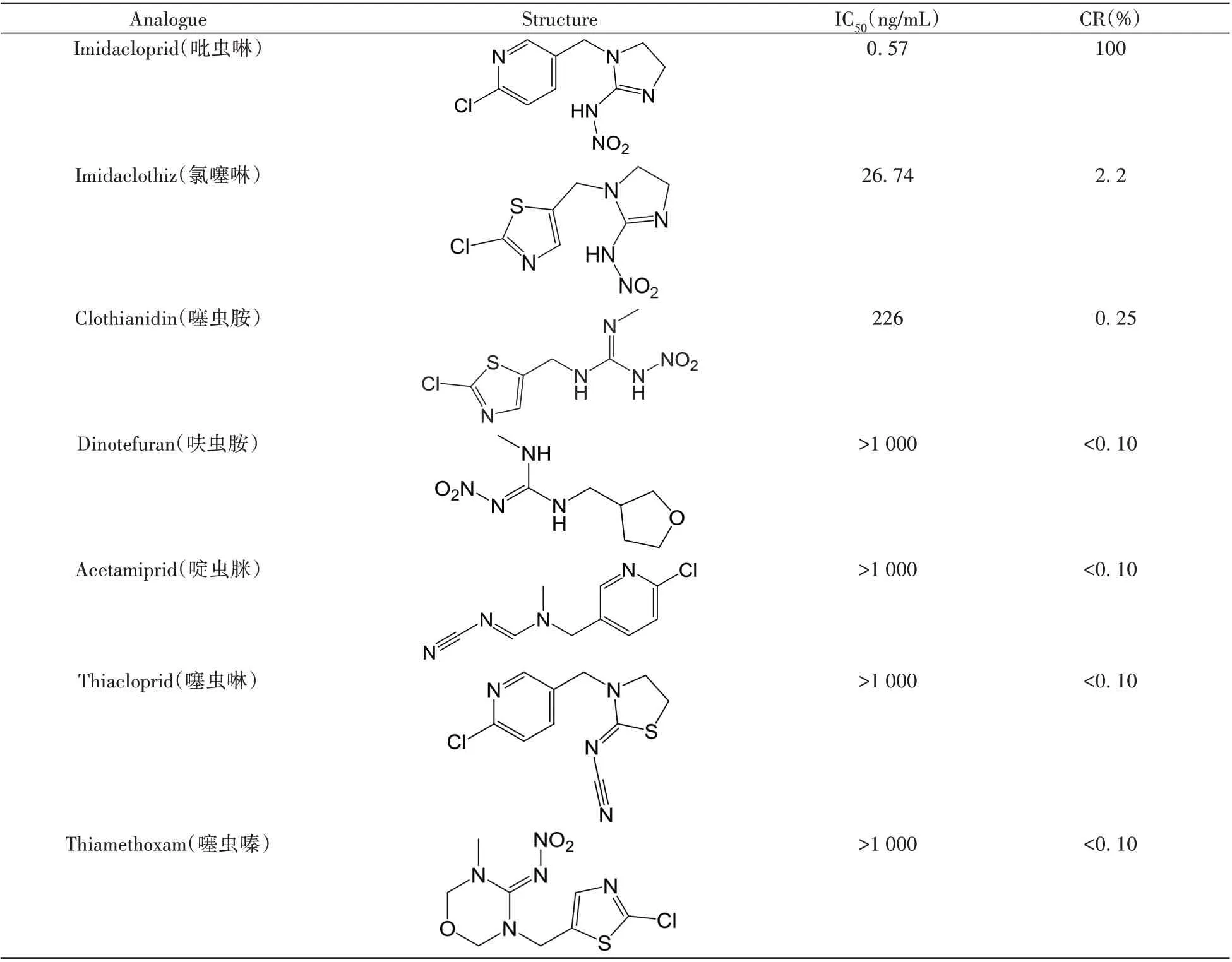
表1 吡虫啉ic-CLEIA方法的交叉反应率Table 1 Cross reaction rate of ic-CLEIA method on imidacloprid
2.6 基质效应
基质效应测定结果如图7所示,黄瓜和苹果样品分别稀释20倍、10倍后建立的标准曲线与方法的标准曲线基本重合,可认为该条件下基质效应基本被消除。
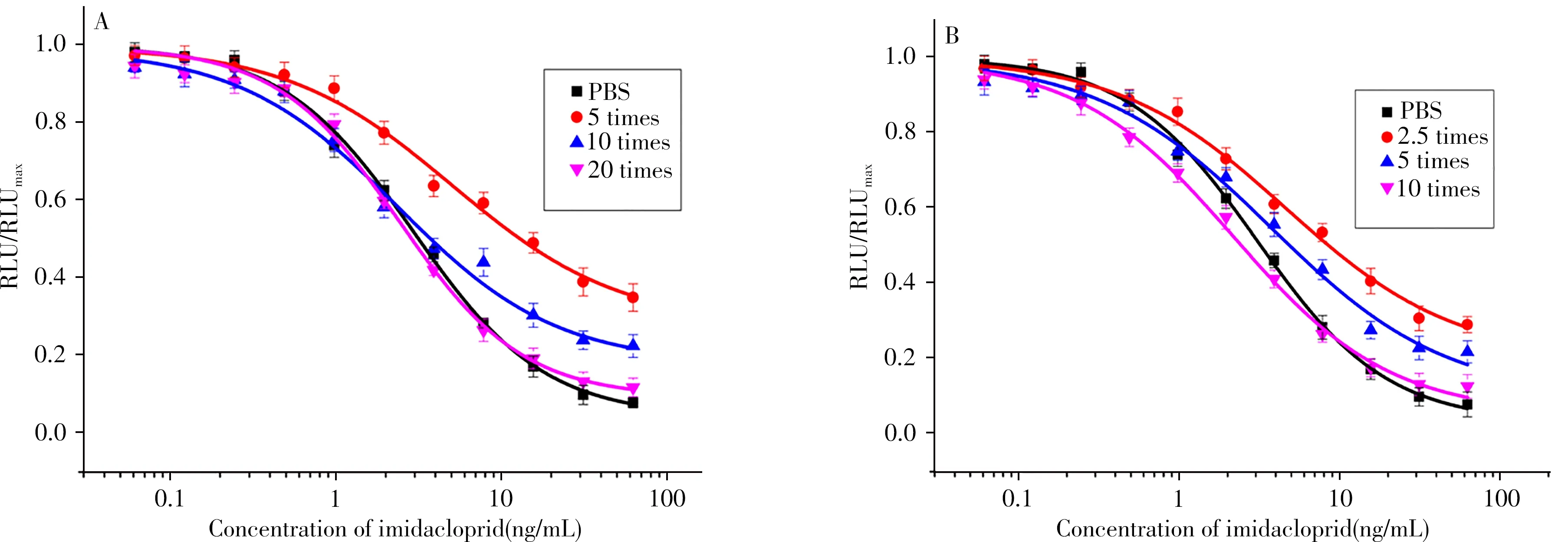
图7 基质效应消除曲线Fig.7 Elimination of matrix effect in real samples
2.7 加标回收实验
黄瓜和苹果样品中分别添加5、10、20 ng/g的吡虫啉标准品,样品前处理后用ic-CLEIA方法进行测定。结果如表2 所示,黄瓜样品的加标回收率为86. 0% ~102%,苹果样品为82. 0% ~112%,相对标准偏差均小于15%。表明该方法准确度较高,可用于蔬菜水果中吡虫啉残留的检测。

表2 吡虫啉ic-CLEIA方法的加标回收实验结果Table 2 Results of addition and recovery experiment of imidacloprid with ic-CLEIA method
2.8 仪器方法验证
从周边市场购买苹果和黄瓜样品各5 份,样品前处理后分别用HPLC 和ic-CLEIA 进行测定。以HPLC法测得的吡虫啉浓度为X轴,ic-CLEIA法测得的吡虫啉浓度为Y轴,进行线性回归分析。线性方程为y=0.952x+0.195,相关系数r2为0.989。表明所建立ic-CLEIA 方法的测定结果准确可靠,可用于实际样品测定。
2.9 与其他方法的比较
与表3 所列举的文献相比,本研究基于单克隆抗体建立的检测吡虫啉的ic-CLEIA 方法,灵敏度有所提高,具有良好的应用前景,为开发相应试剂盒产品奠定了基础。
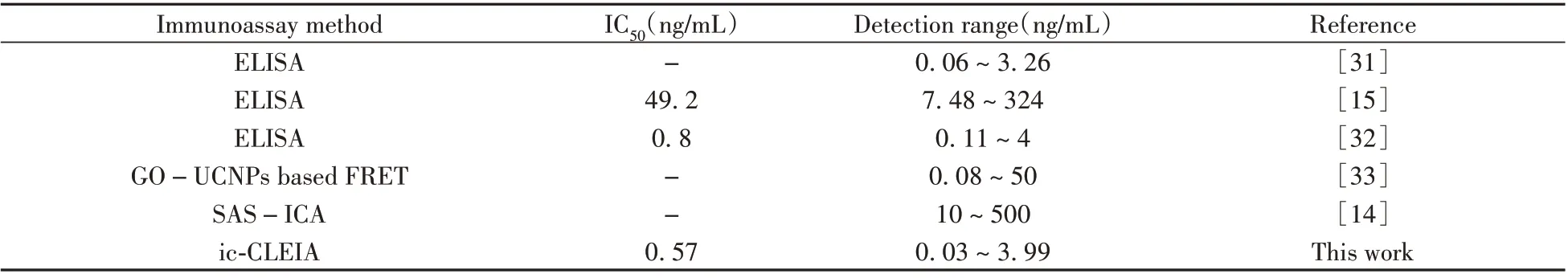
表3 与近年来部分吡虫啉免疫分析方法的对比Table 3 Comparison with some recent literatures on imidacloprid immunoassay
3 结 论
本研究通过将吡虫啉原药与3-巯基丙酸反应获得半抗原,制备得到单克隆抗体,建立了检测吡虫啉的ic-CLEIA方法,方法线性范围(IC20~IC80)为0.083 ~3.99 ng/mL,IC50为0.57 ng/mL,检出限IC10为0.03 ng/mL。与氯噻啉的交叉反应率为2.2%,与噻虫胺等5 种吡虫啉结构类似物无明显交叉反应。对黄瓜和苹果样品的加标回收率为82.0%~112%,且与HPLC 法的测定结果具有良好的相关性。所建立的ic-CLEIA方法特异性较强、结果准确可靠,可用于实际样品中吡虫啉残留的快速检测。

