TRPV1、CRF1在反流性食管炎大鼠下丘脑和食管组织中的表达
年媛媛,刘晓红,孟宪梅,武 勇,陈洪锁,江振宇,郑连生
包头医学院第二附属医院消化内科,内蒙古 包头 014030
胃食管反流病(gastroesophageal reflux disease,GERD)是指胃或十二指肠内容物反流至食管引起一系列不适症状或并发症的一种疾病,是消化系统常见慢性病,还涉及呼吸系统、耳鼻喉科、口腔科等多器官,GERD病程迁延,很多患者需长期、甚至终身服药治疗,给患者身心健康带来严重影响[1-3]。
近期研究显示,GERD的症状产生和食管黏膜损伤,除了化学性物质直接刺激作用之外,炎症、免疫反应、内脏高敏感在GERD发病过程中具有重要作用[4]。我们前期研究也显示,反流性食管炎(reflux esophagitis,RE)大鼠食管组织IL-17、IL-23、COX-2表达量显著增多(文章尚未发表)。既往观点认为,内脏高敏感主要介导非糜烂胃食管反流病(non-erosive reflux disease,NERD)症状产生[5],但NERD动物模型无明确构建方法。根据临床实践,我们推测认为内脏高敏感也参与RE症状产生过程。
辣椒素受体1(transient receptor potential vanilloid type 1,TRPV1)是瞬时受体电位通道的亚型之一,是一种神经系统受体,TRPV1分布于辣椒素敏感传入神经末梢和胞体膜上,广泛分布于胃肠道黏膜层、黏膜下层和肌层,可被多种理化因素、炎症介质直接激活或敏化,参与胃肠动力、分泌和内脏感觉。研究显示,TRPV1与功能性消化不良、肠易激综合征的内脏高敏感及症状发生具有一定相关性[6-8]。但TRPV1在RE中的研究报道较少[9]。
促肾上腺激素释放因子(corticotropin-releasing factor,CRF)是一种神经肽,正常情况下CRF受体在下丘脑表达较低,当机体受到各种应激时,其表达量明显增多;在外周CRF可作用于胃肠道嗜铬细胞和巨噬细胞表面的CRF受体,其中与巨噬细胞表面CRF受体结合后,诱导脱颗粒反应,释放大量前列腺素、细胞因子等活性物质,激活传入神经或背根神经节,形成内脏高敏感[9]。我们推测CRF信号通路在RE发病机制中具有一定作用。
本研究拟以大鼠为载体,采用动物造模、免疫组化、Western blotting、qRT-PCR等方法,检测RE大鼠和对照组大鼠下丘脑和食管下段组织中TRPV1、CRF1的表达情况,初步探索TRPV1、CRF1在RE内脏高敏感中的作用机制。
1 材料与方法
1.1 研究对象及造模方法成年SD大鼠20只,体质量(220±20)g,按照体质量随机分为RE实验组和假手术对照组。
采用部分贲门肌切开加幽门部分结扎术制备酸反流性食管炎大鼠模型,具体步骤:3%戊巴比妥钠溶液腹腔注射(1 ml/200 g)麻醉,除去腹部毛发,消毒,剑突下切口1.5 cm,暴露食管和胃,于食管-胃交界处纵行切开贲门肌0.5 cm,使贲门松弛;半结扎幽门,即将直径为4 mm金属棒置入胃幽门外侧,将金属棒连同幽门同时扎紧后将金属棒抽出。术后禁食24 h,RE实验组大鼠饲以高糖饮食(在普通饲料喂养的基础上,每日每只加用10%蜂蜜、10%白糖混合饮料自由饮用)。
假手术对照组大鼠开腹后暴露食管和胃后,不进行任何相关操作,暴露10 min后关腹,术后饲以普通饮食,其余饲养条件同RE实验组大鼠,实验过程中有两只大鼠因造模手术操作不当而死亡。
术后4周评估造模是否成功,随机处死大鼠观察食管下段黏膜充血水肿表明RE模型构建成功。
之后以3%戊巴比妥钠溶液腹腔注射麻醉,按原手术切口开腹,取食管下段组织(自胃食管交界上0.5 cm处向咽喉部截取1.5 cm)和下丘脑组织,部分置于4%甲醛固定,部分置于液氮、-80 ℃保存备用。
1.2 免疫组化检测RE大鼠和对照组大鼠的下丘脑和食管下段组织TRPV1、CRF1表达采用Max Vision免疫方法分别检测RE大鼠和对照大鼠下丘脑、食管下段组织的TRPV1、CRF1表达。免疫组化结果判定标准如下,阴性(-):细胞未显示着色;弱阳性(+):细胞为浅黄色;中度阳性(++):细胞为棕黄色;强阳性(+++):细胞为棕色。如果阳性细胞数>10%,则切片呈阳性。每张切片随机选取5个高倍视野,光镜下按阳性染色的细胞数和染色深浅分级。
1.3 Western blotting检测RE大鼠和对照的大鼠下丘脑和食管下段组织TRPV1、CRF1蛋白表达分别取大鼠下丘脑、食管下段组织,依次提取组织总蛋白、制备浓缩胶和分离胶、电泳[每孔蛋白上样量为50 μg,Maker上样量为5 μl,电泳条件:浓缩胶区域电压设为80 V,约25 min,分离胶区域电压设为100 V(65 min),当显色剂到底部,停止电泳]、转膜、一抗和二抗孵育、显色、照相分析,使用Image-pro-Plus软件分析目的蛋白条带。
1.4 qRT-PCR检测RE大鼠和对照组大鼠下丘脑和食管下段组织TRPV1、CRF1的mRNA表达大鼠TRPV1 qRT-PCR共测试3对引物,CRF1 qRT-PCR共测试4对引物,最终各确定一对引物有较好的扩增曲线和溶解曲线,序列如下:TRPV1-Forward:5′-AGGCCGAGTTTCAGGGAGAA-3′;TRPV1-Reverse:5′-AAGCAGACCACCCAAAGACC-3′;CRF1-Forward:5′-GGGCAG-CCCGTGTGAATTATT-3′;CRF1-Reverse:5′-ATGATGACTGCAACATGGTAG-3′。
冰上操作、提取总RNA,即称取0.05 g样品于1.5 ml EP管内,加入0.6 ml Trizol,马上用组织匀浆器打匀,将样品完全裂解,脑组织样品能够很好地裂解,匀浆约5 min即可,食管样品最后会残留部分结缔组织等碎片,匀浆时间约15 min,匀浆后每个样品再补加0.4 ml Trizol,使总体积至1 ml,混匀后再在冰上裂解10 min。随后将样品先在4 ℃,12 000g离心10 min,去除碎片沉淀,上清转移至一支新EP管内,按后续正常操作提取样品的总RNA。
取1 μg总RNA进行反转录反应,添加1 μl Oligo dT和1 μl Random primers,20 μl体系,42 ℃,1 h。将反转录得到的cDNA样品用ddH2O补至200 μl,并用于后续qRT-PCR反应。
1.5 统计学分析采用SPSS 23.0进行统计学分析,两组间计量资料比较采用Mann-WhitneyU检验(非参数检验)。所有检验为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 RE大鼠造模基本情况与对照组大鼠相比,RE大鼠食管大体观察色泽明显发红,但未见明显糜烂或溃疡形成;HE染色观察RE大鼠食管下段黏膜层可见大量中性粒细胞、浆细胞,少量嗜酸性粒细胞,黏膜固有层乳头延伸明显,提示RE大鼠造模成功(见图1)。
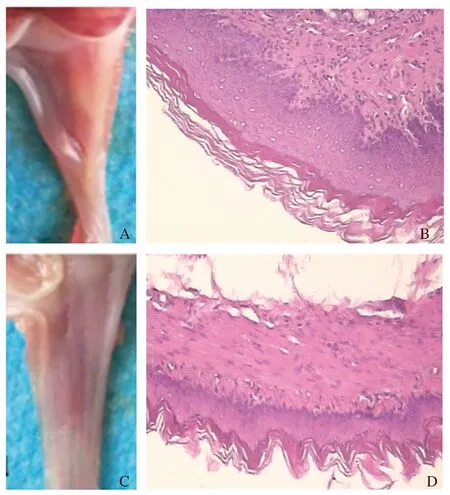
图1 RE大鼠和对照组大鼠食管大体标本和HE染色结果(放大100倍)A~B:RE大鼠;C~D:对照组大鼠Fig 1 The gross specimens and HE staining results of esophagus between RE rats and control rats A-B:RE rats;C-D:control group rats
2.2 RE大鼠下丘脑组织和食管下段组织TRPV1、CRF1的免疫组化结果免疫组化结果显示,RE大鼠下丘脑组织TRPV1、CRF1蛋白表达高于对照组大鼠。但RE大鼠食管下段组织TRPV1和CRF1的表达与对照组相比,差异无统计学意义(P>0.05,见图2)。

图2 RE大鼠和对照组大鼠下丘脑TRPV1及CRF1免疫组化对比图(放大100倍)Fig 2 TRPV1 and CRF1 immunohistochemistry of hypothalamus tissue between RE rats and control group rats
2.3 RE大鼠下丘脑组织和食管下段组织TRPV1、CRF1的Western blotting结果Western blotting结果显示,RE大鼠下丘脑组织TRPV1、CRF1的蛋白表达水平高于对照组。RE大鼠食管下段组织TRPV1、CRF1的表达,与对照组比较,差异无统计学意义(P>0.05)(见图3)。

图3 两组大鼠下丘脑组织和食管下段组织TRPV1、CRF1的蛋白表达Fig 3 TRPV1 and CRF1 protein expression of hypothalamus tissue and lower esophageal tissue between two groups
RE大鼠和对照组大鼠下丘脑、食管组织TRPV1的Western blotting定量分析显示,与对照组大鼠相比,RE大鼠下丘脑组织TRPV1和CRF1蛋白相对表达水平显著升高,而RE大鼠食管下段组织TRPV1、CRF1蛋白相对表达水平无明显变化(见表1~2)。
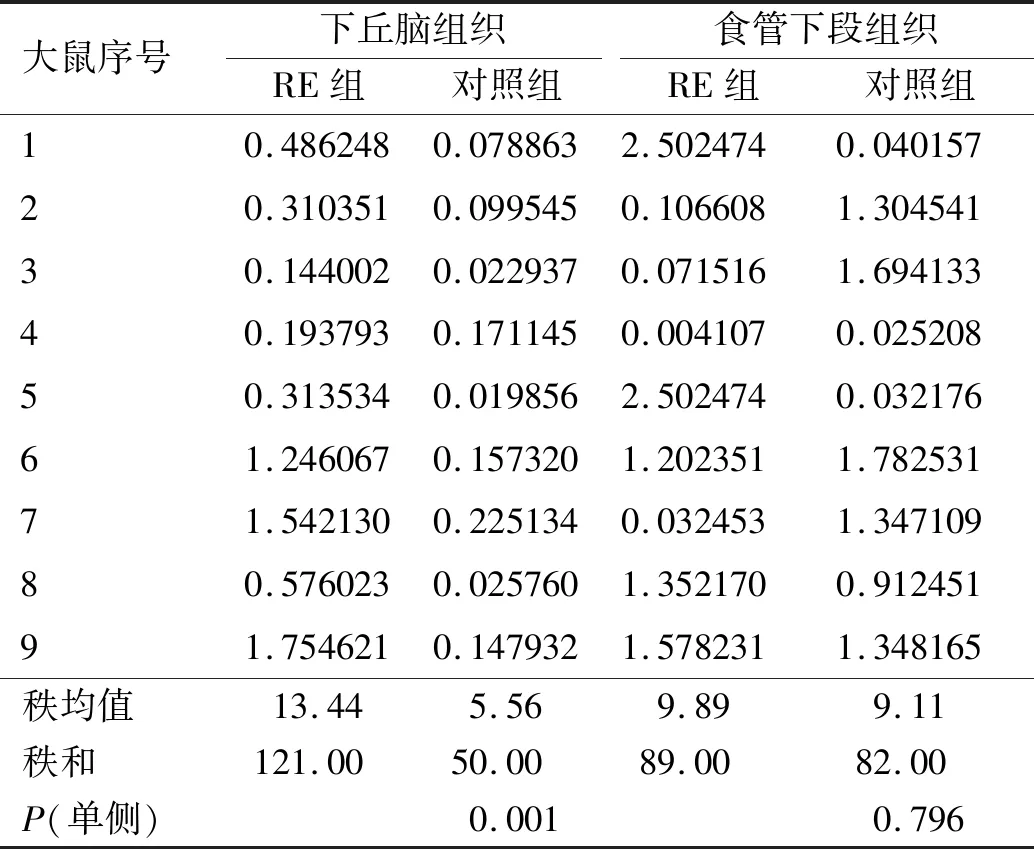
表1 RE大鼠和对照组大鼠下丘脑、食管下段组织TRPV1蛋白相对表达水平Tab 1 TRPV1 protein relative expression levels of hypothalamus tissueand lower esophageal tissue between RE rats and control group rats
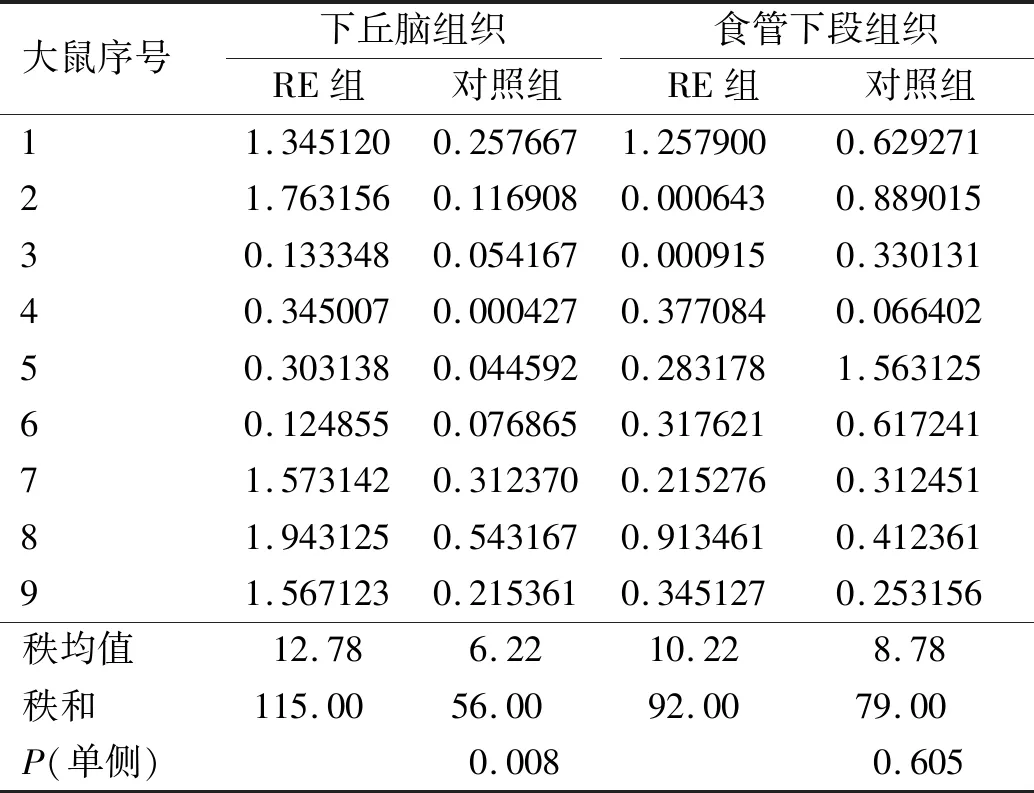
表2 RE大鼠和对照组大鼠下丘脑、食管下段组织CRF1蛋白相对表达水平Tab 2 CRF1 protein relative expression levels of hypothalamus tissue and lower esophageal tissue between RE rats and control group rats
2.4 RE大鼠下丘脑组织和食管下段组织TRPV1、CRF1的qRT-PCR结果qRT-PCR结果显示TRPV1、CRF1、GAPDH的扩增曲线、溶解曲线。样品PCR扩增产物的特异性检验见溶解曲线,溶解曲线分析结果显示为单一锐峰,无非特异性产物出现,说明扩增产物单一,结果可信(见图4)。mRNA含量用相对表达量表示。
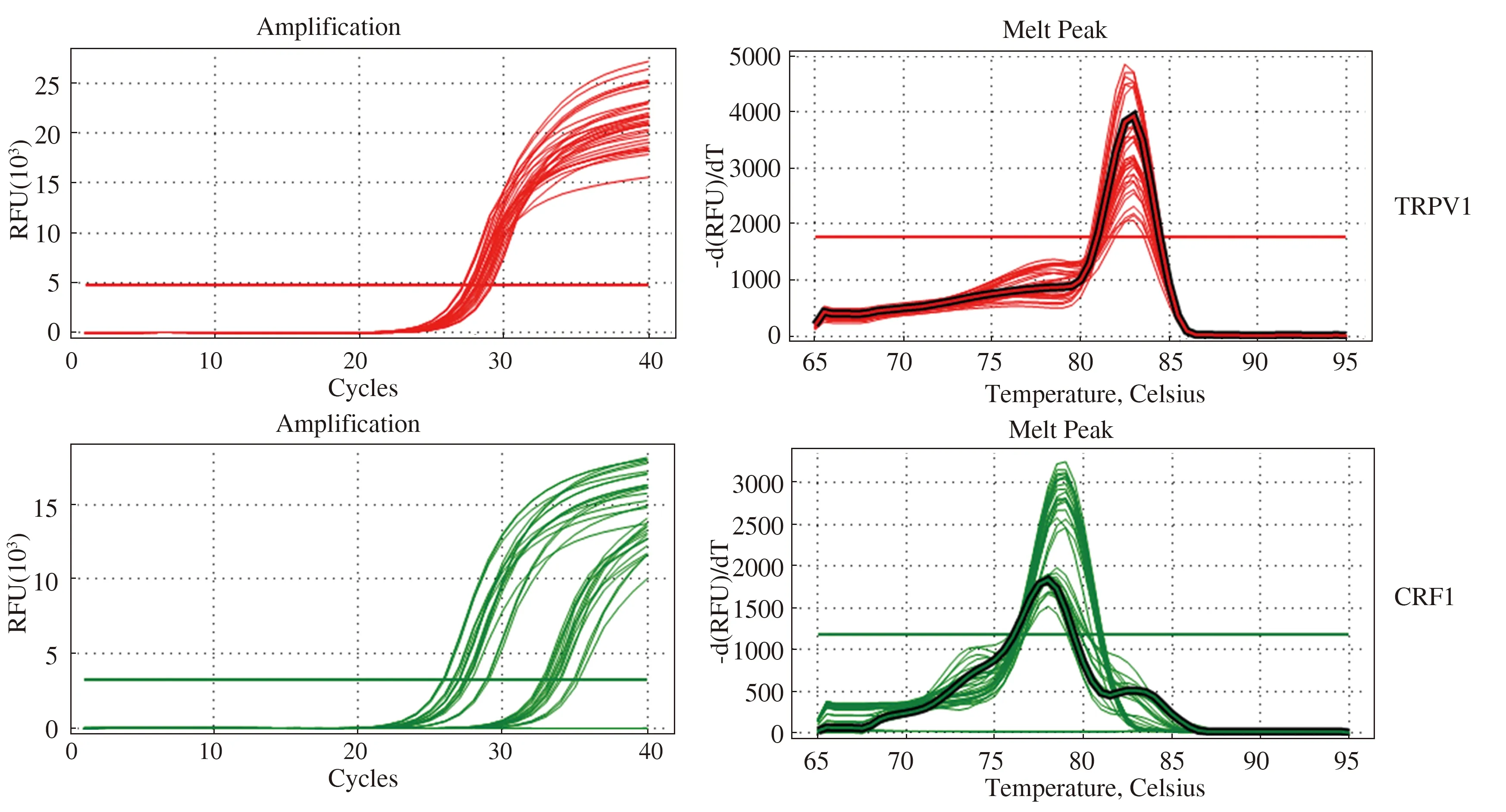
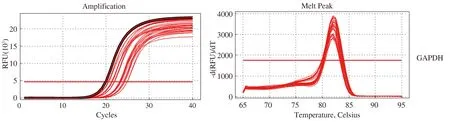
图4 大鼠下丘脑组织TRPV1、CRF1、GAPDH的扩增曲线、溶解曲线Fig 4 The amplification curve and dissolution curve of TRPV1,CRF1 and GAPDH in rat’s hypothalamus
RE大鼠和对照组大鼠下丘脑组织和食管下段组织TRPV1 mRNA表达的非参数统计显示,RE大鼠下丘脑中TRPV1 mRNA的相对表达水平显著高于对照组大鼠,而食管下段组织中TRPV1 mRNA的相对表达水平在两组间差异无统计学意义(P>0.05)(见表3)。
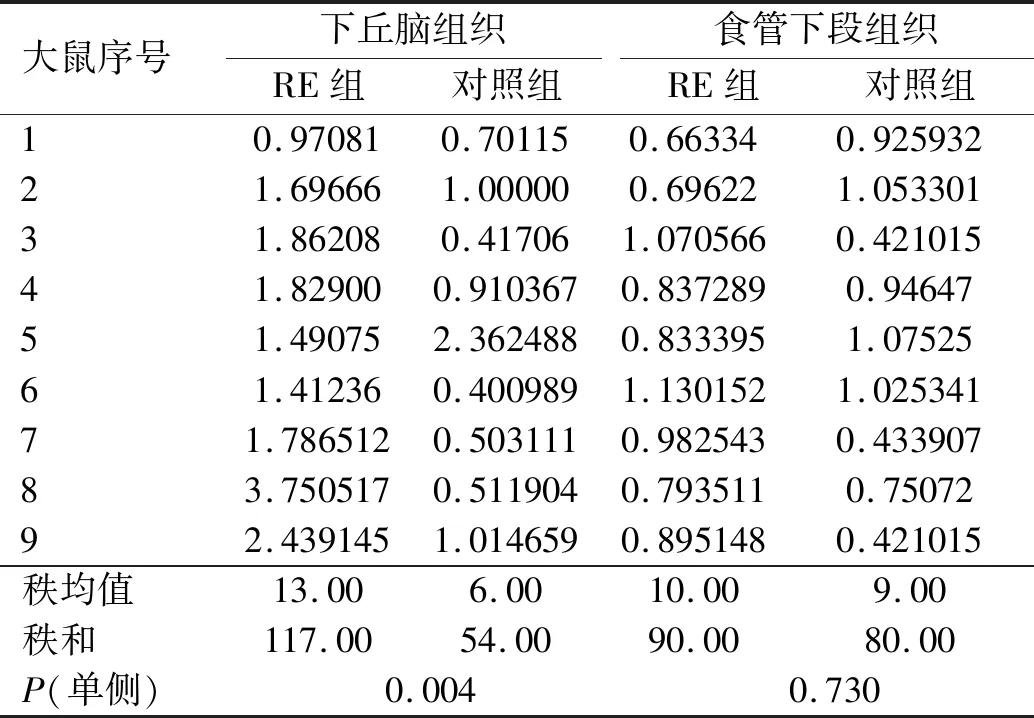
表3 RE大鼠和对照组大鼠下丘脑、食管下段组织TRPV1 mRNA相对表达水平Tab 3 TRPV1 mRNA relative expression levels of hypothalamus tissue and lower esophageal tissue between RE rats and control group rats
RE大鼠和对照组大鼠的下丘脑组织CRF1 mRNA表达的非参数统计显示,RE大鼠下丘脑组织中CRF1 mRNA的相对表达水平显著高于对照组大鼠,而食管下段组织中CRF1 mRNA的相对表达水平在两组比较,差异无统计学意义(P>0.05)(见表4)。
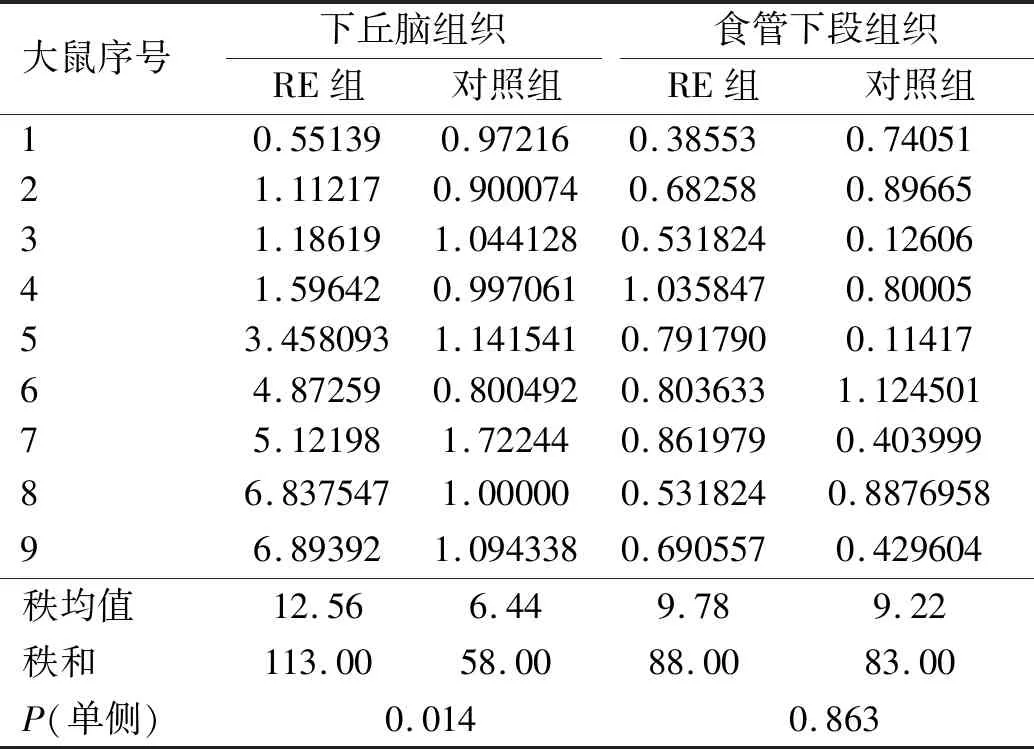
表4 RE大鼠和对照组大鼠下丘脑、食管下段组织CRF1 mRNA相对表达水平Tab 4 CRF1 mRNA relative expression levels of hypothalamus tissue and lower esophageal tissue between RE rats and control group rats
3 讨论
内脏高敏感性是指内脏对生理性刺激产生不适感或对伤害性刺激反应强烈的现象,可能的参与因素有遗传背景、脑肠肽、离子通道异常、受体异常、迷走神经传入神经感觉异常、雌激素、精神心理因素等。GERD患者发生内脏高敏感不仅对食管酸刺激敏感性增强,对食管腔内机械性刺激、胆碱能药物的敏感性也增强。学者们认为内脏高敏感在GERD患者,尤其是NERD症状产生中具有重要因素[10-11]。但目前对于内脏高敏感在GERD发病机制的研究较少,其具体机制尚不清楚、也无客观的诊断标准及临床干预药物。
既往观点认为内脏高敏感主要参与NERD症状产生,但NERD动物模型无明确构建方法。临床实践提示很多RE患者也具有焦虑状态,焦虑状态更加重主观症状的严重程度。本研究拟以大鼠为载体,采用动物造模、免疫组化、Western blotting、qRT-PCR等方法,检测RE大鼠和对照组大鼠下丘脑组织、食管下段组织中TRPV1、CRF1的表达情况,探索TRPV1、CRF1在RE内脏高敏感中的作用机制。
TRPV1主要分布在伤害性感觉神经元上,是多信号探测因子及疼痛刺激整合器,可以被多种理化因素及炎症介质直接激活或敏化,如热刺激(T>43 ℃)、H+(pH<6.0)、辣椒素、缓激肽等。研究表明,TRPV1广泛分布于胃肠道感觉神经纤维及相应背根神经节上,参与内脏高敏感和胃肠动力的改变[12]。国外研究表明,RE患者和NERD患者食管黏膜固有层神经纤维、上皮内游离神经末梢及鳞状上皮细胞TRPV1受体的表达增加,提示TRPV1受体可能与GERD症状的产生有关,RE患者和NERD患者黏膜TRPV1的表达且差异无统计学意义[8]。这说明了RE和NERD在分子水平上存在一定程度的共性。
本研究结果显示,RE大鼠下丘脑TRPV1的蛋白和mRNA的表达量显著高于对照组大鼠。内脏高敏感涉及胃肠道神经系统、自主神经系统和中枢神经系统三个层次,脑肠肽在其中具有重要作用。RE大鼠在胃食管反流的刺激下,下丘脑TRPV1表达升高,提示TRPV1可能在中枢层面介导RE的病理状态,对此尚无文献报道,该研究具有一定创新性。
CRF是一种神经肽,CRF参与肠易激综合征内脏高敏感的发生过程,肠易激大鼠脑和结肠组织中CRF表达均升高[13-14]。研究CRF信号调节系统有利于探索紧张和焦虑在GERD发病中的作用。CRF亚型较多,本研究初步探索CRF1在RE中的作用,研究结果显示RE大鼠下丘脑组织CRF1的蛋白和mRNA相对表达水平显著高于对照组。说明RE大鼠在胃食管反流的刺激下,下丘脑CRF1表达升高,提示CRF1也可能在中枢层面介导RE的病理状态。除了参与焦虑外,文献显示CRF与受体结合具有抑制胃运动的功能[15],推测CRF可能通过减慢胃排空而促进GERD的发生。
但RE大鼠食管下段组织TRPV1的蛋白和mRNA表达水平与对照大鼠差异无统计学意义,该结果与既往TRPV1在GERD患者或RE大鼠模型的实验结果不同[16],分析可能的原因有:(1)本研究取大鼠食管全层为研究样本,查阅文献显示TRPV1主要表达于RE食管黏膜的上皮、固有层;(2)本研究中RE大鼠模型尽管采用经典方法,但食管仅表现为充血水肿、无明显糜烂改变,既往研究显示,TRPV1的表达量与内镜下RE的严重程度呈正相关,以上两方面因素可能会对实验结果有一定影响。RE大鼠食管下段组织CRF1的蛋白和mRNA相对表达水平无显著升高。对于CRF1在RE方面的研究很少,文献报道慢性束缚应激大鼠食管CRF受体在食管黏膜下神经丛有表达[17]。
综上,RE大鼠下丘脑组织中TRPV1、CRF1显著升高,其可能在中枢层面参与RE的病理过程,这为进一步研究RE的发病分子机制提供新的视角。

