重复经颅磁刺激治疗耐药性癫痫的有效性及安全性(附4例报告)
彭淑,脱淼,王静,朱其秀,柳希芹,孙妍萍
癫痫是世界范围内负担最重的神经系统疾病之一[1],它由脑神经元过度放电引起,反映了神经网络中兴奋性和抑制性影响之间的不平衡[2]。目前,尽管有超过20种抗癫痫药物,但有近30%的患者依旧耐药。因此,癫痫的治疗仍然是一个主要的挑战[3]。耐药性癫痫是由国际抗癫痫联盟(ILAE)提出的,其定义为在两种或以上剂量充分、可耐受的、正确选择和使用的抗癫痫药物治疗方案(单药治疗或联合方案)后,仍出现癫痫发作[4]。除了抗癫痫药物外,耐药性癫痫可以通过经颅磁刺激(TMS)、外科手术、迷走神经刺激、深部脑刺激等方法进行治疗。重复TMS(rTMS)对癫痫的潜在治疗作用日益被认识。rTMS是一种电磁感应致脉冲颅内电流的无创技术[5]。一些病例报告[6-7]描述了低频rTMS在耐药性癫痫或难治性癫痫持续状态(RSE)中的应用,结果不一。本文介绍了4例经过rTMS治疗后症状较前好转的癫痫患者,还检索了关于rTMS与癫痫相关的一些文献,并对这些文献进行了一定的回顾总结。
1 临床资料
本研究经青岛大学附属医院医学伦理委员会批准,并获得了患者或其父母的书面知情同意书,本研究采用的TMS仪器为依瑞德CCY-1,除病例1患者外,其余3例患者刺激强度均采用90%运动阈值。
1.1 病例1 患者,男性,20岁。主因“发作性意识丧失5年”就诊。既往体健。查体:神志清,双手震颤,四肢肌力V级,余查体未见阳性体征。于我院行24 h视频EEG示癫痫样放电(EEG资料已丢失),患者EEG未发现局灶放电。后于我院复查24 h视频EEG示未发现明确癫痫样放电,被诊断为未分类癫痫。头颅MRI平扫未见明显异常。先后应用德巴金、加巴喷汀、奥卡西平、开浦兰抗癫痫治疗,效果欠佳,仍有较为频繁的癫痫发作。在患者及其家属签署知情同意书后,对患者进行了rTMS治疗。由于患者头皮EEG未能确定癫痫发作的起源,因此选用小脑作为刺激位点。刺激参数:频率5 Hz,刺激时间10 s,间歇时间20 s。每周3次,共进行3个月的rTMS治疗。应用rTMS治疗前后患者的抗癫痫药物的种类及剂量不变(开浦兰0.75 g/次,每天2次;奥卡西平900 mg/次,每天2次)。发作频率由rTMS治疗前的每月1次GTCS发作,4次先兆发作变为每月1次先兆发作,GTCS发作消失,未观察到明显的不良反应。停止rTMS治疗3个月后患者发作恢复到rTMS治疗前水平。
1.2 病例2 患者,女性,57岁。主因“外伤后发作性抽搐36年”就诊。既往心律异常史,乳腺癌术后。体检未见阳性体征。长程EEG示F8、T6、T4及蝶骨电极尖波。MRI示右侧岛叶软化灶可能性大。诊断为外伤后继发的局灶性癫痫,先后应用德巴金、开浦兰、奥卡西平控制癫痫发作,效果不佳,癫痫发作较为频繁。根据EEG对患者T6、T4位点进行rTMS治疗。刺激参数:频率0.5 Hz,刺激时间10 s,间歇时间2 s。每周3次,共进行rTMS治疗3个月。期间规律服用抗癫痫药物,无明显不适。发作频率由每月5次发作(常为局灶性发作,偶有继发全面性GTCS发作)逐渐减为每月1次发作,发作程度较轻,停止rTMS治疗后3个月效果消失。
1.3 病例3 患者,女性,20岁。主因“发作性抽搐8年”就诊。既往脑出血病史。查体无阳性体征。24 h视频EEG(图1)特征图形为睡眠期左侧额极、额、前颞区可见较少量3~4 Hz中-高波幅棘(尖)慢复合波散发。MRI示右侧额颞叶及邻近颅板改变,考虑脑回发育异常可能性大(图2)。诊断为局灶性癫痫。先后应用奥卡西平、妥泰、德巴金抗癫痫药物治疗,癫痫仍然频繁发作。在患者及家属同意后,对患者行rTMS。根据EEG结果提示,选择F3为刺激位点。刺激参数:频率0.5 Hz,刺激时间10 s,间歇时间2 s。每周3次,共进行rTMS治疗8个月。期间同时应用抗癫痫药物治疗。治疗有效,发作频率由治疗前的半月1次丛集性发作降为每月1次,发作明显减轻,无不良反应。患者因新冠疫情防疫管控,自2020年1月末起暂停rTMS治疗,治疗效果持续4个月。
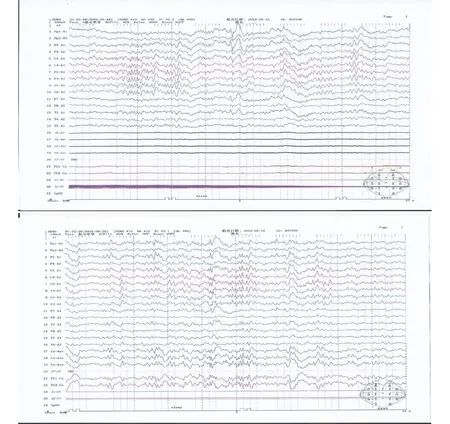
图1 病例3的24 h视频EEG(2019.05.15)示异常癫痫波
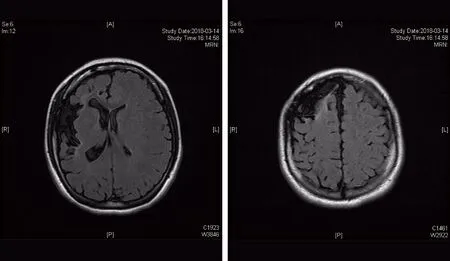
图2 病例3的头颅MRI检查结果
1.4 病例4 患者,女性,30岁。主因“发作性意识丧失伴肢体抽搐二十余年”就诊。该患者同时伴有偏头痛,既往贫血史、阑尾炎病史。体检无阳性体征。EEG示左侧尖波,F3为著。诊断为局灶性癫痫。先后应用奥卡西平、德巴金、氯硝西泮药物治疗,未能很好的控制癫痫发作。在征得患者及其家属同意后,对患者进行rTMS治疗。参考EEG结果,选取F3点为刺激位点。刺激参数:频率0.5 Hz,刺激时间10 s,间歇时间2 s。每周3次,共进行rTMS治疗3个月。同时合并抗癫痫药物治疗,未出现不良反应。癫痫发作未能得到很好的控制,接受治疗前患者每月5~6次不规律的丛集性发作,接受治疗后患者发作频率较前无明显差别,仍为每月4次左右发作,但其偏头痛症状消失(治疗前每月2次)。停止rTMS后其治疗偏头痛效果持续1个月。
2 讨 论
rTMS可以有效缓解癫痫发作。在上述提到的4个病例中,3例患者在接受rTMS治疗后癫痫发作得到很好的控制,发作频率减少50%以上。而癫痫合并偏头痛的病例4,虽然癫痫发作未能很好的控制,但是偏头痛症状消失。在病例2、病例3、病例4中,将抑制性rTMS刺激输送至癫痫病灶以达到抗癫痫作用。而在病例1中,因EEG未能明确癫痫病灶,故采用5 Hz对患者双侧小脑进行刺激。这一机制可能为,小脑的高频rTMS作用于小脑皮质的抑制性浦肯野细胞,使得活跃的浦肯野细胞引起的齿状核-丘脑皮质通路对皮质脊髓细胞的促进作用出现障碍,从而降低运动皮质的兴奋性。此外,rTMS还会增强浦肯野细胞对小脑深部核的抑制作用,这些反之又降低了他们对大脑皮质的激活驱动力[8],进而达到降低癫痫发作频率的效果。根据以往的研究,rTMS对癫痫表现出良好的耐受性、安全性和可能的有效治疗。
rTMS安全无创。4例患者在接受rTMS后均未出现不良反应。rTMS通常是安全的,这与相关报道一致。据报道[9],患者在rTMS后存在认知功能障碍和记忆丧失的风险。还有其他一些潜在的和最常见的不良反应,例如一过性头痛、刺激部位疼痛、肌肉收缩引起的不适和一过性耳鸣。rTMS最严重的不良反应为诱导癫痫发作,但这种不良反应非常罕见,一般考虑为高频刺激大脑皮质时产生致痫作用[10]。rTMS的效果根据刺激频率、强度和刺激持续时间的不同而改变。美国国家卫生研究院的共识会议概述了其安全刺激参数[11]。总体来说,rTMS还是较为安全无创的,不良反应相对轻微,较少有患者出现不适感。
rTMS治疗效果具有时效性。本研究观察的患者中,3例接受了3个月的rTMS治疗,而病例3因家属治疗意愿及我们想观察长期治疗的效果,接受治疗时间较长(8个月),4例患者在停止rTMS治疗后,治疗效果持续2~4个月后消失。相关证据[12]也表明重复的大脑刺激导致的兴奋性变化比刺激期本身更长。换言之,这种变化更有可能在刺激后表现出持续的效应。而一些临床试验及动物实验[13-14]也证明了rTMS的刺激效应可在停止刺激后维持数周。以上说明rTMS的治疗效应虽可在停止刺激后持续存在,但具有一定的时效性。本组4例患者均在刺激后2~4个月恢复到刺激前的发作状态。因此,为了更好的发挥rTMS的抗癫痫作用,患者需要接受较长时间的规律的rTMS治疗,研发一种小型的便携式家用rTMS设备则显得尤为重要,这利于患者规律长期接受rTMS治疗。
本组4例患者的治疗情况表明使用rTMS可以抑制皮质兴奋性,从而缓解癫痫发作。rTMS对癫痫的治疗作用及刺激参数需要更多的研究来进一步证实。本研究小组通过在Pubmed、万方数据库、中国知网数据库中搜索关键词为“Transcranial Magnetic Stimulation”“mechanisms”and“epilepsy”或者“经颅磁刺激”、“癫痫”“机制”的相关文献,简单总结了TMS治疗癫痫机制、研究现状等。
目前,较多研究或者个案报道表明TMS对癫痫的治疗是有一定的效果,但其作用的具体机制尚不是很明确,推测可能通过以下方面起作用。(1)突触可塑性:在rTMS后,由于受刺激的神经元群周围离子平衡的改变,神经元的兴奋性发生变化,该变化表现即为突触可塑性的改变[15]。虽然研究表示rTMS和突触可塑性的诱导之间存在着一定的联系。但是,目前还未能证明二者之间的直接联系。越来越多人注意到rTMS可以通过影响突触可塑性从而调整神经元兴奋性[16]。由此推测,rTMS可能会通过改变突触可塑性来达到改善癫痫发作的效果。一般来说,低频率(≤1 Hz)rTMS通过增加皮质内抑制来抑制皮质兴奋性。相反,高频率(常规标准化为≥1 Hz)rTMS则增强了皮质兴奋性[17]。这些效应与长时程抑制(LTD)和长时程增强(LTP)现象类似。而目前证据表明,低频率rTMS诱导的LTD样抑制作为一种潜在的癫痫抑制治疗方式正在逐渐得到重视[10]。(2)增强GABA能抑制作用:GABA为抑制性神经递质,通过减少动作电位成功发生的机会来抑制神经传递[18],当前较多研究提示,GABA与癫痫发生有关,像Levitt等使用磁共振波谱成像(MRS)来评估接受rTMS刺激的背外侧前额叶皮质(DLPFC) GABA水平的变化。关于rTMS的一些研究[19-20]表明,rTMS的特定位点和频率促进了内源性GABA的释放,减少了突触后膜上GABA的丢失,从而增加GABA能抑制作用,推测这可能与rTMS对癫痫的治疗效果相关。(3)神经保护及神经营养作用:Chervyakov等[15]发现TMS可以影响神经保护机制, TMS可以通过激活抗凋亡机制发挥其抗癫痫作用。Ma等[21]通过研究发现,低强度刺激(1.14 T,1 Hz)可能会通过影响脑源性神经营养因子(BDNF)-酪氨酸激酶B(TrkB)信号系统从而导致树突萌发(轴突生长)和生长,并且增加突触接触密度。除此之外,研究[22]显示,TMS可能会影响血清和CSF中BDNF的含量,BDNF是神经营养因子家族的一员,参与调节神经元的存活、分化、树突和轴突的生长及突触功能等。多项研究表明,rTMS可以增加血清中的BDNF水平,例如Zhao等[23]、Zanardini等[24]、Yukimasa等[25]、冯方等[26]的研究均支持这一观点。但另外一些研究[27]发现rTMS对BDNF水平没有影响,甚至在Wang等[28]的报道中认为低频率刺激会降低BDNF水平,而高频率刺激则与之相反,故而目前尚不能有明确结论。但我们推断,BDNF对于减轻癫痫造成的神经损害是有一定好处的。(4)离子通道基因表达:除了突触可塑性、神经保护及神经营养因子等因素,还有研究[29]表明rTMS可以调控钙离子通道活动,可能会通过影响离子通道来影响皮质兴奋性。(5)神经肽-Y表达水平:谷氨酸是脑内的兴奋性神经递质,而部分研究[30]发现,神经肽Y通过抑制谷氨酸能传递,参与调节皮质兴奋性。Müller等[31]在大鼠中的研究未能证明应用rTMS可以使神经肽Y(NPY)水平增加。到目前为止,对rTMS对皮质NPY表达的影响这一方面了解较少,还有待进一步研究。
目前,越来越多的人开始注意到了rTMS对癫痫的治疗作用[32],并且开展了相关研究。但是目前研究结果存在争议,像Shon等[6]认为0.5 Hz rTMS可使难治性癫痫发作减少,rTMS对于难治性癫痫是一种潜在的有效治疗方法,可以作为常规抗癫痫药物治疗外的一种辅助治疗手段。而Starnes等[33]认为虽然rTMS是安全的,但现有的资料尚未明确rTMS对治疗儿童或成人癫痫的疗效。总而言之,目前,rTMS在耐药性癫痫的治疗应用方面仍存在几个亟待解决的问题。首先,针对rTMS的研究相对来说较少,且不能保证在临床实验中有足够的样本量,使得到的研究结果受到了一定的限制。其次,rTMS必须在医院进行,对患者的依从性造成了一定的困难。再者,rTMS治疗癫痫的作用机制仍需阐明,而且长期治疗的安全性问题及最佳有效治疗参数的设定等方面也都存在一定的考量,这些问题均需要我们在未来的研究中做出解答,为rTMS治疗神经系统疾病提供足够的依据。

