雪茄烟叶原料发酵微生物多样性及酶活变化研究
张磊,罗泽华,杨明川,李世贵,辛玉华,蔡斌,刘好宝,曾代龙,顾金刚*,段碧华
(1.中国烟草总公司海南省公司海口雪茄研究所,海口 570105;2.中国农业科学院农业资源与农业区划研究所,农业农村部农业微生物资源收集保藏重点实验室,北京 100081;3.北京农学院生物与资源环境学院,北京 102206;4.四川中烟工业有限责任公司长城雪茄烟厂,四川 什邡 618400)
中国的雪茄目前已进入起步阶段[1]。调制和发酵是雪茄烟叶质量形成的关键环节[2],在一定温度和湿度条件下,烟叶发酵理化特性和微生物种群会发生变化,激发烟叶内的香气物质,改善雪茄的品质[3]和青杂气和苦涩等气味,促使产生独特风味和芳香并提高燃烧性能[4]。雪茄烟叶发酵有自然发酵和人工发酵两种方式[5]。
在微生物和环境的协同作用下,烟叶会发生一系列生化反应[6]。在发酵过程中,微生物的群落多样性和丰度呈动态变化,产生多种水解酶,如蛋白酶、果胶酶、淀粉酶等,微生物的活动主导物质降解与转化。微生物与酶类协同作用,将烟叶中的碳水化合物和蛋白质物质充分转化生成一系列小分子化合物[7-12]。姚光明等[13]研究发现,中性蛋白酶对烟叶中蛋白质降解作用明显,燃吸品质得到明显改善;阎克玉等[14]分析发现,在烟叶发酵中添加果胶酶可降解细胞壁物质;韩富根等[15]在测定烟草多酚氧化酶酶活性时发现,pH为碱性条件下酶敏感,在偏碱情况下酶活性下降很快。关亮等[16]在不同pH缓冲液条件下试验发现,pH为8时酶活性达到最大,pH继续升高到9时酶活则活性下降。
本文对两个品种的雪茄烟叶原料在不同发酵阶段的微生物种群动态以及酶活特征进行研究,以期为雪茄烟叶原料发酵工艺提供理论基础与应用参数。
1 材料与方法
1.1 试验材料
供试雪茄茄芯烟叶为海南不同种植地的古巴品种(样品1)和印度尼西亚品种(样品2),初始水分含量25%,发酵温度42~45℃,于发酵起始期(0 d)、发酵中期(45 d)和发酵结束期(90 d)随机选取3把烟叶,每把烟叶中随机抽取10片,置于自封袋中并保存于-80 ℃保存备用。
1.2 试验方法
1.2.1样品均质化 烟叶去筋脉后与研磨球一起装入不锈钢研磨罐中,液氮处理10 min,用研磨仪(60 Hz,90 s)研磨。均质仪(100 mL)中加入0.5 g烟叶粉末和40 mL PBS缓冲液(pH 7.2)充分研磨,4 ℃、3 500 r·min-1离心20 min,获得上清液即为烟叶粗酶液。
1.2.2微生物高通量测序 采用细菌和真菌基因组提取试剂盒(D3350-02,Omega;D2300-100T,Solarbio)提取烟叶样品中的微生物DNA并纯化。以细菌和真菌DNA为模板,分别以引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)/1492R(5′-GGT-TACCTTGTTACGACTT-3′)和ITS1(5′-CGTAG-GTGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTAT-TGATATGC-3′)对细菌的16S rRNA V3和V4可变区和真菌ITS1区域进行扩增。以1.0%琼脂凝胶电泳对PCR产物进行检测,并基于IlluminaHiseq进行测序(百迈客生物科技有限公司)。以QIME软件以及R软件等进行生物信息学及数据统计分析。
1.2.3酶活测定 采用福林法和3,5-二硝基水杨酸(DNS)比色法测定蛋白酶、淀粉酶和果胶酶活性[17-20]。酶活反应体系(1 mL)包括100 μL烟叶粗酶液和900 μL底物缓冲液。蛋白酶活性测定的底物缓冲液为酪蛋白溶液(pH 7.5),40 ℃反应20 min,用多功能微孔板酶标仪(Infinite 200 PRO)测定680 nm吸光值,并基于L-酪氨酸标准品绘制的标准曲线计算酶活。淀粉酶活性测定的底物缓冲液为淀粉溶液(pH 5.6),40 ℃反应30 min后加入1.5 mL DNS,测定520 nm吸光值,基于葡萄糖为标准品绘制的标准曲线计算酶活。果胶酶的底物缓冲液pH为4.8,48 ℃反应30 min,测定540 nm吸光值,并基于以D-半乳糖醛酸为标准品绘制的标准曲线计算酶活。
1.2.4pH测定 用pH 4.01和 6.86的标准缓冲液校准pH计(梅特勒FE 28台式酸度计)。取一定量的烟叶粉末在40 ℃条件下干燥并过40目筛[21],称取2 g置于50 mL离心管中,加入20 mL蒸馏水后密封。20 ℃、200 r·min-1条件下震荡30 min,静置1 h后测定上清液的pH。
2 结果与分析
2.1 高通量测序结果及α-多样性分析
通过HiSeq高通量测序从12个烟叶样品中共获得842 616条有效序列,代表1 879个OTU,且真菌种类较细菌更丰富(表1)。样品1的细菌OTU数量在发酵起始为170个,发酵中期51个,发酵结束116个,呈先下降后上升的趋势;相应的ACE指数在发酵起始为178.40,发酵中期59.46,发酵结束143.66和Chao1指数发酵初期178.5,发酵中期57.0,发酵结束133.4,呈相同变化趋势;但香农指数由发酵初期的0.68到发酵结束2.32呈上升趋势;辛普森指数由发酵初期0.82到发酵结束阶段的0.14,呈下降趋势。真菌OTU数量、ACE指数、Chao1指数和辛普森指数由发酵初期361个和391.18、386.6、0.82到发酵结束阶段187个和189.98、192.10.21,都呈持续下降趋势。
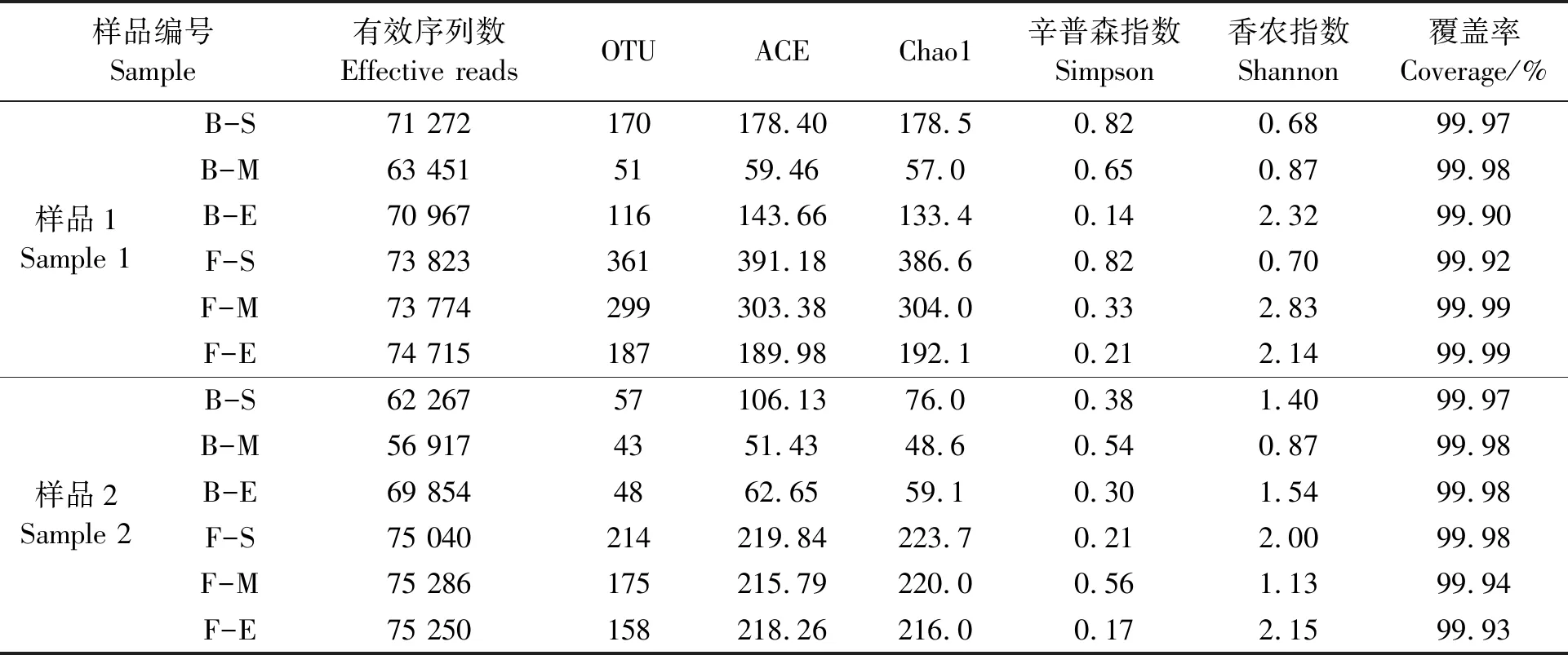
表1 雪茄烟叶发酵样品的微生物多样性分析Table 1 Microbial diversity analysis oftobacco leaves of two cultivars
样品2的细菌和真菌OTU的数量低于样品1,但菌群变化规律与样品1基本一致。在发酵初期阶段两种烟叶样品微生物种类较为丰富,随着发酵时间的延长菌群呈特异化和专一化。
2.2 雪茄烟叶样品的微生物群落结构
2.2.1细菌微生物群落结构 不同发酵时期雪茄烟叶样品中的微生物群落会发生变化(图1)。样品1在发酵起始和中期的优势细菌为葡萄球菌(Staphylococcus),而发酵结束时的菌群相对丰富,优势菌主要为肠杆菌属(Enterobacter)、假单胞菌属(Pseudomonas)、短杆菌属(Brevibacterium)、葡萄球菌等。样品2的微生物群落结构与样品1 既有共性也有差异,样品2在三个发酵阶段的优势细菌都是葡萄球菌,此外发酵初期和结束的优势菌还有棒状杆菌(Corynebacterium)、四联球菌(Tetragenococcus)和肠道球菌(Enteractinococcus),中期的优势菌还有棒状杆菌属。
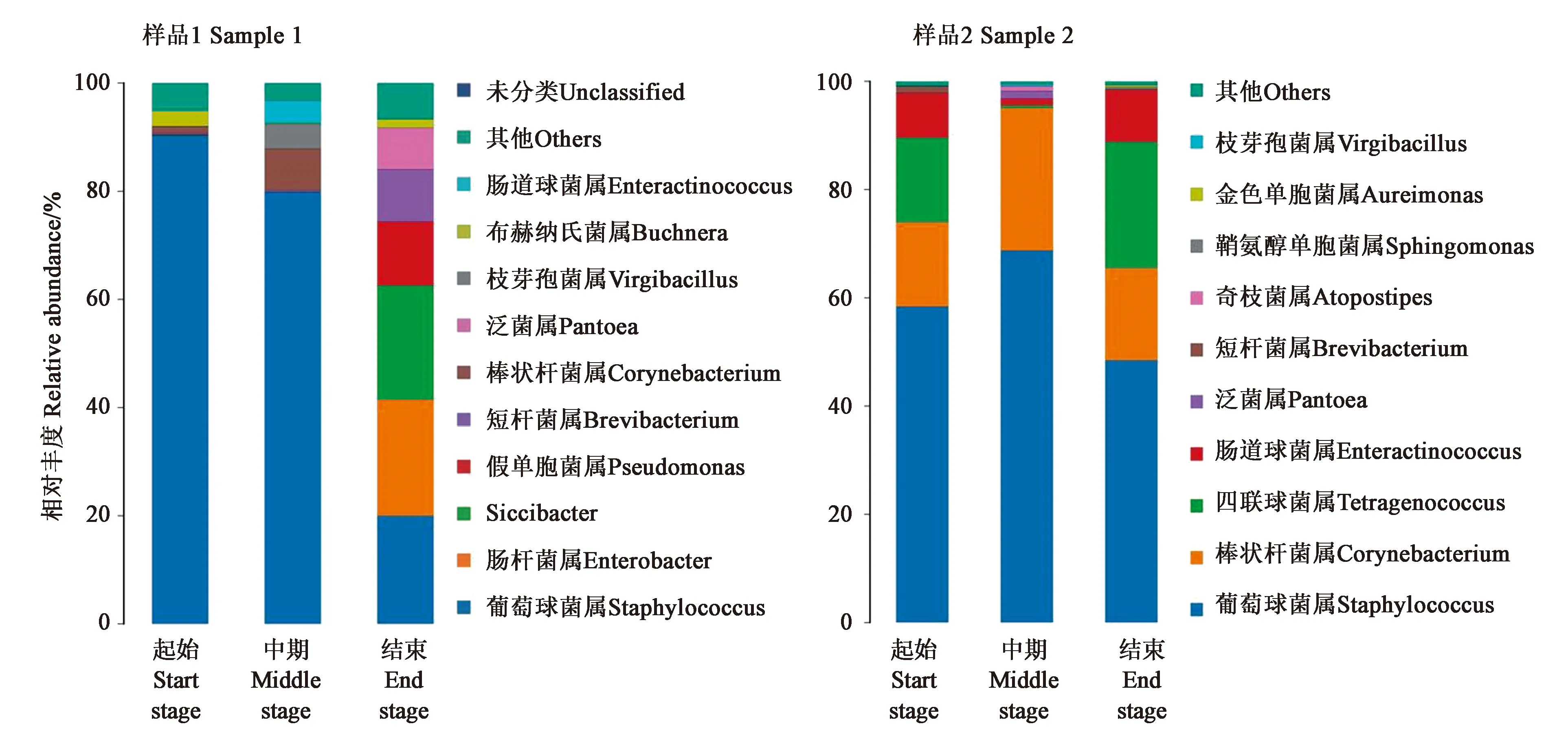
图1 不同发酵时期雪茄烟叶细菌群落结构Fig.1 Bacterial community structure of tobacco leaves at different fermentation stage
2.2.2真菌微生物群落结构 从图2可以看出,不同发酵时期样品1中的真菌群落结构存在明显区别,枝孢菌(Cladosporium)和曲霉(Aspergillus)在不同发酵阶段都是优势菌,但丰度不同。在发酵结束后雪茄烟叶的细菌和真菌群落更多元化。真菌群落结构分析表明,样品2发酵起始的优势菌为未知真菌,在发酵中期优势菌变为曲霉和其他菌,结束时优势真菌更加丰富,包括枝孢菌、曲霉、赤霉菌(Gibberella)等。
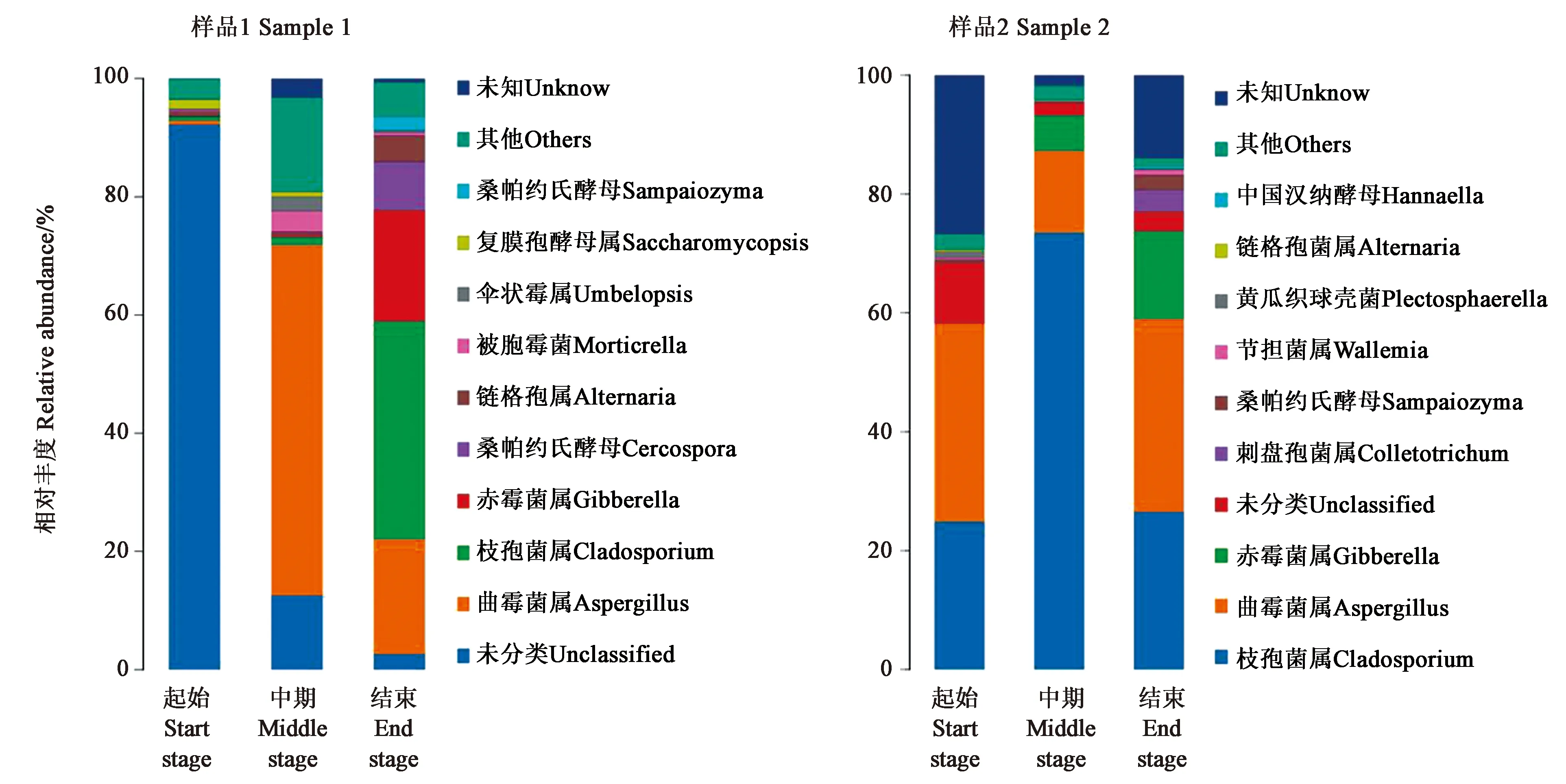
图2 不同发酵时期雪茄烟叶真菌群落结构Fig.2 Fungal community structure of tobacco leaves at different fermentation stage
2.3 不同发酵时期雪茄烟叶样品间基于微生物种群的聚类分析
2.3.1细菌微生物种群的聚类分析 从图3可以看出,雪茄烟叶样品1在发酵起始与中期两个阶段的微生物类群相似度较高,与发酵结束阶段的差距较大。发酵起始与中期丰度较低且相似的细菌属有10个,而发酵结束阶段丰度高属较多。样品2的发酵起始和结束两个阶段的微生物类群相似度较高,与中期有一定的距离。发酵起始与结束丰度较低且相似的属有4个,每个阶段丰度较高的属均有5个,通过热图分析发现雪茄样品随着发酵时间增加,物种更加多样,样品1在发酵结束这一阶段物种更为多样。
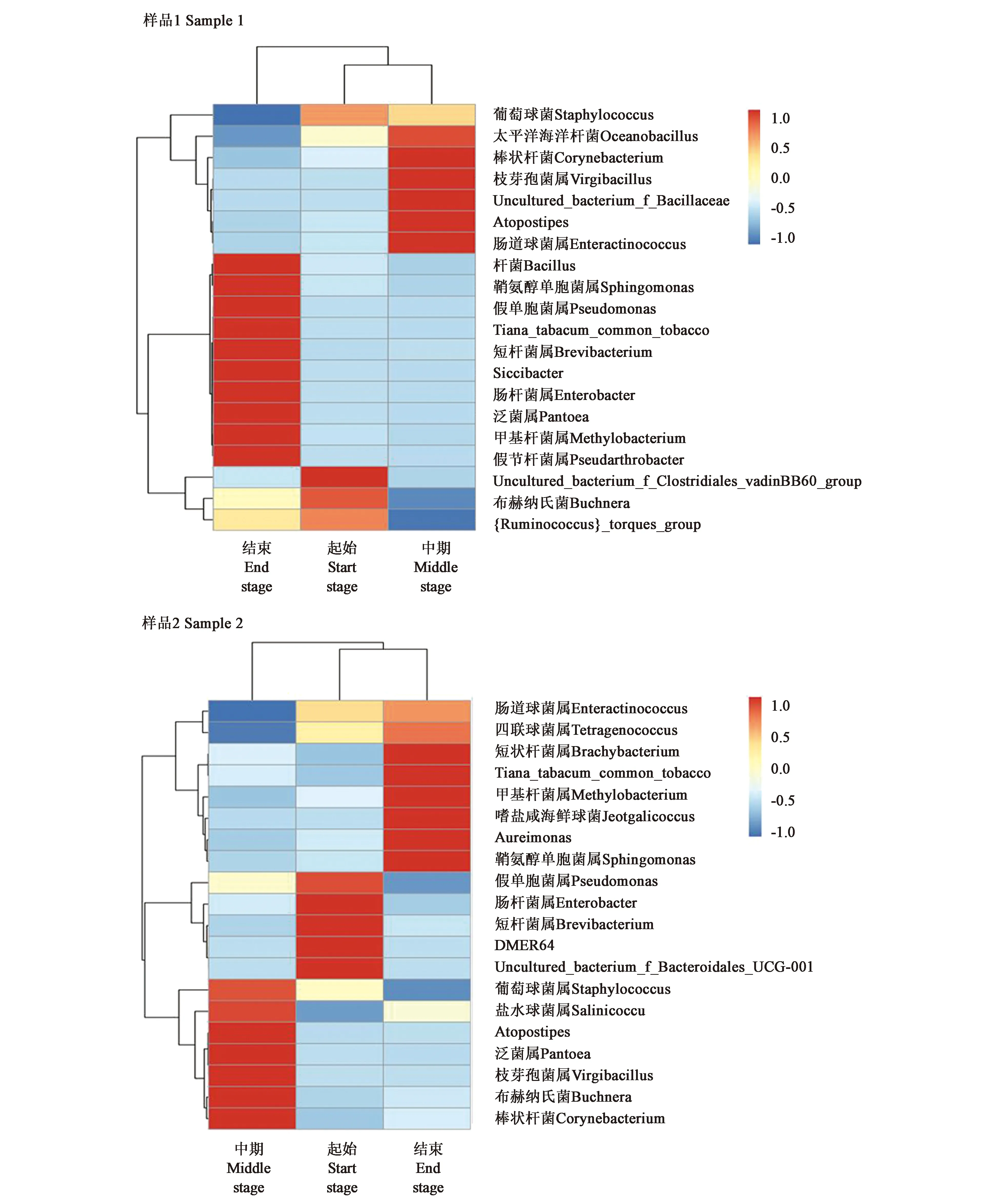
图3 雪茄烟叶在发酵过程中的真菌多样性聚类分析Fig.3 Cluster analysis of the fungal diversity of tobacco
2.3.2真菌微生物种群的聚类分析 真菌多样性聚类分析结果与细菌不同。从图4可以看出,雪茄烟叶样品1在发酵起始与发酵中期微生物种群相似度较高聚为一类,与发酵中期差异较大。发酵前期、发酵结束具有相似丰度较低的真菌属,在发酵中期阶段度较高真菌属有12个,种群较为丰富。样品2在发酵前期与发酵中期微生物种群聚为一类,与发酵结束有一定的差异性。发酵前期、发酵中期有丰度较低且相似的真菌属但较少,三个发酵阶段中丰度较高的真菌属数量均有5个。
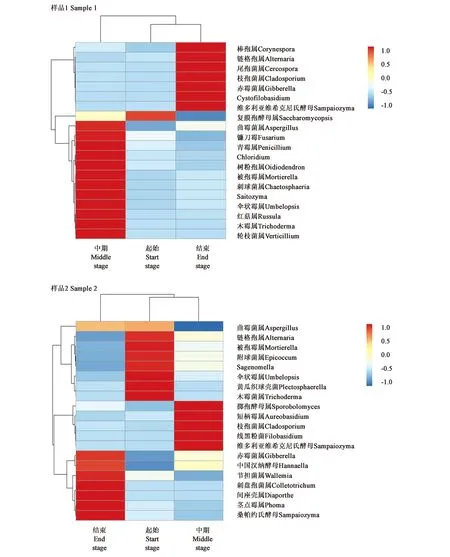
图4 雪茄烟叶在发酵过程中的真菌多样性聚类分析Fig.4 Cluster analysis of the fungal diversity of tobacco
2.4 不同发酵时期雪茄烟叶样品微生物物种分析
2.4.1细菌物种分析 从图5可以看出,样品1在发酵起始、中期、结束三个阶段样品共有的细菌OTU数量为27个,特有的细菌OTU数量分别为55、3、14个。发酵中期与结束两阶段的OTU数量较发酵起始有明显的下降。不同阶段样品所含的细菌OTU数量依序为发酵起始>发酵结束>发酵中期。与样品1 相比,样品2 的细菌OTU较少。三个发酵阶段的烟叶样品细菌OTU 24个,但特有细菌OTU随着发酵时间增加而不断减少。
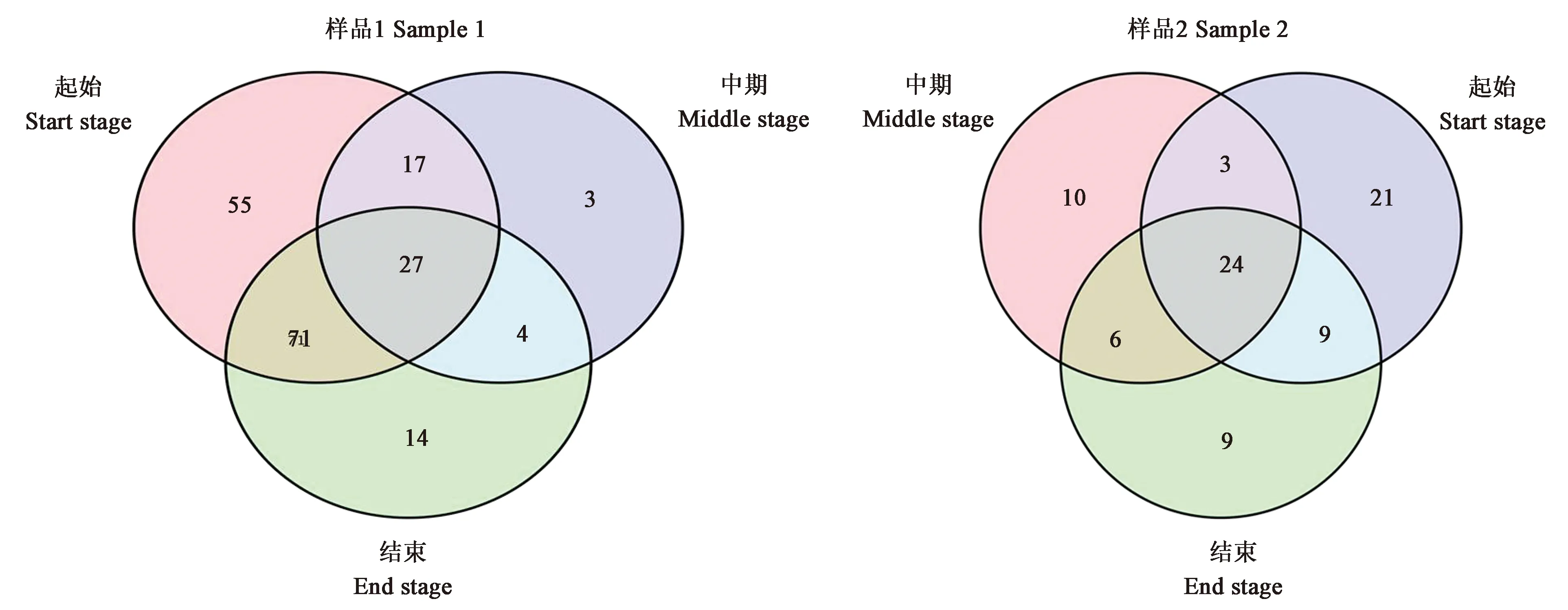
图5 雪茄烟叶细菌物种Venn图Fig.5 Venn map of bacterial species in tobacco leaf
2.4.2真菌物种分析 从图6可以看出,样品1在每个发酵阶段的特有真菌OTU数量较多,分别为71、48、38个。三个发酵阶段共有的真菌OTU为76个,不同阶段样品所含的真菌OTU数量依序为发酵起始>发酵中期>发酵结束。而样品2的真菌OTU较为丰富,共有的真菌OTU为81个。在发酵起始阶段特有的真菌OTU高达136个,是整个发酵时期真菌OTU最为丰富的一个阶段。随着发酵时间增加真菌OTU不断减少,中期104个OTU,结束时只有46个。
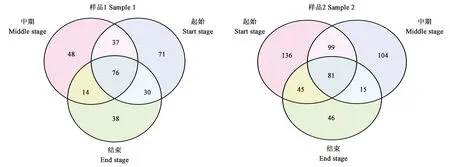
图6 雪茄烟叶真菌物种Venn图Fig.6 Venn map of fungal species in tobacco leaf
2.5 不同发酵时期酶活变化规律研究
雪茄烟叶不同发酵时期酶活变化规律如图7所示。可以看出,样品1蛋白酶活性在发酵起始阶段为129.89 U·g-1,在发酵中期降低,而发酵结束后活性升高至165.95 U·g-1。果胶酶活性随着发酵时间的延长而逐渐降低,发酵结束时为0.95 U·g-1。淀粉酶活性在整个发酵过程中变化不大(0.29~0.34 U·g-1),不同阶段间差异不显著。样品2的酶活和变化趋势与样品1 有显著差异。发酵起始的蛋白酶活性较低(26.50 U·g-1),随着发酵时间的延长,蛋白酶活性也在增加,发酵结束时蛋白酶活性已高达121.57 U·g-1。果胶酶活性呈现一个先上升再下降的趋势,在发酵中期果胶酶活性高达1.60 U·g-1,而发酵起始与结束后的果胶酶活性相差较小。淀粉酶活性在发酵中期酶活最高(0.38 U·g-1),发酵结束后淀粉酶活性比发酵起始的酶活还要低。
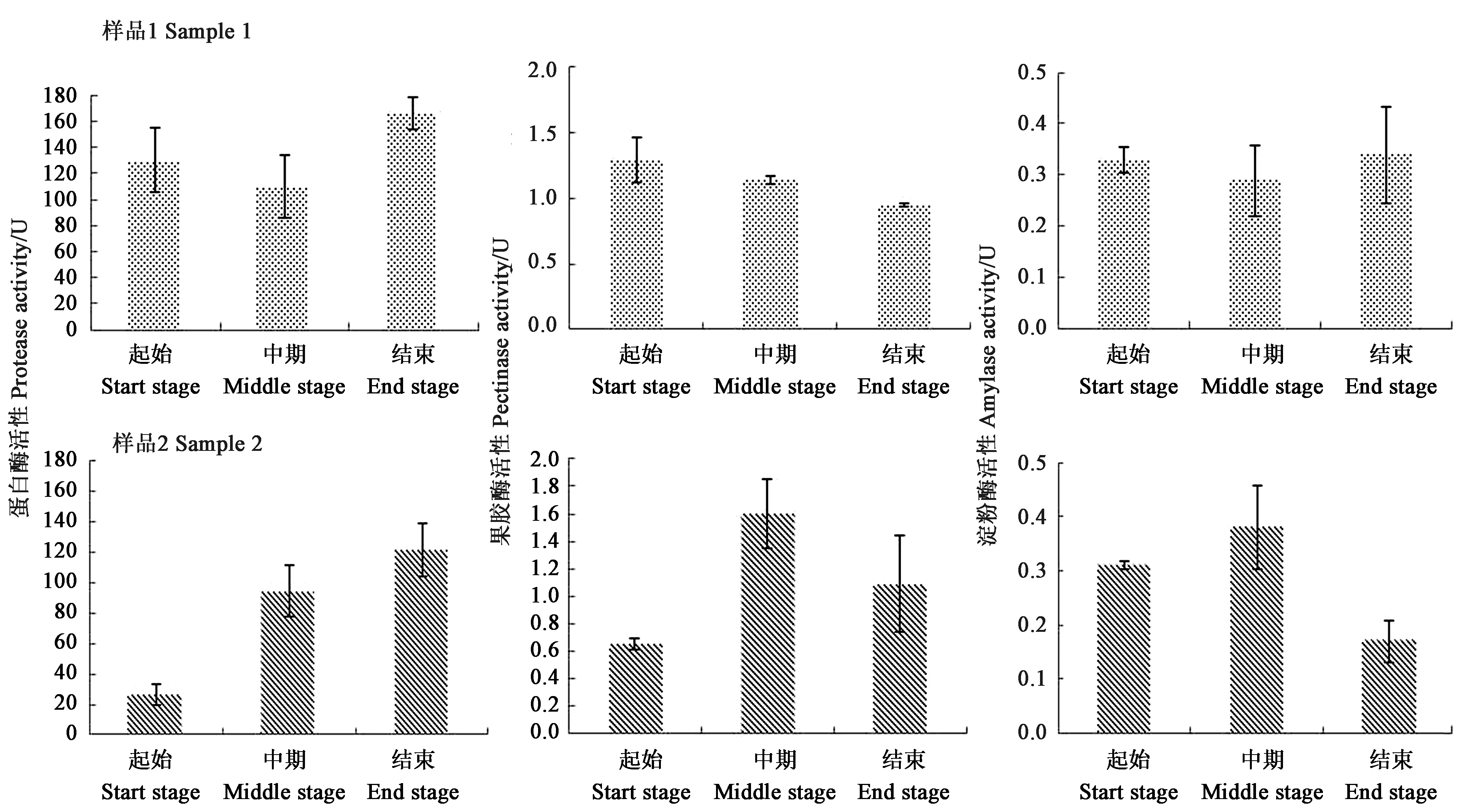
图7 雪茄烟叶的蛋白酶、果胶酶和淀粉酶在发酵期间的活性变化Fig.7 Changes of protease,pectinase and amylase activities in cigar tobacco leaf
2.6 雪茄烟叶发酵过程中pH的变化
雪茄烟叶两个样品在发酵过程中pH的变化差异很大(图8)。样品1的pH在发酵中期阶段pH达到7.6,呈碱性状态,而发酵起始与结束时pH都在酸性范围内且差异较小。样品2的pH在发酵过程中都呈酸性状态,且差异较小(图8)。

图8 雪茄烟叶的pH变化Fig.8 pH changes of the cigar tobacco leaf
3 讨论
两种雪茄烟叶样品的微生物群落结构在发酵的三个阶段有显著差异。样品1在整个发酵过程中细菌数量一直呈现下降趋势,这与杜佳等[10]对雪茄茄衣人工发酵过程中叶面微生物区系研究结果一致。张晓娟等[7]在相对湿度70%、温度40 ℃条件下对雪茄外包皮烟发酵发现细菌数量占绝对优势,未分离到酵母和放线菌。李宁等[22]对雪茄烟叶表面微生物分离鉴定发现,人工发酵后的雪茄烟叶表面微生物数量急剧减少,细菌数量仍占绝对优势,芽孢杆菌属和青霉属在发酵前后均处于优势地位。张鸽等[23]分析了4个国家雪茄外包皮烟叶表面细菌种类,发现芽孢杆菌属和葡萄球菌属为主要优势菌。本研究结果表明,待测雪茄烟叶样品中细菌以葡萄球菌属为主,微生物多样性丰度与种类与已有研究存在差异性,可能与样品本身和发酵环境条件有关[24-26]。
酶活指标在雪茄烟叶发酵过程中作用明显。样品1蛋白酶活(165.95 U·g-1)和淀粉酶活(0.34 U·g-1)在发酵结束时期最高,果胶酶活性(1.30 U·g-1)在发酵起始时期呈最高。样品2蛋白酶活(121.57 U·g-1)在发酵结束时期最高;果胶酶活性(1.60 U·g-1)和淀粉酶活性(0.38 U·g-1)在发酵中期活性最高。在烟叶发酵过程中不光有微生物、化学反应的协同作用,酶在整个发酵过程中起着促进作用[27]。闫克玉等[28]使用混合酶制剂来提高上部烟叶品质研究结果表明,α-淀粉酶用量10 mL·kg-1处理后的烟叶总氮含量减少、总糖含量增加,杂气较少吸味更加醇和;蛋白酶用量80 U·g-1处理的烟叶蛋白质含量减少,总糖含量增加,余味变得柔软干净。黄强等[29]采用先进的固定化酶反应技术,与α-淀粉酶的催化作用来对烟叶进行保润功效。王怀珠等[30]在烤烟中烘烤过程中外源添加淀粉类酶,酶量增加导致淀粉含量下降,水溶性糖和还原糖含量增加。
雪茄烟叶发酵过程中pH会发生变化。样品1雪茄原料在发酵中期pH呈碱性,三个不同发酵阶段pH变化较为明显;样品2雪茄原料在不同发酵阶段pH变化较小,呈酸性状态。本研究发现酶活的变化与pH有着密切联系,蛋白酶的酶活在酸性条件下随pH的升高而逐渐上升,在碱性条件下随pH的升高迅速下降,这一研究结果与王朋朋等[19]研究结果一致。细菌中优势菌的变化影响着果胶酶活性的变化[31-32]。

