冬凌草甲素-介孔二氧化硅固体分散体的制备及体外性质评价
李钦,原永芳,杨刚(上海交通大学医学院附属第九人民医院 药剂科,上海 200000)
冬凌草甲素(ORI)是从冬凌草或碎米亚等唇形科香茶菜属植物中分离出的一种有活性的天然有机化合物。研究表明,ORI具有较强的抗肿瘤活性,同时还具有抗菌、杀虫及消炎止痛等功效[1-3]。目前,上市的冬凌草制剂均为粗提取物制剂,即片剂和糖浆剂等口服剂型,其所含有效成分ORI的含量较低,如冬凌草甲素片剂中其含量仅为1.189%[4],因ORI几乎不溶于水,且溶出速率较慢,因此口服后其生物利用度较低。
药物的溶出是吸收的前提,对于难溶性药物,药物的溶出速率常为其吸收的限速步骤[5]。改善药物的体内吸收首先需要解决的就是提高药物的溶出度。介孔二氧化硅(MSN)固体分散体作为一种新型载体,它可以使吸附的难溶性药物的结晶状态发生改变,防止难溶性药物重结晶,从而提高水难溶性药物的溶解度。本研究利用MSN为载体制备ORI-MSN固体分散体,希望在高载药量的前提下,提高药物的水溶性和溶出度,从而提高药物的口服吸收效果。
1 仪器与试药
1.1 仪器
LC-2010AHT 高效液相色谱仪(日本岛津公司);IKA RCT磁力搅拌器(德国 IKA公司);RC-806 溶出度仪(天津因赛科技发展有限公司);D8 ADVANCE X-射线衍射仪(德国布鲁克公司);DZF6050 真空干燥箱(上海博远实业有限公司);Q2000 差示扫描量热仪(美国 TA 公司)。
1.2 试药
ORI对照品(含量≥99%,批号:111721-201403,中国食品药品检定研究院);ORI原料药(含量≥98%,批号:E1526003,上海阿拉丁生化科技股份有限公司);冬凌草片(规格:0.25 g/片,批号:180501,河南济世药业公司);正硅酸乙酯(TEOS,批号:20200214,永华化学股份有限公司);十六烷基三甲基溴化铵(CTAB,批号:20180423,国药集团化学试剂有限公司);甲醇、乙腈为色谱级;其余试剂为市售分析纯。
2 方法
2.1 ORI 分析方法的建立
2.1.1 色谱条件[6]色谱柱:Dikma Diamonsil Plus-C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-水(60∶40);流速:1 mL·min-1;进样量:20 μL;柱温:25℃;检测波长:242 nm。
2.1.2 标准曲线制备 精密称取 ORI 对照品适量溶于甲醇中,分别配制成质量浓度为 10、30、60、90、120 μg·mL-1的 ORI系列对照品溶液,进样测定,记录峰面积值A,以质量浓度C对峰面积A作线性回归,得回归方程。
2.1.3 精密度试验 取10、60、120 μg·mL-13个质量浓度的ORI对照品溶液,在同一色谱条件下,分别在日内和日间重复测定5次,平行操作 5份,计算日内精密度和日间精密度。
2.1.4 回收试验 取 10、60、120 μg·mL-13个质量浓度的ORI对照品溶液,加入空白MSN混悬液中,10 000 r·min-1离心10 min,上清液用0.45 µm微孔滤膜过滤,平行操作5份,取滤液进样测定,计算回收率。
2.2 溶解度测定
在西林瓶中分别加入蒸馏水、0.2%十二烷基硫酸钠(SDS)、0.2%吐温-80、0.5%吐温-80适量,分别加入过量ORI原料药,封瓶口,25℃水浴振荡 48 h,取样,12 000 r·min-1离心 10 min,经0.45 µm微孔滤膜过滤,取滤液20 µL进样测定,计算ORI在不同介质中的溶解度。
2.3 MSN 的制备 [7]
以 CTAB 作为胶束模板,于 150 mL 蒸馏水中溶解 0.5 g CTAB,配成澄清溶液。缓缓向此溶液中加入浓度为 2 mol·L-1的 NaOH 溶液6 mL,边加边搅拌,混匀后,水浴加热至 60℃,维持恒温,缓慢滴入 TEOS 6 mL,高速搅拌 2 h。将所得浑浊液离心,洗涤,然后将所得白色固体转移至三口烧瓶中,并加入酸性乙醇溶液(乙醇-盐酸 4∶1)150 mL,待其充分分散后,加热至80℃回流 3 h 以便除去 CTAB,再次抽滤,并用蒸馏水和无水乙醇交替洗涤 3 次,于50℃真空干燥,即得MSN 载体粉末。
2.4 ORI-MSN的制备[8]
精密称取适量ORI,用100 mL乙醇溶解,分别按照ORI与MSN质量比为1∶1、1∶2、1∶3、1∶4、1∶6和 1∶10的比例加入MSN 粉末,水浴超声将载体完全分散,用磁力搅拌器搅拌 4 h,以达到吸附平衡,置于50℃条件下旋转蒸发去除溶剂,得到颜色均一的固体粉末。随后将所得粉末置于真空干燥箱中干燥 24 h(25℃),研细,过80目筛,即得ORI-MSN。
2.5 载药量测定
精密称取适量ORI-MSN分散于氯仿中,水浴超声10 min后用氯仿定容至10 mL,10 000 r·min-1离心 5 min,取上清液用甲醇稀释后采用HPLC 进行检测,载药量的计算公式如下:载药量(%)=WORI/WORI-MSN×100%,式中,WORI表示ORI-MSN中ORI的质量,WORI-MSN表示负载ORI的MSN的质量。
2.6 透射扫描电镜(TEM)
利用透射电镜观察 ORI-MSN的外观形态。将分散有ORI-MSN的去离子水,取适量滴加至铜网上,自然干燥,等待约20 min即可形成薄膜,再在薄膜上滴加2%磷钨酸负染10 min,用滤纸小心吸除铜网边缘多余的液体,自然干燥后置于透射电镜下观察。
2.7 物相鉴别
采用Cu-Kα射线作为X-射线,管电压40 kV,管电流20 mA,衍射角(2θ)的测定范围为0~60°,步长为 0.02°。分别对ORI、MSN、ORI-MSN以及物理混合物进行XRD分析。
取 ORI、MSN、ORI-MSN 以及物理混合物适量(2~6 mg),分别装入铝坩中进行差示扫描量热(DSC)分析,以空铝坩锅为参比,扫描范围10~300℃,升温速度为10℃·min-1,氮气流速为60 mL·min-1。
2.8 稳定性考察
在温度(40±2)℃和相对湿度(75±5)%的条件下,将 ORI-MSN进行加速试验,分别于1、2、3、6个月末取样,比较存放前后 ORI含量和溶出度变化。
2.9 ORI-MSN 的体外溶出试验
2.9.1 ORI-MSN 在不同溶出介质中的溶出度按照溶出度测定法(《中国药典》2010年版二部附录ⅩC浆法),取 ORI-MSN适量,分别以 900 mL蒸馏水、0.1 mol·L-1HCl、pH 6.8 的磷酸盐缓冲液为溶出介质,37℃,转速 50 r·min-1,于 5、10、15、20、30、45、60、90、120 min各取样 5 mL,并及时补充相同温度的溶出介质 5 mL,取出的样品用0.45 μm 微孔滤膜过滤,取续滤液进样测定,计算在不同时间得到的ORI的累积溶出百分率,并绘制溶出曲线。
2.9.2 溶出度比较 取 ORI 原料药、市售制剂冬凌草片及 ORI-MSN 适量,按照溶出度测定法(《中国药典》2010年版二部附录ⅩC第一法),以 900 mL 蒸馏水为溶出介质,按“2.9.1”项下方法操作,进样测定,计算不同时间药物的累积溶出百分率,绘制溶出曲线。
3 结果
3.1 方法学考察
回归方程为A=18.97C-0.1631(r=0.9999),ORI在10~120 μg·mL-1与峰面积线性关系良好。同时,日内RSD和日间RSD分别为0.19% 和0.24%,平均回收率为(99.7±0.17)%,表明该方法适用于 ORI 的含量测定。
3.2 ORI 在不同溶剂中的溶解度
由表1可知,在所考察的溶剂中,ORI原料药在蒸馏水中的溶解度最低,在0.2%SDS中的溶解度最好。

表1 ORI 在各种溶剂中的溶解度(n=3)Tab 1 Solubility of ORI in various solvents (n=3)
3.3 不同药载比对载药量的影响
不同药载比所得载药量的结果见图1,药载比例与介孔孔道的载药量成正比。当药载比例大于1∶3时,载药量逐渐接近极值,此时介孔孔道的吸附量接近饱和。继续提高药物比例,药物装载量基本不变。因此选择药载比例为1∶3,得到的载药量为(26.47±1.18)%。

图1 不同药物 / 载体比例的载药量曲线(n=3)Fig 1 Curve of drug loading with different ratios of drugs and carriers(n=3)
3.4 外观形态
图2为ORI-MSN的透射电镜图。由图可知,ORI-MSN形态完整,均呈椭球形,粒径均一,尺寸约为100 nm,且有规整的孔道结构。

图2 ORI-MSN透射电镜图Fig 2 Transmission electron microscopy image of ORI-MSN
3.5 物相分析
XRD结果如图3所示,ORI在2θ为4.337°、9.183°、19.203°、43.827°有尖锐的特征峰,表明 ORI主要以晶体形式存在,晶体衍射峰强度较大;ORI-MSN中,ORI的晶体衍射峰消失,表现为无定形特征;而在物理混合物仍然出现 ORI的晶体衍射峰,这一现象表明药物与载体之间未发生分子间的作用。

图3 ORI 原料药、MSN、物理混合物及 ORI-MSN 的 XRD 谱图Fig 3 XRD of ORI,MSN,physical mixture,and ORI-MSN
DSC结果如图4所示,ORI在 257.7℃有特征吸热峰,物理混合物中也存在ORI的特征吸热峰。在制备成ORI-MSN后,ORI在 257.7℃特征吸热峰消失,说明药物与载体之间发生了反应,MSN 的小孔道妨碍了 ORI 形成结晶,在MSN中ORI只能以非晶体的状态存,进一步证实了XRD的结果。

图4 ORI 原料药、MSN、物理混合物及 ORI-MSN 的 DSC 谱图Fig 4 DSC of ORI,MSN,physical mixture and ORI-MSN
3.6 稳定性评价
由表2可得,ORI原料药在同一温湿度条件的环境下加速试验6个月后,药物含量几乎没有变化;ORI-MSN中的药物含量有所下降,但是仍在96%以上,说明ORI-MSN的稳定性较好。造成ORI-MSN中药物含量降低的原因可能是由于ORI负载于MSN 后,形成的物理结构在热力学上是不稳定的无定形或部分无定形状态,其受热后会转化为更稳定的药物结晶,所以药物含量有所降低[8-9]。而ORI原料药以淡黄色针状结晶存在,因此稳定性更好。此外,ORI原料药和ORI-MSN 的累积溶出在放置 6个月后,并无明显变化。
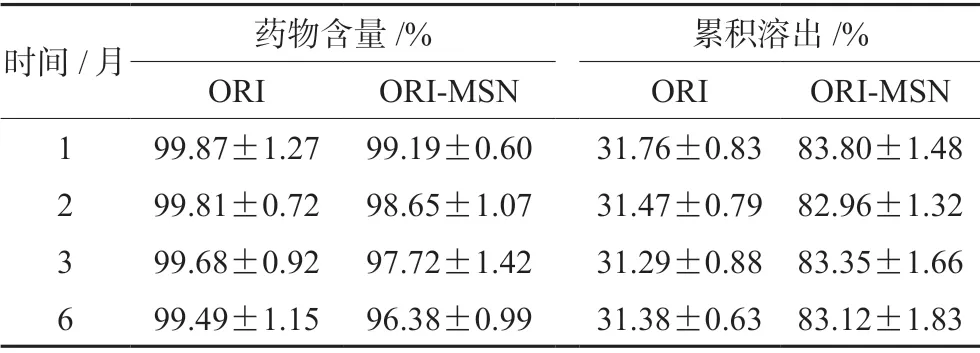
表2 稳定性研究(n=3)Tab 2 Study of stability (n=3)
3.7 体外释药曲线
由图5可知,在不同溶出介质中,ORIMSNs的溶出度大小顺序依次为:0.1 mol·L-1HCl>蒸馏水>pH 6.8的磷酸盐缓冲液,即溶出介质pH越小,ORI-MSNs的溶出度越大。故后续试验的溶出介质选择pH 6.8的磷酸盐缓冲液。

图5 ORI-MSN 在不同溶出介质中的体外释放曲线(n=3)Fig 5 In vitro release curve of ORI-MSN in different dissolution media(n=3)
对比市售制剂冬凌草片,ORI原料药,以及ORI-MSN的溶出度可知(见图6),ORI原料药溶出度较小,溶出速率也较慢,累积溶出度小于30%;冬凌草片在120 min时的累积溶出度为65.43%;ORI-MSN溶出度最大,在60 min后累积溶出在80%以上。上述结果表明,制成ORIMSN后显著提高了ORI的溶出度。

图6 ORI、市售制剂和 ORI-MSN 的体外释放曲线(n=3)Fig 6 In vitro release curve of ORI,commercial product and ORIMSN(n=3)
4 讨论
药物生物利用度受药物的溶解性能影响较大,在胃肠道溶出较慢,致使口服生物利用度低。改善难溶性药物的溶出方式有很多[11],其中采用固体分散技术,将药物高度分散于惰性的载体中,形成药物的固态分散体系,可显著增加难溶性药物的溶出速率[12]。近年来,MSN作为药物固体分散体载体材料,在制药领域中广泛使用。MSN内部的孔道大大增加了比表面积,能吸附大量药物并使药物均匀分散,降低颗粒间的吸附作用,从而避免一些细粉状药物的附聚与结块,有利于药物粒子与溶解介质充分接触,促进药物的溶解与释放[13]。MSN孔道还抑制了难溶性药物形成结晶,在MSN中难溶性药物只能以无定形或微晶状态存在[14],而无定形或微晶状态会增加药物溶出度[15]。同时,MSN的孔道由于增加了比表面积,促进药物的溶解与释放,进而提高了生物利用度[16-17]。此外,MSN的使用还可起到抗老化作用,因其提高了固体分散体的稳定性[18]。
本研究成功将ORI负载于MSN中,ORI在与MSN 结合后发生了晶型转变,药物以无定形存在于MSN孔道中,并能够保持相对稳定。体外溶出试验结果表明,对于难溶性的ORI应用MSN作为载体后,显著提高了ORI的溶出速率和累积溶出百分率。该研究为ORI的临床应用带来更广泛的可行性,也说明MSN可以改善难溶性中药成分的溶出度。
虽然MSN作为难溶性药物的载体有很多优点,但还缺少其他相关研究,包括进入人体后发生的变化和体内代谢过程,因此仍需谨慎评估其安全性并对比其他给药载体,因此MSN载体技术真正应用于临床还需不断的探索和努力。

