新型冠状病毒灭活操作对利奈唑胺血药浓度的影响及一致性评价
唐原君,尹悦勤,陈明,汪硕闻*,范国荣(. 上海交通大学附属第一人民医院 临床药学科,上海00080;. 上海健康医学院,上海 038)
新型冠状病毒肺炎(简称新冠肺炎,COVID-19)为新发急性呼吸道传染病,目前已成为全球性重大的公共卫生事件[1]。根据病例的回顾性研究,部分重症患者往往存在合并细菌、真菌感染的情况[2-3],必须联合使用抗菌药物和抗真菌药物进行治疗。利奈唑胺是新一代全合成的噁唑烷酮类抗菌药物,临床用于治疗革兰氏阳性球菌所致的感染,对葡萄球菌属、肺炎链球菌属、肠球菌属细菌都具有高度的抗菌活性[4]。然而其在体内的药动学特征却存在较大的个体差异,肾功能、合并用药、年龄、体重等因素均可影响利奈唑胺的血药浓度,为避免或减少其不良反应,提高药物疗效,开展治疗药物监测(TDM),实施科学个体化给药将发挥重要作用[5]。根据《新型冠状病毒肺炎患者血药浓度检测技术指引》中的相关要求,针对新冠肺炎患者的外周静脉血标本,需要按规定严格做好防护[6]。TDM项目送检样本属于未经培养的感染性材料,其操作应当在生物安全二级实验室进行,同时采用生物安全三级实验室的个人防护。
鉴于目前国内许多开展TDM的实验室均不符合生物安全二级实验室的相关要求,且在防护物资紧张的情况下也无法满足生物安全三级实验室的个人防护的要求。在保证监测方法准确性和可靠性的基础上,能否通过病毒灭活的操作方法对临床获取标本进行处理,成为后疫情时代下TDM从业者亟待解决的关键问题。根据指南推荐的对于生物标本的病毒灭活方法可采取湿热法和紫外消毒法,已有报道对万古霉素和伏立康唑的临床生物标本经新型冠状病毒(SARS-CoV-2)灭活处理后的稳定性进行了考察[7-8]。本研究考察了新型冠状病毒不同灭活方式对利奈唑胺血药浓度的影响,以此填补病毒灭活操作对TDM样本稳定性影响的空白,为开展其他相关TDM的医疗机构提供参考借鉴。
1 仪器与试药
1.1 仪器
Thermo UltiMate_3000超高效液相色谱仪(美 国Thermo Fisher),包 括LPG-3x00色 谱泵,WPS-3000自动进样器,TCC-3x00柱温箱,VWD-3x00检测器,采用Chromeleon 6.80工作站进行数据分析。HY-5涡旋混合器(美国SI公司);Centrifuge 5804R冷冻离心机(德国Eppendorf公司);AL104-01电子分析天平(瑞士METTLER TOLEDO);SK7200H超声仪(上海科导超声仪器有限公司);Hi-Tech水纯化系统(18.2M,上海和泰仪器有限公司)。
1.2 试药
利奈唑胺对照品(纯度:98%,批号:M0801AS)、苯妥英钠对照品(纯度:99%,批号:J0727AS)(大连美仑试剂有限公司),磷酸二氢钾(批号:20190725,上海凌峰化学试剂有限公司),异丙醇(批号:K49790140802)、甲醇(批号:1036307929)(德国Merck Millipore公司),甲基叔丁基醚(批号:17080261,美国Tedia公司),水为Hi-Tech水纯化系统自制的去离子水(18.2 MΩ)。
2 方法与结果
2.1 色谱条件
参考文献,采用超高效液相色谱法测定利奈唑胺的浓度[9]。以苯妥英钠为内标,色谱柱采用Agilent ZORBAX SB-C18(1.8 μm,2.1 mm×100 mm),柱温:30℃,流动相:甲醇-水=55∶45(V/V),等度洗脱,流速:0.3 mL·min-1,检测波长:254 nm,进样量20 μL,分析时间3 min。典型色谱图见图1,利奈唑胺的保留时间为1.473 min。质控血浆样品和临床样本根据测定当日的随行标准曲线进行定量。
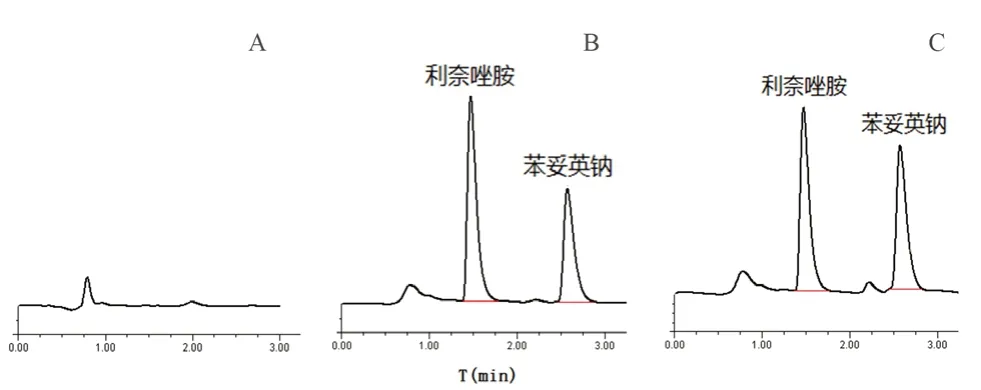
图1 人血浆中利奈唑胺高效液相色谱图Fig 1 Typical chromatogram of linezolid and phenytoin sodium in human plasma
2.2 溶液配制
精密称取利奈唑胺对照品10.51 mg,置于10 mL量瓶中,加甲醇溶解,定容,摇匀,即得利奈唑胺质量浓度为1.051 mg·mL-1的对照品储备液,置于4℃冰箱保存。
精密称取苯妥英钠对照品10.02 mg,置于10 mL量瓶中,加甲醇溶解,定容,摇匀,即得苯妥因钠质量浓度为1.02 mg·mL-1的对照品储备液,用甲醇溶液逐级稀释成1.02 μg·mL-1的对照品工作液,置于4℃冰箱保存。
2.3 新冠病毒灭活方法
①湿热灭活法:在56℃水浴加热30 min;②紫外灭活法:在紫外灯下照射60 min。
2.4 血浆样品前处理
取人血浆样品200 μL置于1.5 mL离心管中,加入20 μL内标(苯妥因钠1.02 μg·mL-1),涡旋混匀,再加入1 mL提取溶剂(叔甲醚-异丙醇=90∶10,V/V),涡旋振荡5 min,于13 000 r·min-1离心10 min。取上清液800 μL,于氮气下吹干,加200 μL流动相复溶,涡旋振荡1 min,于13 000 r·min-1离心5 min,取上清液80 μL置于进样器中自动进样20 μL测定。
2.5 新冠病毒灭活操作对利奈唑胺样品稳定性考察
2.5.1 新冠病毒灭活方法对利奈唑胺对照品溶液浓度的影响 取利奈唑胺对照品储备液,用甲醇逐级稀释成质量浓度为2.63、5.26、10.51 μg·mL-1的利奈唑胺质控对照品溶液,分别采用湿热灭活法和紫外灭活法对利奈唑胺质控对照品溶液的稳定性进行考察。结果如表1所示,采用紫外灭活法,利奈唑胺的实测浓度仅为标示值的59.23%、16.75%、3.51%,且随着浓度的增高,利奈唑胺降解越多。根据《中国药典》2020年版“原料药物与制剂稳定性试验指导原则(9001)”中关于制剂质量的定义,本研究中将对照品准确度范围定义为标示值的95%~105%。若超过此范围,则认为该化合物在该新冠病毒灭活操作条件下不稳定,不予考虑进行后续的生物样品稳定性实验。结果表明,采用湿热法灭活操作未对利奈唑胺对照品溶液产生影响,采用紫外法灭活操作后利奈唑胺对照品溶液不稳定,后续实验选择湿热灭活法进行操作。
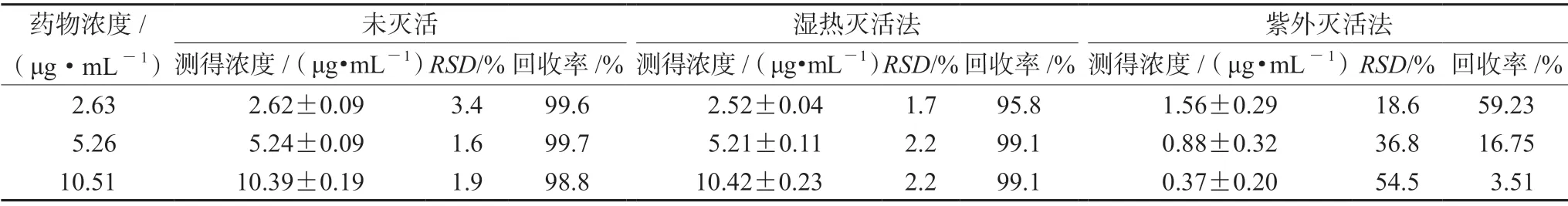
表1 新冠病毒灭活法对利奈唑胺质控对照品溶液浓度影响考察(n=6)Tab 1 Effect of SARS-CoV-2 virus inactivation on the concentration of linezolid quality control reference solution (n=6)
2.5.2 湿热灭活法对利奈唑胺质控血浆样品浓度的影响 取利奈唑胺对照品储备液,用空白血浆配制成质量浓度为2.63、5.26、10.51 μg·mL-1的利奈唑胺质控血浆样品,采用湿热灭活法进行利奈唑胺质控血浆样品稳定性考察。未灭活样品和湿热灭活法操作后的样品,按“2.4”项下方法操作,结果见表2。采用血浆样品处理湿热法灭活后,利奈唑胺质控血浆样品低、中、高浓度的准确度分别为99.1%、94.9%和100.1%,RSD均小于15%。根据“生物样品定量分方法验证指导原则(9012)”中关于生物样品准确度的规定,本研究中将生物样品的准确度范围定义为标示值的85%~115%,若超过上述范围则认为该生物样品在此操作下不稳定。结果表明,采用湿热法灭活操作未对利奈唑胺质控血浆样品的稳定性产生影响。
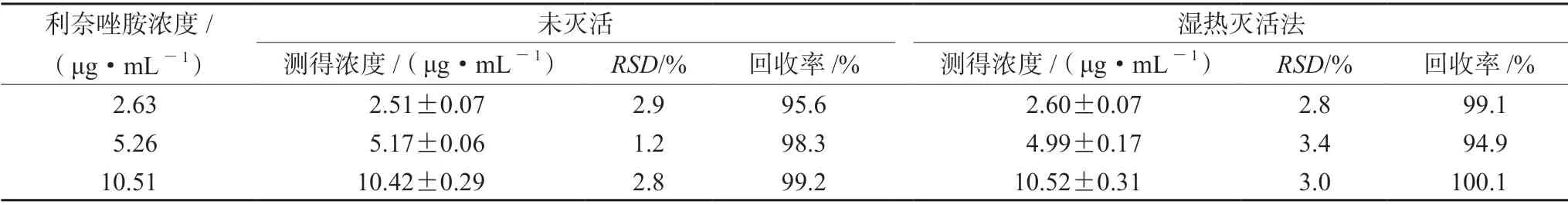
表2 湿热法灭活对利奈唑胺质控血浆样品浓度影响考察(n=6)Tab 2 Effect of damp heat inactivation on the concentration of linezolid quality control plasma samples (n=6)
2.5.3 利奈唑胺血药浓度监测样本湿热灭活前后分析方法一致性评价 选取本院重症医学科使用利奈唑胺的患者58例,采集稳态谷浓度血液标本,经6000 r·min-1离心5 min分离上层血浆,采用湿热灭活法进行利奈唑胺临床样品稳定性考察,分别测定未灭活操作、湿热灭活法操作后的利奈唑胺血药浓度。
采用SPSS 19.0统计软件对两种方法测定结果进行组内相关系数(intraclass correlation efficient,ICC)值统计分析,统计结果显示未灭活操作与湿热灭活操作的利奈唑胺浓度结果的相关系数值为0.997(P<0.001)。说明所检测数据可信度高、一致性较好(ICC>0.75),可以初步判断两组TDM检测结果可重复性较好。
采用MedCalc软件对两种方法测定结果进行Passing-Bablok回归法相关分析,以未进行灭活操作所测得利奈唑胺的浓度结果(Y)与湿热灭活法操作所得利奈唑胺的浓度结果(X)进行线性回归分析,回归方程为Y=-0.042 35+1.009X(R2=0.9957,n=58),如图2所示。其斜率和截距均在95%的置信区间内,表明两种方法之间不存在系统误差和比例误差,测定结果之间的相关性良好(R2>0.95)。Passing-Bablok回归法证明两种检测方法可以互相代替。
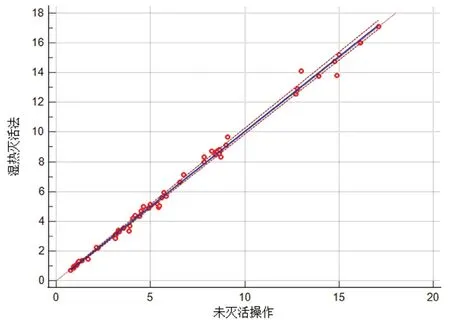
图2 利奈唑胺未灭活操作与湿热灭活法Passing-Bablok线性回归分析图Fig 2 Passing-Bablok linear regression of un-inactivation and damp heat inactivation on linezolid
采用MedCalc软件将两种方法测定的利奈唑胺浓度值进行Bland-Altman分析,绘制偏差图,如图3所示。58例利奈唑胺实测配对数据差值的均数d=-0.0133,则95%一致性界限为(-0.5880,0.5613)。从图3可以看出96.55%(56/58)的点在95%一致性界限以内,符合相关要求。在一致性界限范围内,未灭活操作的血药浓度值与湿热法灭活操作后血药浓度值相比,差值的绝对值最大为1.18。由图3中可知使用百分比比值计算一致性界限时,95%一致性界限为(-9.6668%,10.3177%),96.55%(56/58)的点在95%一致性界限内,此相差幅度在临床上可以被接受。Bland-Altman分析证明湿热灭活法与未灭活操作两种检测方法可以互换。
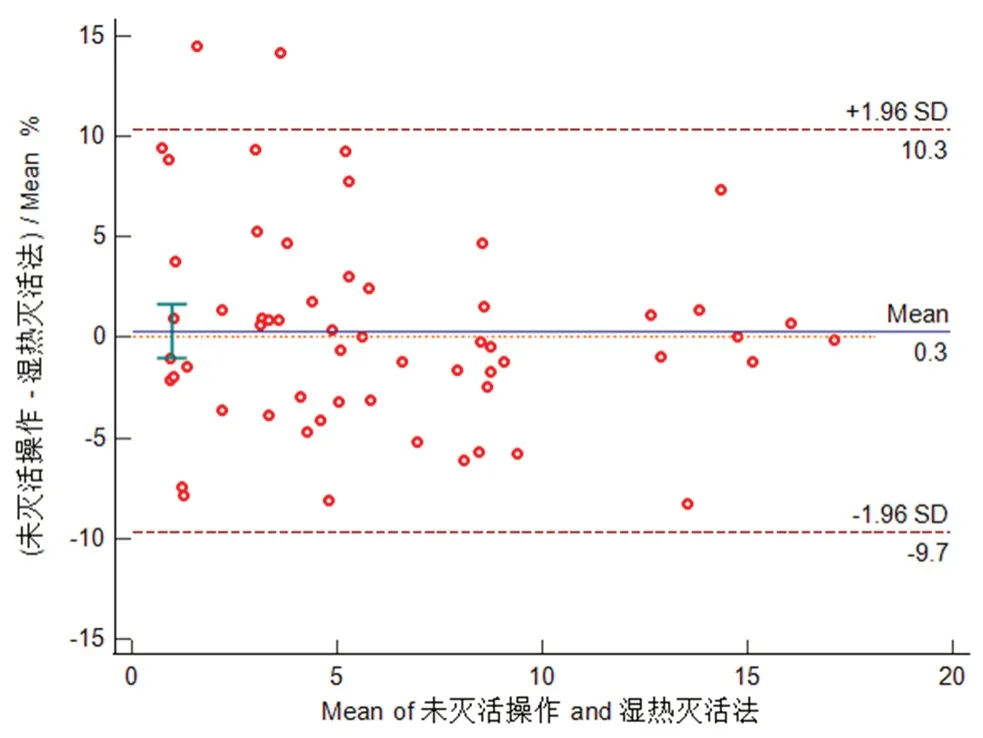
图3 利奈唑胺未灭活操作与湿热灭活法Bland-Altman分析图Fig 3 Bland-Altman analysis of un-inactivation and damp heat inactivation on linezolid
3 讨论
《新型冠状病毒肺炎诊疗方案(试行第八版)》中提出,新冠病毒对紫外线和热敏感,56℃ 30 min、乙醚、75%乙醇、含氯消毒剂、过氧乙酸和氯仿等脂溶剂均可有效灭活病毒[1]。针对重症新冠肺炎患者往往合并细菌、真菌感染的情况,临床亟需对抗菌药物的血药浓度监测标本开展新冠病毒灭活操作稳定性的研究,以保护相关医护人员的操作安全。目前尚未见到关于新冠病毒灭活操作对利奈唑胺血浓度监测影响的研究报道,本文主要采用湿热法和紫外法灭活病毒。
研究结果发现,利奈唑胺样品经湿热灭活法后测定浓度与灭活前无明显差异,但经紫外灭活法处理后出现明显降解,有文献报道,利奈唑胺在光化学条件下会发生C-F键的断裂,进而产生相应的三线态笨基阳离子,发生光降解现象[10-11]。且在紫外灭活法中,随着利奈唑胺浓度的升高,降解率增大,推测可能是由于在高浓度时,利奈唑胺的光化学动力学受反应中间体形成的影响,比如自由基,引起链式反应从而提高光降解率,造成利奈唑胺的浓度和光降解速率成正比。
本研究中所采用的临床患者血样均是在病区进行分离血浆的操作后送至实验室进行检测的,考虑到全血样品在分离血浆的操作中也存在感染病毒的风险,本研究对全血样品也进行了灭活前后的考察,发现湿热灭活法会使全血样品发生严重的溶血现象,样品检测的色谱图杂质峰较多,会对利奈唑胺的保留时间造成干扰,且影响到利奈唑胺检测的灵敏度。因此本研究中主要是对血浆样品进行灭活前后的考察。
在一致性评价过程中,采用多种方法从不同角度进行综合评价,可以避免单一评价方法的局限性,也使得评价结果更具有代表性[12-13]。本文采用经典的临床分析检验一致性评价方法来判断利奈唑胺样品经过病毒灭活处理与未灭活处理的一致性,通过计算ICC值、Passing-Bablok回归法和Bland-Altman偏差图分析法进行综合分析考察,证明湿热法新冠病毒灭活操作不会对利奈唑胺血药浓度监测结果产生影响。
综上所述,在新冠肺炎疫情防控期间,对于利奈唑胺的TDM检测血浆样本可采用56℃、30 min湿热法进行病毒灭活操作,不可采用紫外灭活方式。后续将对更多的抗菌药物进行新冠病毒灭活操作影响的考察,从而减少疫情期间TDM相关医护人员病毒感染的风险。

