基于数据库分析ASF1B在胃癌中的表达与预后的关系
李蒙蒙黄 露李全营密奥宁纪知语秦长江
河南大学淮河医院 普通外科,河南 开封475000
根据国际癌症研究机构(IARC)的估计,2018年胃癌的发病率和死亡率较2012 年的统计增加[1]。目前全世界新增胃癌病例占所有确诊癌症的5.7%,死亡率占所有确诊癌症病例的8.2%,是全球第五大最常见的癌症类型和死亡率仅次于肺癌和结直肠癌的第三大癌症类型。并且,绝大多数胃癌病例发生在发展中国家[2]。早期诊断、早期治疗对于胃癌的预后至关重要,准确的胃癌生物标记物可有助于胃癌的早期诊断和指导治疗。
哺乳动物中有两种ASF1 亚型,分别是ASF1A 和ASF1B,作为组蛋白H3/H4 的伴侣蛋白,为组蛋白H3/H4 提供N-末端作为结合界面[3]。ASF1 编码的蛋白作为细胞周期调控激酶TLKs家族的底物,chk1 通过调节TLK1 潜在协调ASF1 组蛋白结合能力,并推动DNA 修复过程。在调节核小体结构中确保核小体组装位点上组蛋白的持续供应[4,5]。肾细胞癌、前列腺癌、宫颈癌、乳腺癌患者的发生及预后与ASF1B 有密切关系[6-9]。目前ASF1B在胃癌中的表达及预后价值仍不清楚,本研究利用TCGA 数据库研究ASF1B在胃癌的预后价值和作用通路,并用GEO 数据集验证结果准确性。
1 材料与方法
1.1 数据来源
从癌症和肿瘤基因图谱(TCGA,https://portal.gdc.cancer.gov/)中下载407 个胃癌样本的mRNA 的表达数据(版本为2019-07-20 的Htseq-counts,其中包括375 个肿瘤组织和32 个癌旁样本)和临床数据。GEO(Gene Expession Omnibus)数据库作为验证组,从中下载433 个胃癌肿瘤组织的mRNA 的表达数据(来自GSE84437 芯片,并进行标准化)和临床数据。
1.2 方法
运用R3.6.3 版本进行分析,从TCGA 数据库中提取ASF1B mRNA 的表达量,研究整体和配对癌组织与癌旁组织中的表达是否具有差异,并从gepia2(gepia2.cancer-pku.cn)上验证。根据ASF1B 表达中位值将TCGA 组和验证组样本分为高表达和低表达组,采用Kaplan-Meier 方法分析ASF1B 高低表达的总生存率是否具有差异。采用COX 回归方法探讨实验组和验证组中目的基因表达和其他相关临床因素对总生存期的影响,绘制列线图以对病人进行较好的个体化预,测并通过计算C-index 验证预测模型准确度。应用GSEA_4.0.3 版软件对实验组ASF1B 高低之间差异基因进行KEGG 富集分析,将FDR<25%的基因集作为显著富集基因集[10]。
2 结果
2.1 ASF1B 基因在胃癌肿瘤组织和癌旁组织中的表达
在TCGA 组中整体肿瘤组织中ASF1B mRNA 表达明显高于癌旁组织(P<0.001),见图1A;在gepia2 中得到相似的结果,见图1B;癌旁组织ASF1B 表达量明显低于来自同一样本的肿瘤组织(P=<0.001),见图2。
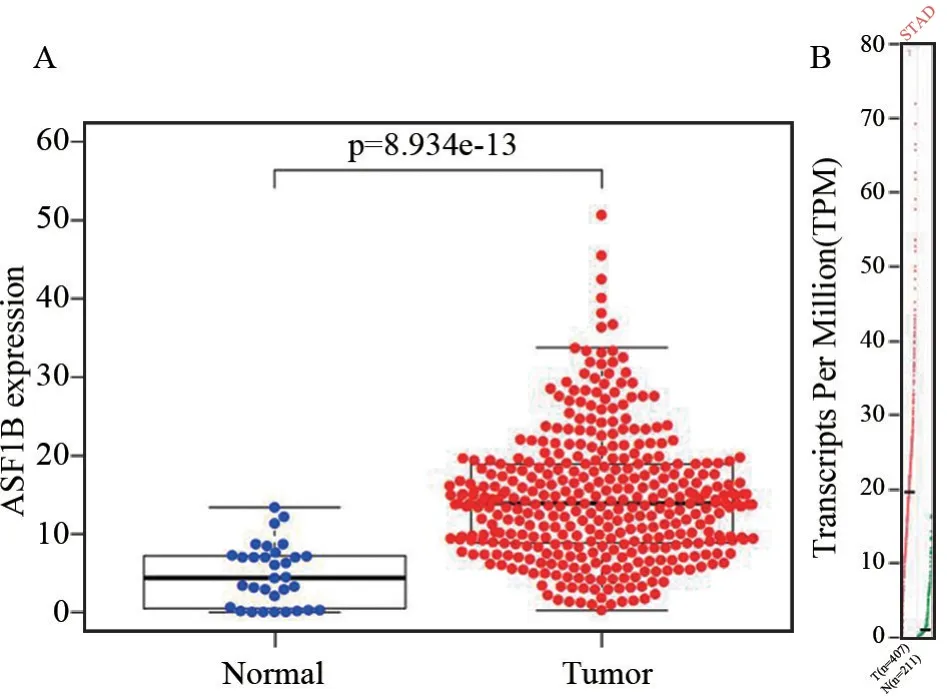
图1 ASF1B 基因mRNA 表达水平分析

图2 TCGA 中ASF1BmRNA在胃癌组织和配对癌旁正常组织的表达差异
2.2 胃癌患者ASF1B 基因表达水平与预后相关性分析
通过KaPlan-Meier 生存曲线分析ASF1B 表达高低与总体生存率是否具有影响,研究发现ASF1B表达与胃癌患者总体生存率显著相关,高表达组相对于低表达组具有更高的生存率(P=0.032),见图3A;在验证组应用同样的方法进行分析得出相似结果(P=0.018),见图3B。

图3 ASF1B 高低表达组的总体生存率之间差异
应用COX 比例风险模型分析胃癌患者的临床病理特征与预后关系。在实验组中单因素COX 模型分析结果表明,胃癌患者预后与ASF1B 表达显著相关(P=0.032,HR=0.973,95%CI=0.949~0.998),此外还分别与年龄、分期、T、M、N 有显著相关性(P<0.05),见图4A;在验证组中ASF1B 表达与胃癌患者预后具有显著相关性(P=0.004,HR =0.785,95%CI=0.665~0.927),此外还分别与年龄、T、N 有显著相关性(P<0.05),见图4B;多因素COX 比例风险模型结果表明实验组中胃癌患者预后与ASF1B 表达量显著相关(P=0.006,HR =0.961,95%CI =0.934~0.988),此外还与年龄、性别、M 有显著相关性(P<0.05),见图5A;在验证组中胃癌患者预后与ASF1B表达量有显著相关关系(P=0.017,HR =0.811,95%CI=0.684~0.963),此外还与年龄、T、N 有显著相关性(P<0.05),见图5B。根据多因素COX 比例风险模型构建列线图,C-指数为0.70,95%CI =0.66~0.74,验证组C 指数为0.68,95%CI =0.65~0.72,说明该模型分辨度较好,见图6。

图4 单因素COX 回归分析ASF1B 表达水平和临床病理因素与预后相关性

图5 多因素COX 回归分析ASF1B 表达水平和临床病理因素与预后相关性

图6 多因素COX 回归模型建立列线图
2.3 ASF1B在胃癌中的相关通路
为了研究ASF1B 基因对于胃癌可能的作用机制,将实验组胃癌样本ASF1B 表达量按中位值分为高表达和低表达组,将两组的表达数据进行了GSEA(Game set enrichment analysis)比较。结果表明,ASF1B 高表达肿瘤样本在碱基切除修复、细胞周期、同源重组、错配修复、核苷酸切除修复等生物学过程或通路存在富集。而ASF1B 低表达组在ECM受体相互作用和Hedgehog 信号等信号通路存在富集,见图7。

图7 GSEA 分析高低表达组富集的生物学过程及信号通路
3 讨论
目前研究表明,ASF1 是组蛋白H3/H4 的伴侣蛋白,参与DNA 复制和修复以及转录调控[11]。关于影响胃癌预后因素的包括细胞周期调控因子、微卫星不稳定性(MSI)、细胞凋亡调控因子、DNA 修复等[12],细胞周期蛋白D1(Cyclin D1)能够正向调节细胞周期过程,但过度表达与胃癌的低分化和不良预后有关[13]。而细胞周期蛋白激酶抑制剂P27KiP1 具有减缓甚至停止细胞分裂的功能,研究结果显示,P27KiP1 低表达与胃癌病人不良预后有关[14]。MSI 主要是由于基因突变造成,最近关于胃癌的突变分析显示有37 个明显突变基因,如TP53、KRAS、PIK3 等,而造成高突变性的原因主要是DNA错配修复的缺陷[15-16];ASF1 蛋白作为TLKs 家族的底物,而TLK 失活会损害核小体的组装,并会导致单链DNA 断裂和复制叉停止,最终诱发DNA 损伤反应[17]。
ASF1B在前列腺癌的研究[7]中表明敲除ASF1B 可以通过抑制PIK3/AKT 信号通路从而减少了前列腺癌的增殖,促进了细胞凋亡和细胞周期阻滞,ASF1B 高表达与前列腺癌患者的不良预后有关。在肾透明细胞癌中ASF1B 高表达通过上调PCNA和下调P27 表达促进细胞增殖,上调MMP2 和MMP9 促进细胞迁移,同样通过AKT 通路促进癌细胞的增殖和迁移[8]。然而,胃癌病人中ASF1B 低表达与患者的不良预后有关,这可能与肿瘤的组织特异性和微环境不同导致ASF1B在胃癌中的作用通路不同有关。通过GSEA 富集分析表明,胃癌病人中ASF1B 高表达主要在调控细胞周期和DNA 错配修复上存在富集,在调控细胞周期的作用机制可能与P27KiP1 相似,在DNA 错配修复的生物学过程中可能通过减少基因突变和DNA 损伤反应,进而减少微卫星不稳定性(MSI)[18]。而胃癌病人中ASF1B低表达主要在细胞外基质ECM 受体相互作用和Hedgehog 信号通路上存在富集,肿瘤相关成纤维细胞与巨噬细胞M2 相互作用造成肿瘤微环境TME缺氧,进而导致ECM 的密度和组成发生改变,这一现象造成癌细胞的增殖和迁移[19]。Hedgehog 信号通路在维持胃癌的稳态和肿瘤转化中有重要作用[20],Hedgehog 信号通路异常导致在TME 中分泌含有肿瘤相关的成纤维细胞,导致癌细胞增殖和侵袭[21]。
本研究通过TCGA 数据库首次报道了ASF1B在胃癌患者中的可以作为独立预后因素,指出ASF1B 低表达与胃癌患者的不良预后有关,并通过了GEO 数据库验证;ASF1B在胃癌中具体作用机制及生物学行为需后期通过体内体外实验进一步研究。

