绵羊乳腺上皮细胞的分离鉴定及炎性模型的建立
宣超莹,段景龙,刘茂军,马玉忠* (.河北农业大学 动物医学院,河北 保定 0700;.江苏省农业科学院,江苏 南京 004)
乳腺上皮细胞是一种具有合成和分泌乳汁功能的特化细胞[1],是机体黏膜免疫系统的一部分,是抵御病原体的第一道屏障[2]。大量研究表明,微生物感染是乳房炎发生的主要原因,以葡萄球菌、链球菌和大肠杆菌为主[3-4]。乳房炎会造成乳品质下降,严重影响着养羊业的发展。目前药物治疗乳房炎是普遍使用的方法,但效果不甚理想,通过体外试验进行乳房炎的研究相对较少。本研究旨在获得同一性高、纯度高、活力强的乳腺上皮细胞,并建立乳腺上皮细胞炎性模型,为进行体外研究奠定基础。
1 材料与方法
1.1 实验动物2岁左右健康泌乳期绵羊,体质量25~30 kg,来自河北农业大学实验动物中心。在温度16~28℃,相对湿度40%~60%条件下饲养。该研究经河北农业大学动物管理委员会批准。
1.2 主要试剂DMEM/F12、Ⅰ型胶原酶、0.25% Trypsin购自Gibco公司;CCK-8试剂盒购自Solarbio公司;CK-18抗体购自Abcom公司;TLR-4抗体购自Bioss公司。
1.3 乳腺组织的采集和处理无菌条件下采集5 cm×5 cm×5 cm乳房基部组织,用含有青、链霉素的PBS进行清洗,去除结缔组织,并将组织块剪成1 mm×1 mm×1 mm左右的小块,清洗到没有奶渍和血渍为止。
1.4 组织块法将剪碎的组织块转入6孔板中,于37℃、5% CO2条件下培养6 h,每孔加入2 mL含15% FBS的DMEM/F12继续培养,2~3 d换液1次。
1.5 酶消化组织块法向组织块中加入0.25%Ⅰ型胶原酶,37℃振荡消化1.5 h,1 000 r/min离心5 min,弃上清,转入6孔板中,37℃、5% CO2条件下培养过夜,加入2 mL含15% FBS的DMEM/F12继续培养。
1.6 酶消化法向组织块中加入0.25%的胰酶(Trypsin)于37℃振荡消化15 min后,1 000 r/min离心5 min,弃上清,加入2倍体积10%Ⅰ型胶原酶,37℃振荡消化1.5 h后用100 μm孔径滤网过滤,收集滤液,1 000 r/min离心5 min,弃上清,用含15% FBS的DMEM/F12重悬细胞,置于细胞瓶中,于37℃、5% CO2条件下培养。
1.7 细胞纯化及传代待细胞长到80%~90%时,弃培养基,用PBS洗2遍,以EDTA-Trypsin 于37℃作用1~2 min,加入含15% FBS的DMEM/F12终止消化。将成纤维细胞吹打下来,弃去液体,用PBS洗2次,加入含15% FBS的DMEM/F12继续培养。重复2~3次后得到较为纯净的乳腺上皮细胞。待纯净的细胞再次长满,用PBS清洗后,加入EDTA-Trypsin 于37℃作用4 min,用含15% FBS的DMEM/F12终止消化,传代到培养瓶中继续培养。
1.8 姬姆萨染色待第7代细胞铺满瓶底时弃去原培养基,用PBS洗3遍,加姬姆萨染色A液静置2 min,加入等量B液混匀,静置5 min,洗去多余染色液,晾干后封片,观察。
1.9 乳腺上皮细胞的免疫荧光染色将细胞铺到含盖玻片的平皿中,于37℃、5% CO2条件下培养12 h,用4%多聚甲醛固定;PBS浸洗3次后用0.2% TritonX-100进行通透;PBS浸洗后用1% BSA封闭;加CK-18一抗(1∶100稀释),4℃孵育过夜;用PBS浸洗后加二抗(1∶100稀释),37℃孵育35 min;用PBS浸洗3次,加10 mg/L DAPI,作用5 min;用PBS洗涤后吸干水分,封片,于倒置荧光显微镜下观察。
1.10 乳腺上皮细胞的RT-PCR鉴定提取细胞总RNA,通过反转录得到cDNA。以cDNA为模板,通过引物(β-酪蛋白-F:5′-TGCTACTCATCTTTATTTTGGAC-3′;β-酪蛋白-R:5′-TTCCTAAAACATTTGCAGTCA-3′),进行PCR扩增。25 μL PCR反应体系:2×Mix 12.5 μL,ddH2O 8.5 μL,cDNA 2 μL,上游引物 1 μL,下游引物 1 μL。反应程序:94℃预变性30 s;94℃变性20 s,60℃退火20 s,72℃延伸30 s,35个循环;72℃延伸10 min。通过琼脂糖凝胶电泳检验PCR扩增产物。
1.11 乳腺上皮细胞的生长曲线纯化好的上皮细胞用EDTA-Trypsin消化后,用DMEM/F12重悬细胞,接种到96孔板中,每隔24 h用CCK-8法测D值,连测7 d,绘制生长曲线。
1.12 构建炎性模型的LPS最适质量浓度的筛选将细胞铺到96孔板中,随机分为3个组,每组使用0,5,10,20,50 mg/L LPS处理,每个质量浓度5个孔,3个组在37℃、5% CO2条件下分别处理6,12,24 h。每孔加10 μL CCK-8作用1 h,测D450值,计算相对增长率。
细胞相对增长率(%)=(D加药组-D空白组)/(D对照组-D空白组)×100%
1.13 ELISA法检测细胞培养上清中IL-8和TNF-α的浓度将细胞铺到96孔板中,分成2组,每组5个孔。分别用0,10 mg/L LPS处理12 h,收集细胞培养上清,用ELISA法检测IL-8和TNF-α浓度。
1.14 Western blot法检测TLR-4蛋白的表达将细胞铺到24孔板中,分别使用0,5,10,20,50 mg/L的LPS处理12 h。提取总蛋白,测定蛋白浓度。以40 μg总蛋白/孔的量在12% SDS-PAGE进行电泳,通过半干法转膜,用5%脱脂奶封闭,用TLR-4一抗(1∶1 000稀释)孵育过夜,用TBST洗膜,加入碱性磷酸酶标记二抗(1∶2 000稀释),孵育1 h,TBST洗膜后进行显色。
1.15 数据处理用SPSS 10.0软件进行单因素方差分析(one-way ANOVA),评估试验组之间的差异,并使用Dumcan方法进行多重比较,用GraphPad Prism 7.0软件绘图。
2 结果
2.1 乳腺上皮细胞的形态观察通过组织块法进行细胞分离,培养5 d后,可见有少量成纤维细胞从组织块迁出,呈纺锤形或者星形(图1A),培养11 d左右可见有上皮细胞迁出;通过酶消化组织块法进行细胞分离,在消化培养第3 天可见有极少量的成纤维细胞迁出,第7天可见乳腺上皮细胞呈晕状出现,细胞形态呈多边形,均一良好,排列紧密(图1B);通过酶消化法进行细胞分离,铺板次日可见有细胞贴壁,部分细胞向外延伸呈岛屿状,由于消化下来的细胞为成纤维细胞和上皮细胞,会出现成纤维细胞包围上皮细胞生长的现象(图1C)。

A.成纤维细胞;B.乳腺上皮细胞;C.酶消化法培养的细胞图1 细胞形态观察
2.2 乳腺上皮细胞的纯化以上3种方法均可成功获得乳腺上皮细胞,利用成纤维细胞和乳腺上皮细胞对Trypsin敏感性不同的特点,通过Trypsin消化使成纤维细胞先脱落,去除成纤维细胞,上皮细胞继续贴壁培养,从而达到分离出乳腺上皮细胞的目的。如图2A所示,纯化获得的乳腺上皮细胞形状多为多边形或卵圆形,少数呈短梭形,细胞连接紧密成片,总体呈多边形。由于采取的组织正处在泌乳期,有些区域出现了脂滴空泡(图2B)。1周后可见有些细胞外基质互相连接,出现了“拉网”现象(图2C)。
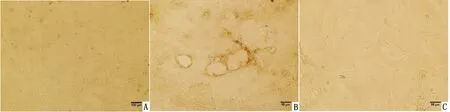
A.纯化的细胞;B.脂滴空泡;C.“拉网”初期图2 纯化的细胞形态
2.3 姬姆萨染色姬姆萨染色显示,乳腺上皮细胞呈多边形,细胞质着色较浅,细胞核大,呈不规则圆形,多数细胞有2~5个核仁,核仁明显,着色较深(图3)。

图3 乳腺上皮细胞的姬姆萨染色
2.4 生长曲线通过3种不同方法所获得细胞的生长曲线见图4,其中组织块法获得的细胞生长速度最快,胶原酶消化结合组织块法培养的细胞生长速度次之,酶消化法获得的细胞生长速度最慢,生长曲线均呈“S”型,符合细胞增殖的生物学规律。从生长曲线上看,前3 d是细胞生长的潜伏期,此阶段的细胞生长速度较慢;第3~6天是对数增长期,该阶段的细胞生长速度很快,传代适合在该阶段进行;第6 天之后进入细胞生长的平台期,细胞开始逐渐老化、凋亡。

图4 3种不同方法所获得细胞的生长曲线
2.5 乳腺上皮细胞的免疫荧光鉴定倒置荧光显微镜下观察发现,细胞核被DAPI染成蓝色,细胞膜上CK-18呈阳性,可见绿色荧光(图5)。

A.细胞核呈现蓝色荧光;B.细胞质呈现绿色荧光;C.细胞核和细胞质荧光叠加图图5 乳腺上皮细胞鉴定
2.6 RT-PCR法检测β-酪蛋白的表达琼脂糖凝胶电泳发现,3种方法获得的细胞均可检测到180 bp 的β-酪蛋白基因条带(图6)。

M.DL2000 DNA Marker;1.酶消化法;2.组织块法;3.酶消化组织块法图6 不同方法获得细胞的β-酪蛋白基因的RT-PCR检测
2.7 LPS最适质量浓度的筛选由表1可知,10 mg/L LPS处理乳腺上皮细胞12 h对乳腺上皮细胞的促生长作用最强。

表1 LPS对乳腺上皮细胞增殖的影响(n=5)
2.8 10 mg/L LPS对乳腺上皮细胞IL-8和TNF-α分泌的影响由表2可知,LPS处理乳腺上皮细胞后12 h,10 mg/L LPS可以显著提高IL-8和TNF-α的分泌量(P<0.01)。
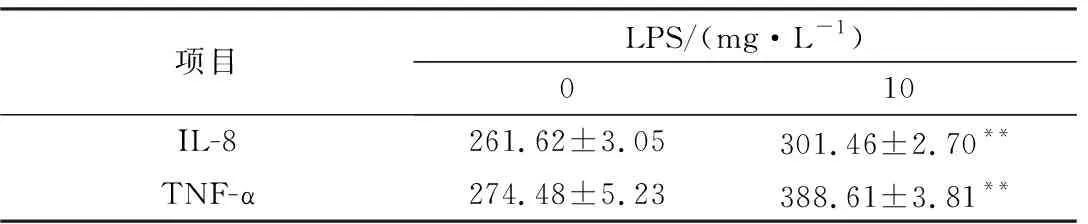
表2 LPS对乳腺上皮细胞IL-8和TNF-α分泌的影响 (n=5) μg/L
2.9 LPS对乳腺上皮细胞TLR-4蛋白表达的影响由图7可知,当LPS质量浓度为10 mg/L时,TLR-4的蛋白表达量最高。

图7 LPS对乳腺上皮细胞TLR-4蛋白表达的影响
3 讨论
目前国内外学者已成功培养出了多种动物的乳腺上皮细胞。培养的方法有组织块法[5]、酶消化法[6]、乳汁分离法[7]、机械破碎法[8]等。本研究分别采用组织块法、胶原酶消化组织块法和酶消化法3种方法对乳腺上皮细胞进行了分离培养。酶消化法是使用Trypsin和胶原酶联合消化后直接获得细胞的方法,此方法用时短,采取的组织腺泡发育越好获得的上皮细胞数目越多,缺点是会掺杂大量成纤维细胞,需要多次纯化,且酶对细胞的损伤大。本研究采用酶消化法获得的细胞中掺杂大量成纤维细胞,经过多次纯化后细胞活力降低,培养至4~5代后细胞会逐渐凋亡,其原因可能是Trypsin消耗过程对细胞的损伤太大,不适合乳腺上皮细胞的分离[9]。组织块法是3种方法中操作最简单的方法,对细胞损伤小,但培养时间长,由于成纤维细胞比上皮细胞先从组织块中迁出[10],导致去除成纤维细胞时会损失部分上皮细胞,因此上皮细胞的收集较难[11-12]。酶消化组织块法是联合两种方法的一种比较新的方法,该方法细胞迁出速度比组织块法快,掺入的成纤维细胞比酶消化法少,而且,由于酶的使用浓度低,所以对细胞造成的损伤也比较小,所获细胞的活性比较好[13]。由于组织块法培养细胞周期长于酶消化组织块法,所以酶消化组织块法是最符合预期的乳腺上皮细胞分离方法。
本研究采用免疫荧光技术对细胞进行了鉴定。角蛋白是细胞骨架的组成成分,是上皮来源的组织标志物,广泛地应用于多种动物乳腺上皮细胞的鉴定[14-15],因而通过免疫荧光法检测角蛋白可以鉴别乳腺上皮细胞。酪蛋白是动物乳汁蛋白的重要组成部分,β-酪蛋白是酪蛋白的主要形式,所以β-酪蛋白可以作为乳腺上皮细胞是否具有泌乳功能的重要指标[7,14-15]。本研究中β-酪蛋白基因在乳腺上皮细胞中的表达呈阳性,说明分离的细胞都具有合成乳蛋白的能力。
多数乳房炎是由革兰阴性菌引起的,LPS位于革兰阴性菌细胞壁的最外层,当菌体受到破坏或者裂解死亡后会释放到周围环境中,引发机体产生炎症反应[16]。田青等[17]研究表明,LPS可以诱导大鼠乳腺上皮产生炎性反应;张驰等[18]也用LPS刺激牛乳腺上皮细胞成功构建了奶牛乳腺上皮细胞炎性模型。TLR-4是LPS激活炎症信号通路的关键受体,当有炎症发生时,TLR-4的蛋白表达量升高[19]。本研究以10 mg/L LPS刺激乳腺上皮细胞12 h后,TLR-4蛋白表达量最高。
将TNF-α和IL-8两种炎症早期分泌的细胞因子作为衡量炎性细胞模型是否构建成功的指标,10 mg/L LPS刺激乳腺上皮细胞后12 h TNF-α和IL-8的表达量显著高于对照组,表明10 mg/L LPS作用12 h是构建乳腺上皮细胞炎性模型的适宜条件。

