托法替布治疗类风湿关节炎肺间质病变的疗效评估
王田玲 崔佳佳 沈芹 杨沅浩 胡怀霞 李慧
江苏省连云港市第二人民医院风湿免疫科 222000
类风湿关节炎(rheumatoid arthritis,RA)是一种临床上常见的自身免疫性疾病,患者主要表现为关节的疼痛、肿胀,病情反复发作、迁延进展,从而导致软骨、骨的破坏,出现关节畸形强直、功能障碍,是临床上较为常见的致残性疾病[1-2]。但临床上RA除累及关节外,也会引起其他脏器损害,数据统计,10%~50%的RA患者可以出现肺间质病变(interstitial lung disease,ILD),类风湿关节炎相关肺间质病变(RA-ILD)是患者生活质量下降、预后不佳的重要原因之一。RA引起ILD的发病机制复杂、不明,大量动物及临床研究表明多种细胞因子[Ⅱ型肺泡细胞表面抗原(KL-6)、白细胞介素(IL)-8、IL-38等]水平的变化在ILD的发病过程中起一定的作用。目前,临床上治疗RA-ILD的主要药物为糖皮质激素,其能通过有效地抑制结缔组织的增生,促进蛋白的分解,缓解患者的临床症状,但由于该药物疗效单一,常不能有效治疗RA-ILD的肺部病变[3-4]。托法替布(tofacitinib)是一种全新的RA口服靶向治疗的新药,可以靶向性地选择抑制Janus激酶(Janus kinase,JAK),阻断其通路,进而从源头上阻断RA患者的炎性反应、病情进展。我们通过在醋酸泼尼松片的基础上加用枸橼酸托法替布治疗RA-ILD,评估临床效果及对血清中KL-6、IL-8、IL-38水平的影响。
1 资料与方法
1.1 一般资料 选择在连云港市第二人民医院初诊100例RA继发的ILD 100例纳入临床研究(就诊时间2018年12月至2020年5月),其中RA的诊断符1987年美国风湿病协会(American College of Rheumatology,ACR)分类标准或美国风湿病协会(American College of Rheumatology,ACR)/欧洲抗风湿病联盟(European League Against Rheumatism,EULAR)2010年修订的RA分类标准。继发ILD的判定标准为:(1)静息或活动后气促,干咳或者听诊肺部Velcro啰音;(2)肺HRCT提示1种或者1种以上肺间质影像学改变,肺功能提示限制性通气功能障碍和(或)弥散功能降低。所有患者或者家属入组前均签订知情同意书。排除标准:(1)合并慢性呼吸道疾病者;(2)尘肺、吸入有机粉尘引起的ILD;(3)明显循环系统功能不全者;(4)近期服用过其他抗风湿药物或糖皮质激素等药物者;(5)不能配合检查者。将入组患者按随机数字表法分成2组:治疗组和对照组,两组患者的一般资料(年龄、性别、病程)经统计学分析差异均无统计学意义(均P>0.05)(表1),具有可比性。本研究通过连云港市第二人民医院医学伦理委员会审批。

表1 两组类风湿关节炎肺间质病变患者一般资料比较
1.2 治疗方案 对照组和治疗组在半年疗程期间均给予吸氧、糖皮质激素等基础治疗,糖皮质激素按醋酸泼尼松片(辰欣药业股份有限公司,国药准字H37021900)1.0 mg/(kg•d)起始,2周后规律减药,至半年后7.5~10.0 mg/d维持治疗;治疗组患者在对照组的基础上加用枸橼酸托法替布片(正大天晴药业集团股份有限公司,国药准字H20193281)5 mg/次,2次/d,本研究总计观察疗程为半年。
1.3 观察指标
1.3.1 ILD症状评分 根据《现代呼吸病治疗学》对于ILD的相关症状如干咳、气短、进行性呼吸困难进行评分[5-6]。
1.3.2 外周血指标 所有入组患者于治疗前、治疗半年后分别抽取外周静脉血5 ml放入无菌试管中,采用全自动血细胞分析仪测定血常规,记录血小板计数(PLT),采用全自动免疫散射速率比浊法检测C反应蛋白(CRP)、类风湿因子(RF),魏氏法检测红细胞沉降率(ESR),酶联免疫吸附法(ELISA)检测血清中KL-6、IL-8、IL-38水平,上述操作均按说明书严格进行。
1.3.3 肺高分辨率CT(HRCT)评分 依据国际上通用积分方法,根据患者HRCT病变受累范围进行评分。0分:正常;1分:累及范围在<25%;2分:累及范围在25%~50%之间;3分:累及范围在51%~75%之间;4分:累及范围>75%。分别由经验丰富的呼吸科专家及放射科专家单独阅片,当遇到争议性案例时再联合阅片,最终商议结果[7]。
1.3.4 肺功能指标 包括用力肺活量(FVC)、第1秒用力呼气容积(FEV1)、FEV1/FVC,其中肺功能检查采用德国Master Screen PFT高级弥散功能仪,治疗前后在规定时间进行。
1.3.5 不良反应 记录恶心、头痛、呕吐、出汗等所有不良反应的发生例数。
1.4 统计学方法 本研究数据采用SPSS 22.0统计软件处理,计数资料以百分率(%)表示,采用χ2检验,计量资料符合正态分布,以均数±标准差(±s)表示,组间比较采用独立样本t检验,组内治疗前后比较采用配对t检验。其中P<0.05为差异有统计学意义。
2 结 果
2.1 ILD症状的比较 半年治疗后治疗组ILD症状评分低于对照组,差异均有统计学意义(均P<0.05),见表2。
表2 两组RA-ILD患者治疗前后ILD症状评分比较(分,±s)
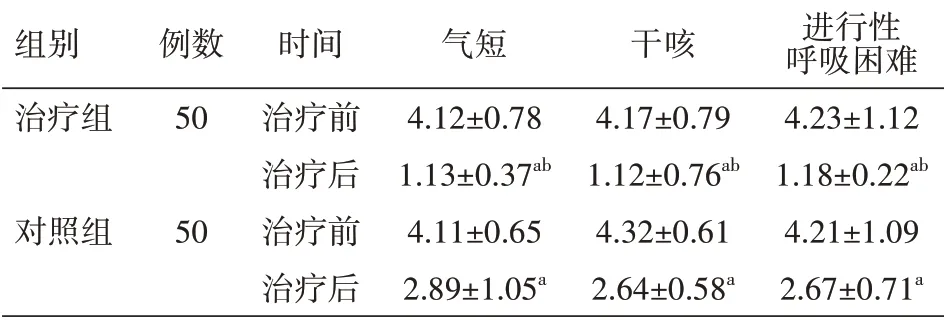
表2 两组RA-ILD患者治疗前后ILD症状评分比较(分,±s)
注:RA为类风湿关节炎,ILD为肺间质病变;对照组给予糖皮质激素治疗,治疗组在此基础上加用枸橼酸托法替布;与本组治疗前比较,a P<0.05;与对照组治疗后比较,b P<0.05
组别治疗组对照组例数50 50时间治疗前治疗后治疗前治疗后气短4.12±0.78 1.13±0.37ab 4.11±0.65 2.89±1.05a干咳4.17±0.79 1.12±0.76ab 4.32±0.61 2.64±0.58a进行性呼吸困难4.23±1.12 1.18±0.22ab 4.21±1.09 2.67±0.71a
2.2 外周血指标、肺HRCT积分比较 治疗后治疗组外周血中PLT、ESR、CRP、RF水平及肺HRCT积分明显低于对照组,差异均有统计学意义(均P<0.05),见表3及图1。
表3 两组RA-ILD患者治疗前后PLT、ESR、CRP、RF、HRCT积分比较(±s)
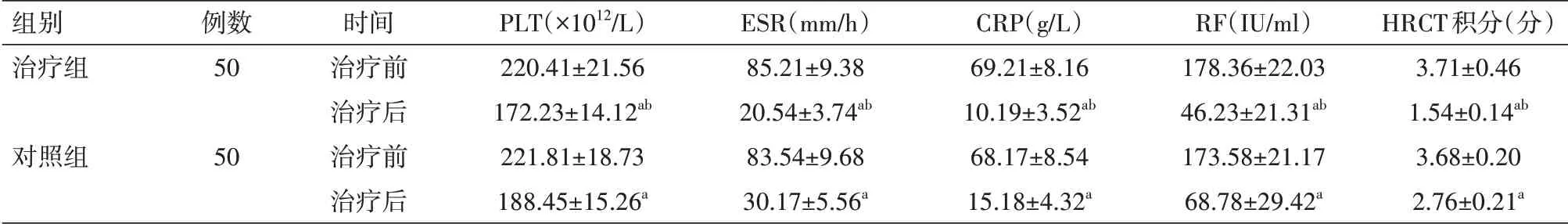
表3 两组RA-ILD患者治疗前后PLT、ESR、CRP、RF、HRCT积分比较(±s)
注:RA为类风湿关节炎,ILD为肺间质病变,PLT为血小板计数,ESR为红细胞沉降率,CRP为C反应蛋白,RF为类风湿因子,HRCT为高分辨率CT;对照组给予糖皮质激素治疗,治疗组在此基础上加用枸橼酸托法替布;与本组治疗前比较,a P<0.05;与对照组治疗后比较,b P<0.05
组别治疗组对照组例数50 50时间治疗前治疗后治疗前治疗后PLT(×1012/L)220.41±21.56 172.23±14.12ab 221.81±18.73 188.45±15.26a ESR(mm/h)85.21±9.38 20.54±3.74ab 83.54±9.68 30.17±5.56a CRP(g/L)69.21±8.16 10.19±3.52ab 68.17±8.54 15.18±4.32a RF(IU/ml)178.36±22.03 46.23±21.31ab 173.58±21.17 68.78±29.42a HRCT积分(分)3.71±0.46 1.54±0.14ab 3.68±0.20 2.76±0.21a

图1 治疗组1例类风湿关节炎肺间质病变患者治疗前后肺高分辨率CT(HRCT)检查结果比较。A:治疗前;B:治疗后
2.3 肺功能比较 治疗前两组肺功能指标差异均无统计学意义(均P>0.05)。治疗后:治疗组FVC(89.34±12.11)L、FEV1(98.12±15.62)L、FEV1/FVC(79.54±2.21)%,对 照 组FVC(80.56±12.12)L、FEV1(88.12±14.27)L、FEV1/FVC(70.03±2.45)%,均较治疗前改善,且治疗组各指标高于对照组,差异均有统计学意义(均P<0.05)。见表4。
表4 两组RA-ILD患者治疗前后FVC、FEV1、FEV1/FVC比较(±s)
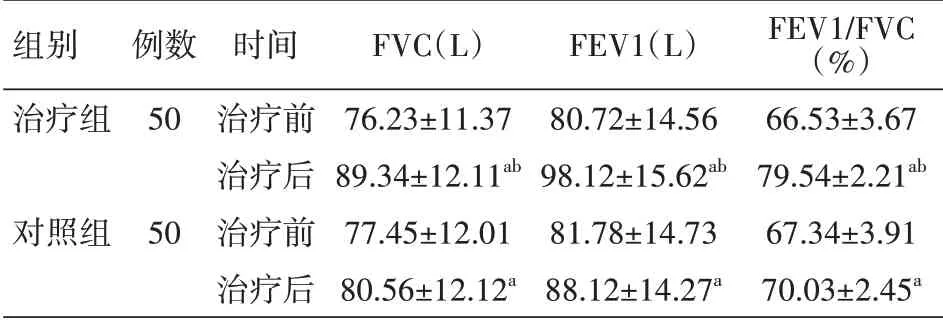
表4 两组RA-ILD患者治疗前后FVC、FEV1、FEV1/FVC比较(±s)
注:RA为类风湿关节炎,ILD为肺间质病变,FVC为用力肺活量,FEV1为第1秒用力呼气容积;对照组给予糖皮质激素治疗,治疗组在此基础上加用枸橼酸托法替布;与本组治疗前比较,a P<0.05;与对照组治疗后比较,b P<0.05
组别治疗组对照组例数50 50时间治疗前治疗后治疗前治疗后FVC(L)76.23±11.37 89.34±12.11ab 77.45±12.01 80.56±12.12a FEV1(L)80.72±14.56 98.12±15.62ab 81.78±14.73 88.12±14.27a FEV1/FVC(%)66.53±3.67 79.54±2.21ab 67.34±3.91 70.03±2.45a
2.4 KL-6、IL-8、IL-38水平比较 治疗后治疗组KL-6(210.82±34.78)U/ml、IL-8(5.12±1.78)ng/L较对照组KL-6(328.17±82.26)U/ml、IL-8(8.23±2.21)ng/L低,IL-38(28.08±1.16)ng/L较对照组(21.45±1.65)ng/L高,差异均有统计学意义(均P<0.05)。见表5。
表5 两组RA-ILD患者治疗前后KL-6、IL-8、IL-38水平比较(±s)
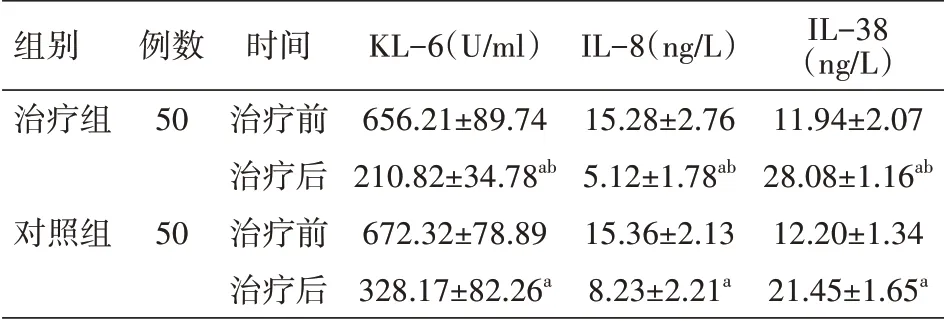
表5 两组RA-ILD患者治疗前后KL-6、IL-8、IL-38水平比较(±s)
注:RA为类风湿关节炎,ILD为肺间质病变,KL-6为Ⅱ型肺泡细胞表面抗原,IL为白细胞介素;对照组给予糖皮质激素治疗,治疗组在此基础上加用枸橼酸托法替布;与本组治疗前比较,a P<0.05;与对照组治疗后比较,b P<0.05
组别治疗组对照组例数50 50时间治疗前治疗后治疗前治疗后KL-6(U/ml)656.21±89.74 210.82±34.78ab 672.32±78.89 328.17±82.26a IL-8(ng/L)15.28±2.76 5.12±1.78ab 15.36±2.13 8.23±2.21a IL-38(ng/L)11.94±2.07 28.08±1.16ab 12.20±1.34 21.45±1.65a
2.5 不良反应 两组患者整个治疗期间均未发生严重肝肾功能损害、消化道出血等严重的不良反应,其中治疗组出现恶心2例、呕吐1例、出汗2例,对照组出现恶心3例、出汗2例、头痛1例,且上述症状经对症处理后均消失或缓解,对整个治疗过程无影响。
3 讨 论
ILD是RA累及肺脏的最常见的表现形式,机制复杂、不明,近几年研究的不断深入表明RA并发ILD是由于变态反应介导的机体免疫反应[8]。因此,目前临床上主要是通过抑制机体自身的免疫反应、阻止各种炎症因子的释放来达到有效阻止ILD疾病进展的目的。而糖皮质激素以其强大的抗炎作用,有效抑制巨噬细胞分泌,一直是风湿免疫科首选阻止ILD进展的治疗手段。但因为糖皮质激素药效单一,导致治疗效果通常是暂时性的且部分患者的疗效也不理想,因此,寻找安全有效的治疗RA-ILD的药物,对缓解临床症状、提高生活质量、改善预后具有重要的临床意义。托法替布作为最新的靶向合成类改变病情的抗风湿药物,其有效成分是化学合成的小分子JAK抑制剂,研究表明,托法替布主要的作用机制是通过抑制肿瘤坏死因子(TNF)和IL-6等细胞因子的产生,显著降低炎性细胞的浸润以及骨的吸收,缓解RA炎症、减少关节损伤。
众所周知,炎症是机体对内源性或外源性损伤的一种反应,在RA的整个发病过程中炎性反应发挥着举足轻重的作用。临床上目前主要通过患者自身症状评价、PLT、ESR、CRP等水平评估疾病严重水平[9-11]。而RF是由感染因子导致体内产生的一种以变性免疫球蛋白G(IgG)为抗原的自身抗体,其指标高低也可以反映RA的严重程度[12]。
对此,本研究通过枸橼酸托法替布联合醋酸泼尼松片治疗RA-ILD的研究中发现,治疗后治疗组和对照组临床检测实验室指标PLT、ESR、CRP、RF水平均较治疗前好转,影像学检查(肺HRCT)及肺功能指标(本研究选用FVC、FEV1、FEV1/FVC)也均较治疗前有所改善,这就进一步说明糖皮质激素对于改善RA-ILD的各项临床指标,降低体内的炎性反应、缓解临床症状具有一定的有效性,但部分患者临床上在糖皮质激素逐渐减量过程中出现症状反复,以及由于过量应用糖皮质激素导致RA患者肺脏感染、股骨头坏死等疾病发生的风险增加。托法替布作为能有效地选择性抑制JAK的JAK抑制剂,通过阻断JAK/STAT信号通路,在RA发病过程中的所有阶段发挥作用,本研究在糖皮质激素的基础上加用枸橼酸托法替布治疗,其结果显示托法替布可以更加明显改善患者各项临床指标(治疗组中PLT、ESR、CRP、RF水平较对照组好转明显),降低肺部HRCT积分、改善肺功能(FVC、FEV1、FEV1/FVC等),从而更加明显改善患者肺组织结构,增强其肺功能、提升肺活量,这进一步说明枸橼酸托法替布能够阻止ILD病情进展,提升生活质量、改善RA患者的预后。
KL-6是由肺泡上皮细胞产生的一种大分子的糖蛋白,主要的生理功能可以促进成纤维细胞的趋化以及抗凋亡的作用,已有研究表明,KL-6在结缔组织病相关肺间质病变(CTD-ILD)患者血清或肺泡灌洗液中的水平是升高的[13],提示KL-6可以促进肺纤维化的形成,加速ILD的病情进展、恶化,且高水平的KL-6可以通过活化转化生长因子(TGF)-β信号通路,严重影响患者肺功能[14]。IL-8属于小分子多肽,在多种免疫细胞或者非免疫细胞刺激因子的作用下都可以产生,而在肺内,IL-8主要来源于巨噬细胞[15],相关研究表明IL-8主要作为趋化因子参与ILD的发病过程。多项研究表明IL-38在多种自身免疫性疾病的发病过程中发挥着重要作用,且孙云晖等[16]的研究表明IL-38具有抑制巨噬细胞产生促炎症细胞因子(TNF-α、IL-8等),从而减缓ILD的发生、发展的作用。本研究通过检测对比治疗前后RA-ILD患者外周血清中KL-6、IL-8、IL-38的水平发现,两组患者在治疗前KL-6、IL-8、IL-38的水平基本相同,而在治疗后KL-6、IL-8水平均较前下降,IL-38的水平上升,且其中治疗组较对照组水平变化更明显,因此,笔者猜测枸橼酸托法替布能够有效抑制RA-ILD病情进展与体内KL-6或IL-8水平的下降亦或者IL-38水平的升高有关,仅检测外周血中三者水平的变化,未能检测肺泡灌洗液或肺组织中各项细胞因子的变化水平也是本研究的不足之处。
除此之外,治疗期间两组患者均有不同程度的不良反应发生,主要为恶心、头痛、出汗、呕吐等,并没有出现消化道出血、严重的肝肾功能损害等严重副作用,上述不良反应经对症处理后均消失或缓解,对整个治疗过程无明显影响,提示托法替布治疗RA-ILD具有良好的安全性。
综上,本研究从影像学、肺功能以及血清学检查3个方面探讨了托法替布对RA-ILD患者的临床疗效,其结果证实托法替布不仅能有效控制RA-ILD患者的疾病活动度,减轻ILD的程度,提高其生活质量,并且具有良好的安全性。
利益冲突:作者已申明文章无相关利益冲突。

