创伤性股骨头坏死miRNA-蛋白组学联合分析△
黄世金,张 颖,韩 超,刘成业,秦崇臻,卢瑶瑶,柴玉娜*
[1.郑州大学第一附属医院,河南郑州 450052;2.河南省洛阳正骨医院(河南省骨科医院)髋部疾病研究治疗中心,河南洛阳 471002;3.河南科技大学第三附属医院洛阳东方医院骨科,河南洛阳 471003;4.郑州大学医学科学院,河南郑州 450052]
创伤性股骨头坏死(trauma-induced osteonecro⁃sis of the femoral head,TIONFH)一般由股骨头颈骨折、髋臼骨折、髋关节脱位等引起。目前认为其主要的影响因素为患者年龄、骨折分型和复位质量。该病预后较差,若无早期干预,则可能导致股骨头结构发生改变及塌陷,导致髋关节疼痛及功能障碍[1]。
成骨细胞和破骨细胞的平衡对于骨形成和骨重构具有关键作用[2,3]。最新研究发现一些非编码RNA及靶向分子对成骨细胞和破骨细胞的生物学功能具有重要的调控作用[4~6]。血液成分是骨细胞生长的重要物质基础,探索TIONFH外周血中特异性微小RNA(miRNA)靶向的蛋白分子,可能为TIONFH的发病机制提供新的证据。
本研究联合miRNA芯片和蛋白质组学技术对TIONFH患者外周血样本中的差异分子进行鉴定,以期筛选出特异性miRNAs调控的差异化蛋白分子,为TIONFH的表观遗传机制提供理论依据。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)年龄在20~55岁之间;(2) 股骨颈骨折经皮空心螺钉内固定术治疗>2年,出现股骨头坏死;(3)符合《成人股骨头坏死诊疗标准专家共识(2012年)》。
排除标准:(1)合并全身性疾病或者关节疾病的患者;(2)随访时间<2年。
1.2 一般资料与标本采集
按照以上纳入和排除标准筛选股骨头坏死患者10人(疾病组),另外选取10例股骨颈骨折非坏死患者(对照组)。本研究已获得医院伦理委员会批准,所有入组患者均签署知情同意书[4,7]。
受试者于空腹状态下抽取肘部静脉血2管,离心取血浆,立即于-80℃保存,分别用于miRNA芯片和蛋白组学的检测。
1.3 特异性miRNAs靶基因预测
前期通过芯片技术筛选并验证出TIONFH血浆中8个显著差异的 miRNAs[7],5个上调的 miRNAs为hsa-miR-93-5p、hsa-miR-7i-5p、hsa-miR-16-2-3p、hsa-miR-320a、hsa-miR-25-3p;3 个下调的miRNAs 为 hsa-miR-122-5p、hsa-miR-4711-3p、hsa-miR-3191-5p。通过miranda microscom以及tar⁃getscan三个数据库预测靶基因,通过维恩分析取三个数据库检索结果的交集。
1.4 蛋白组学分析
蛋白提取和酶解:各样品分别加入裂解液,4℃,2 000 g离心10 min,取上清加入三氯乙酸,静置后4℃,12 000 g离心3 min,用丙酮洗涤后,沉淀用8 M尿素复溶,最后用BCA蛋白试剂盒进行定量。加入胰酶,37℃酶解过夜。胰酶酶解的肽段用Strata X C18除盐后真空冷冻干燥。以0.5 M TEAB溶解肽段,根据TMT试剂盒操作说明标记肽段。
液相色谱-质谱联用分析:肽段用高pH反向HPLC分级。随后肽段合并为18个组分,合并后的组分经真空冷冻干燥。肽段用液相色谱流动相A相溶解后使用EASY-nLC 1000超高效液相系统进行分离。肽段经由超高效液相系统分离后被注入NSI离子源中进行电离然后进质谱进行分析。二级质谱数据使用Maxquant(v1.5.2.8)进行检索。
数据通过R(version 3.6.2)中limma包计算,以P<0.05为差异有统计学意义。
1.5 生物信息学分析
聚类分析:使用分层聚类方法做单边聚类分析,聚类关系使用R语言包gplots中的函数heatmap.2绘制出热图。KEGG通路(Kyoto Encyclopedia of Genes and Genomes Pathway)富集:使用KEGG在线服务工具KAAS对提交的蛋白进行注释,之后通过KEGG mapper将注释过的蛋白匹配入数据库中相应的通路中。通路的富集分析采用KEGG数据库进行,以P<0.05为差异有统计学意义。
1.6 关联分析
根据miRNA反向调控靶基因的规律,将TION⁃FH中上调miRNAs的靶基因与蛋白组学中下调的蛋白进行关联,将下调miRNAs的靶基因与蛋白组学中上调的蛋白进行关联,然后取交集。
2 结 果
2.1 特异性miRNAs的靶基因及KEGG通路
对TIONFH中8个特异性miRNAs进行靶基因预测,结果显示上调miRNAs有609个靶基因,如图1a;下调miRNAs有37个靶基因,如图1b。经过KEGG信号通路富集分析,依据-log10(P value)将富集最显著的前10条信号通路分别展示,如图1c和1d。结果显示,这些靶基因在MAPK、PI3K-Akt等重要的信号通路上显著富集。
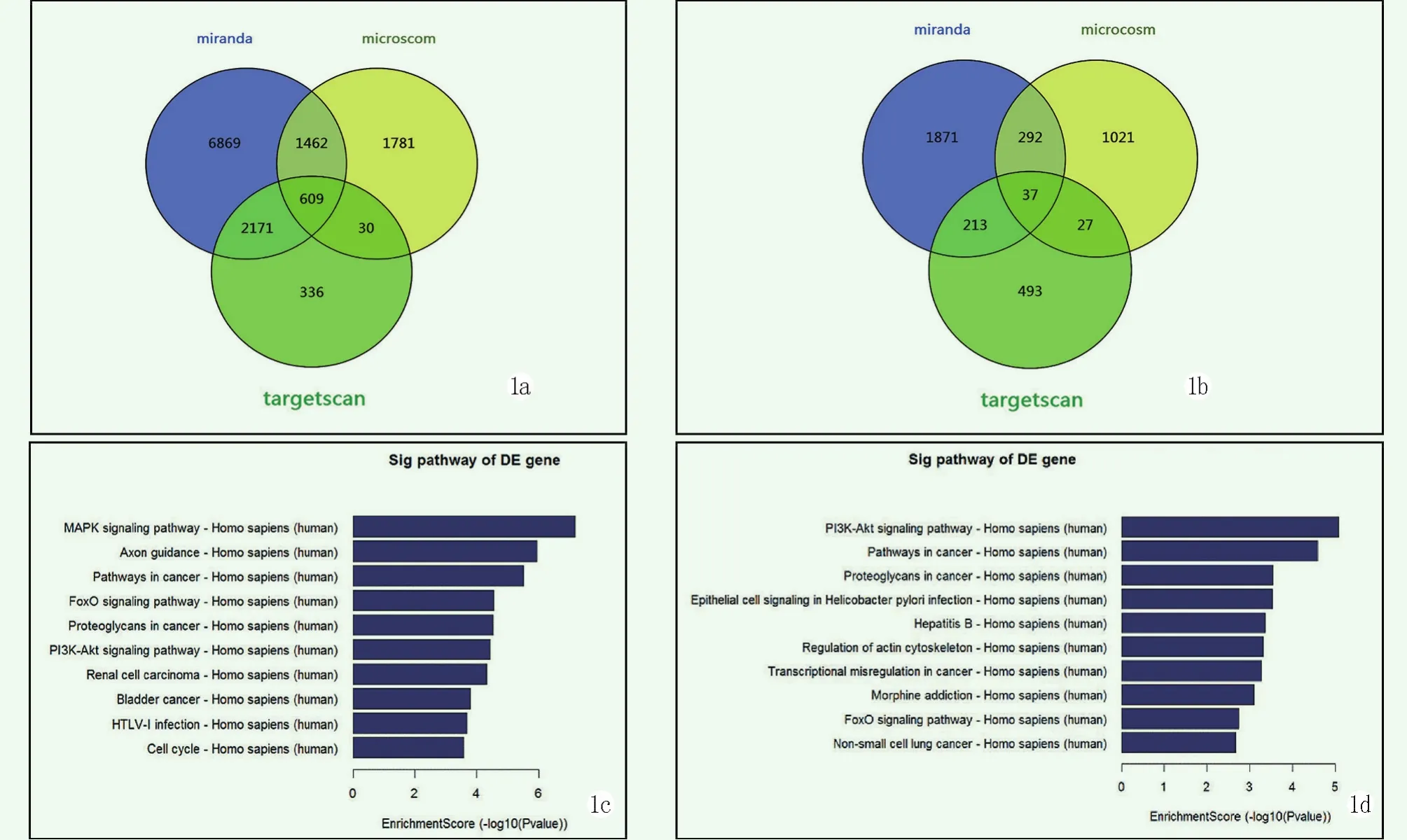
图1 TIONFH血浆特异性miRNAs的靶基因及富集的信号通路 1a:上调miRNAs的靶基因 1b:下调miRNAs的靶基因 1c:上调信号通路 1d:下调信号通路
2.2 蛋白组结果及KEGG通路
在这项研究中共鉴定到905个蛋白,其中652个包含定量信息。如果以P<0.05为标准,检测到差异化表达蛋白115个,其中上调蛋白23个,下调蛋白92个,如图2a。将115个蛋白进行KEGG信号通路富集,发现上调蛋白富集在补体系统等3条信号通路,如图2b;下调蛋白富集在蛋白酶体等11条信号通路,如图2c。

图2 TIONFH血浆蛋白组学分析 2a:115个差异表达的蛋白的聚类图(红色代表富集程度强,蓝色代表富集程度弱)2b:上调信号通路 2c:下调信号通路(Disease:疾病组;Normal:对照组)
2.3 关联分析
将上调的miRNA的靶基因与下调的蛋白数据关联,将下调的miRNA的靶基因与上调的蛋白数据关联,得到22个共性蛋白分子,其中电压依赖性阴离子选择性通道1(voltage-dependent anion-selective channel protein 1,VDAC1)、26S蛋白酶体非ATP酶调控亚基 (26S proteasome non-ATPase regulatory sub⁃unit 14,PSMD14)、膜棕榈酰化蛋白(membrane-pal⁃mitoylated protein 1,MPP1)和磷酸核糖焦磷酸激酶(ribose-phosphate pyrophosphokinase 1,PRPS1) 4个蛋白分子有显著差异。VDAC1受到miR-7i-5p、miR-16-2-3p、miR-320a和miR-93-5p共同靶向调控;PSMD14受到miR-16-2-3p和miR-25-3p共同靶向调控;PRPS1受到miR-7i-5p和miR-320a共同靶向调控;MPP1受到miR-25-3p靶向调控。4个蛋白分子与miRNAs的表达呈反向关系(符合miRNAs对靶向分子的调控规律),如表1。22个共性蛋白参与的信号通路有:破骨细胞分化通路、Wnt信号通路、PI3K-Akt信号通路、蛋白质水解泛素化通路等,如表2。
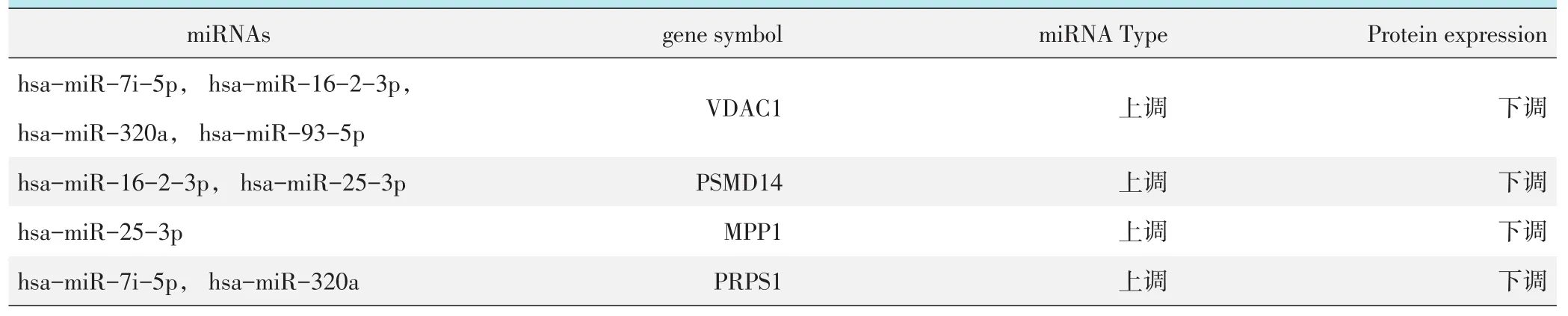
表1 特异性miRNAs靶基因和差异蛋白的关联分析
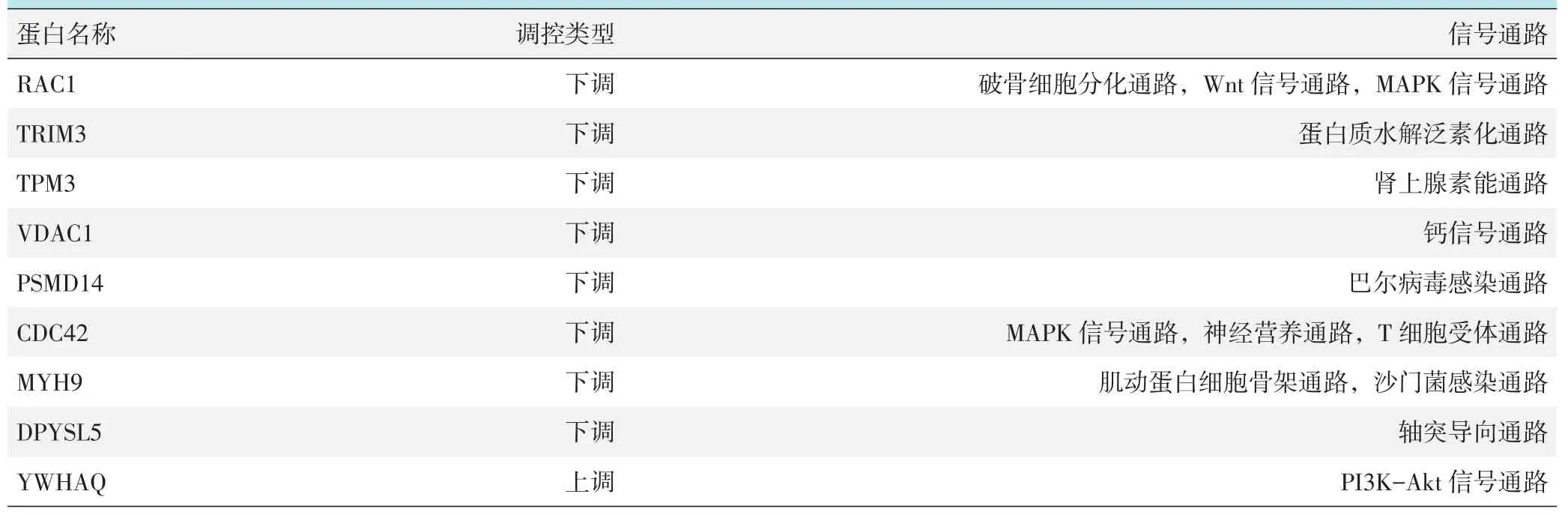
表2 共性蛋白分子及参与的信号通路
3 讨论
研究证明,miRNAs在骨形成和骨重构中有重要作用,它们通过对成骨细胞和破骨细胞关键转录因子的调控发挥表观遗传调控功能[4~6],但是在TION⁃FH中的研究尚不充分。本研究结合前期基于miR⁃NAs芯片技术的研究成果,关联蛋白组学的数据,筛选出特异性8个miRNAs调控的蛋白分子VDAC1、PSMD14、PRPS1和MPP1等,并梳理出相关的重要信号通路,分析结果初步揭示了这些特异性分子在TIONFH中可能的作用。
VDAC1是一种β桶蛋白,在人类中由位于5号染色体上的VDAC1基因编码。在真核细胞中,线粒体负责ATP合成细胞存活所需的其他代谢物,而VDAC1在线粒体外膜和细胞膜中形成离子通道,允许线粒体和细胞之间的通信,从而介导细胞代谢和细胞死亡之间的平衡。高表达VDAC1可使线粒体自噬水平增强,导致NLRP3炎症体的活化被抑制,保护细胞生物学功能不受损害[8]。结合本研究结果VDAC1在TIONFH中血浆的含量显著降低,可以初步推测VDAC1可能在TIOFNH中起保护作用。VDAC1能够通过增加钙离子水平导致线粒体膜电位破坏,从而诱导细胞凋亡[9]。虽然有报道TIONFH的早期发病过程与骨细胞凋亡有关[10],但VDAC1是否参与了TIONFH的细胞凋亡尚需进一步研究证明。关联分析显示,VDAC1是多个miRNAs的靶基因,进一步提示VDAC1在TIONFH中可能与多种非编码RNA的转录调控相关。
PSMD14是一种金属蛋白酶,属于26S蛋白酶体的重要组分。蛋白酶体参与许多细胞过程,包括细胞周期进程、细胞凋亡或DNA损伤修复。PSMD14亚基可以调节特定蛋白质的去泛素化从而来影响其稳定性,进而影响细胞的功能状态[11]。已有报道PSMD14与肿瘤免疫相关[12]。本研究显示该蛋白在TIONFH中含量降低,同时受到hsa-miR-16-2-3p和hsa-miR-25-3p的调控,具体机制有待进一步探明。
PRPS1是核酸合成的重要限速酶,对嘌呤、嘧啶相关的合成、代谢有重要作用,同时能够影响细胞能量代谢。PRPS1基因突变可引起肿瘤对代谢类化疗药物的耐药以及多种临床综合征[13],如听力损失、视网膜营养不良等。近些年逐渐有miRNA调控PRPS1基因转录在疾病中的相关报道[14,15],进一步揭示了PRPS1的相关作用机制。本研究分析显示hsamiR-7i-5p和hsa-miR-320a对PRPS1有调控作用,初步揭示了PRPS1在TIONFH中的转录调控作用。
MPP1是中性粒细胞的调节器,通过调节AKT1的磷酸化来调控中性粒细胞极性从而发挥生物学功能[16]。本研究分析表明:MPP1是hsa-miR-25-3p的靶基因,并且在TIONFH血浆中含量降低。但是该分子的相关报道较少,还需要进一步的探索。
特异性miRNA靶基因和差异蛋白关联分析显示,差异的miRNA调控的蛋白分子参与多条重要信号通路,如破骨细胞分化通路、Wnt信号通路、PI3K-AKT信号通路、MAPK信号通路、钙信号通路等。已知Wnt信号能够调控成骨细胞分化[17],并且在破骨细胞形成中的作用也逐渐被揭示[18];而PI3K-AKT信号通路、MAPK信号通路等亦为股骨头坏死机制研究中的重要通路,已经成为治疗或者干预非创伤性股骨头坏死的切入点[19,20]。这些结果提示,上述信号通路有可能在TIONFH中也有重要作用,值得进一步挖掘验证。
本研究结果显示,特异性miRNAs调控的VDAC1、PSMD14、MPP1、PRPS1等蛋白分子可能参与了TIONFH的发病过程,为TIONFH的表观遗传机制提供了新的信息。但是它们参与TIONFH的具体作用机制还需进一步证明。

