PIWI/piRNA在癌症中的功能和机制
石硕,王晨,林海帆
①上海科技大学 免疫化学研究所,上海 201210;②耶鲁大学医学院 干细胞中心和细胞生物学系,纽黑文,康涅狄格州 06510,美国
1 PIWI/piRNA概述
PIWI蛋白是PAZ/PIWI结构域蛋白质家族(PPD家族)的两个亚家族之一,常与另一亚家族(Argonaute亚家族)统称为Argonaute(Ago)蛋白。所有PPD家族蛋白都高度保守,它们包含一个相对可变的N端结构域、位于中部的PAZ与MID结构域及位于C端的PIWI结构域。PAZ与MID结构域一起结合一个小RNA[1-2](图1a和1b)[3],而C端的PIWI结构域类似于RNase H,有一些PPD蛋白的PIWI结构域可以切割目标RNA[4-6]。Ago亚家族蛋白在大多数细胞中广泛存在,它们结合microRNAs (miRNAs)和小干扰RNA(siRNA)。这两种RNA都是以依赖Dicer的方式由双链RNA前体加工而成的长度为20~22个核苷酸的成熟小RNA[7]。相比之下,PIWI亚家族蛋白主要在生殖系中表达,尽管在大多数节肢动物中,PIWI蛋白也在体细胞系中表达[8-10]。PIWI蛋白结合一类特定的小RNA——piRNA(PIWI-interacting RNA),这类小RNA的长度一般在24~32个核苷酸,也主要在生殖系中表达[11-14]。
在大多数生物体中,piRNA是由长单链前体以非依赖Dicer方式加工而成的(图1c),但线虫除外。在线虫中,piRNA (21 U-RNA)是由短单链前体(约26个核苷酸长度的加帽的转录本)以非依赖Dicer的方式加工而成的[15-16](图1d)[3]。长单链前体RNA是由基因组上称为piRNA簇的位点区域转录并通过乒乓循环路径加工而来的。乒乓循环路径可通过不断促进前体产生,从而以转录后调控的方式扩增有重叠互补的piRNA。前体RNA通过与其结合的PIWI蛋白交替作用从而加速前体的生产[4,11-14,17](图1c)[3]。当PIWI蛋白在起始piRNA的引导下切割互补的靶标转录本,生成具有单磷酸化5'末端的前前体piRNA(prepre-piRNA)时,这一乒乓循环路径就开始了。许多动物的起始piRNA是母源遗传继承来的。由PIWI蛋白和起始piRNA催化切割得到的前前体piRNA的5'端与起始piRNA的5'端序列互补,得到的前前体piRNA会结合到一个新的PIWI蛋白。这个PIWI蛋白会发挥其内切酶的功能切割前前体piRNA,并进一步在3'到5'外切酶的作用下得到应答前体piRNA(responder pre-piRNA)。应答前体piRNA再进一步在3'端发生2'-O-甲基化修饰得到成熟的应答piRNA。应答piRNA的5'端序列与起始piRNA的5'端序列互补。这个应答piRNA再作为新的起始piRNA,引导PIWI蛋白结合到与应答piRNA序列互补的长前体转录本上,PIWI蛋白切割长前体转录本得到新的前前体piRNA。新的前前体piRNA与一个新的PIWI蛋白结合并切割前前体piRNA得到新的前体piRNA,新的前体piRNA在3'端发生外切酶修剪并被2'-O-甲基化修饰后得到新的成熟的piRNA。这个piRNA的序列与乒乓循环通路一开始时的起始piRNA序列一致,这样完成了一轮乒乓循环可以进行再一轮piRNA生产的乒乓循环[18-21]。单磷酸化5'端的前前体piRNA在被加工成应答前体piRNA的同时,也会被PIWI蛋白和线粒体外膜上的PIWI结合蛋白一起分阶段片段化,PIWI蛋白不断上去切割又再上去切割,这样得到一系列连续尾随的piRNA前体(phased trailing pre-RNA)。这些尾随的piRNA前体紧接着被3'端截短和2'-O-甲基化修饰,最终得到一系列多样的尾随的成熟piRNA[22-24](图1c)[3]。很重要的一点是,腺苷蛋氨酸依赖的甲基转移酶会使得piRNA的3'端发生2'-O-甲基化的修饰,这一修饰是piRNA这种小RNA的典型特征[17,25-29]。
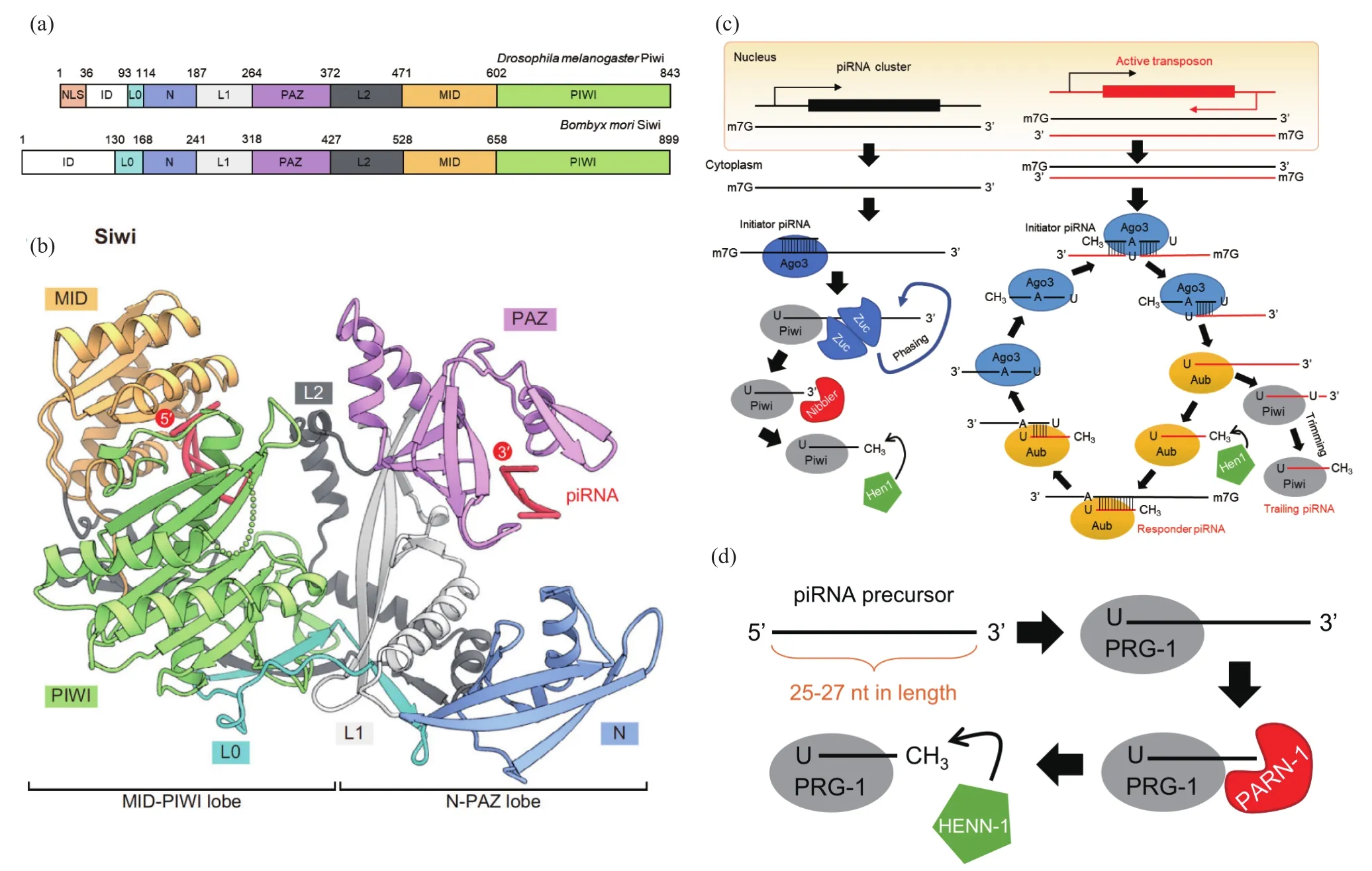
图1 PIWI-piRNA通路概述[3]。(a)果蝇Piwi和蚕Siwi的结构[2,22,79]。Piwi和Siwi高度保守,Piwi和Siwi的氨基酸序列都包含ID、L0、N、L1、PAZ、L2、MID和PIWI这8个区域,其中4个结构域为两者皆有。这4个结构域包括N、PAZ、MID和PIWI结构域,结构域之间被L0、L1、L2序列间隔开。核定位信号(NLS)在PIWI的N端结构域中,使PIWI核定位成为可能。Siwi不含核定位序列NLS,是一种细胞质蛋白。(b)Matsumoto等人解析了第一个Piwi蛋白——Siwi的3D结构[2]。Siwi分为两叶:L0、N、L1、PAZ和L2结构域构成N-PAZ叶,而L0、L2、MID和PIWI结构域构成MID-PIWI叶。这两叶产生一个核酸结合通道。(c)果蝇中piRNA的生成。piRNA前体由piRNA簇转录并从细胞核输出。5'端单磷酸化的piRNA前体被载着起始piRNA的PIWI蛋白所结合,加工成pre-piRNA和pre-pre-piRNA。pre-pre-piRNA由Zucchini内切酶(zucc)进行分阶段切割[22-24],而pre-piRNA由Nibbler蛋白进行修剪[80-81],并经Hen1甲基转移酶对piRNA的3'末端进行2'-O-甲基化的修饰得到成熟的piRNA[25-28]。经过2'-O-甲基化修饰后,成熟的piRNA-Piwi复合物进一步启动由另外两个Piwi蛋白Ago3和Aub促进的乒乓循环式piRNA生成途径[17,29]。(d)线虫piRNA的生成途径[15]。线虫的piRNA前体是长度为25~27 nt的短RNA,经过处理的piRNA前体也被相应的核酸酶修剪和2'-O-甲基化修饰,生成成熟的piRNA(此图来自文献[3])
2 PIWI/piRNA在生殖系中的多面功能
PIWI蛋白最为人熟知和经典的功能就是与piRNA一起参与转座子沉默的调控和生殖发育的调控。在这里我们将简单概述PIWI对转座子沉默的调控。转座子沉默一般通过在转录水平和转录后水平上抑制逆转座子RNA的表达来实现[30]。转录水平上的转座子沉默一般由核内PIWI蛋白来执行,例如果蝇的PIWI和小鼠的MIWI2(即PIWIL4)。转录后水平上调控转座子沉默则一般由细胞质中的PIWI蛋白来执行,例如果蝇中的Aubergine (Aub)和Ago3或小鼠中的MIWI(即PIWIL1)和MILI(即PIWIL2)。已有研究提出了几种关于转录水平上调控转座子沉默的模式,但所有这些调控模式都有两个共同点:一是转录抑制需要PIWI-piRNA复合物与靶点的新生RNA特异性结合,以招募表观遗传/染色质因子,但不需要PIWI的内切酶活性[31-32];二是转录抑制需通过修改染色质结构发生。转录后水平调控的转座子沉默则发生在细胞质中,PIWI-piRNA复合物结合到与piRNA序列互补的转座子RNA上,并通过PIWI蛋白的内切酶活性切割靶向的RNA。这种转座子沉默同时实现了piRNA的生成。
除了研究比较清楚的转座子沉默的调控外,近期有不少出色的研究发现PIWI蛋白还拥有多方面的功能。例如,PIWI-piRNA通路可参与调控生殖系中其他主要类型的RNA的表达,如信使RNA(mRNA)和长链非编码RNA(lncRNA)。此外,PIWI-piRNA通路还调控假基因、亚端粒以及中心粒周围转录本的表达。PIWI-piRNA对mRNA的调控是通过转座子来实现的。已知27.7%的小鼠和28.5%的人类mRNA中包含至少一个逆转录转座子片段。这些片段通常是SINE(short interspersed nuclear element),主要在mRNA的3'UTR中[33],而其他少数片段则在5'UTR中,更少的在蛋白质编码序列CDS(protein-coding sequences)中[34]。最近的研究表明,mRNA中的转座子序列是转座子衍生的piRNA靶向的位点,PIWI-piRNA可通过这些位点结合并降解mRNA。潜藏在mRNA中的转座子序列就像潜藏在特洛伊城中的特洛伊木马一样,最终导致mRNA降解[3,35](图2a)。
以piRNA为靶点的mRNA的切割大多发生在距离靶向piRNA的5'端的第10和第11个核苷酸之间[13,68]。深入分析Tdrd1信使RNA的3'UTR上piRNA靶向的切割位点会发现,大多数piRNA反义对齐mRNA序列,并且mRNA上的切割位点距离piRNA的5'端有10个核苷酸的距离。但也有一些切割位点在距离piRNA的5'端11~20个核苷酸处[35]。在线虫和小鼠中,piRNA与目标RNA的结合依赖于序列,但并不具有完全的序列特异性,2~8位核苷酸为至关重要的种子序列,14~22位核苷酸对piRNA的靶向也很重要[35-38](图2b)。这种识别方式不禁让人想起miRNA的种子序列对靶点的识别。不仅piRNA调控mRNA的表达,研究发现mRNA有时候也可以是产生piRNA的来源。比如在果蝇的卵巢中,整合在活跃转录基因的3'UTR中的转座子可诱导产生piRNA,而产生出来的piRNA又进而抑制相应基因的表达[39-40]。除了比较常见的3'UTR是piRNA经常靶向mRNA的区域之外,也有少量文献报道mRNA的蛋白编码序列CDS也可被piRNA靶向,从而降解被靶向的mRNA。例如,在果蝇胚胎中,Aub以依赖piRNA的方式直接与母源mRNA的CDS和3'UTR结合,从而促进这些母源的mRNA的降解[41-42]。PIWI-piRNA对mRNA的降解除了利用PIWI自身内切酶活性直接参与的方式外,也有研究发现一些别的蛋白复合体也参与转座子衍生的piRNA所介导的mRNA的降解。这些蛋白复合体包括果蝇生殖系中的mRNA去帽复合体(包括DCP1/2、Me31B和PCM蛋白)[43],果蝇胚胎中的Armi、Spn-E、Smg和CCR4这些参与去腺苷化(deadenylation)的蛋白组成的复合体[42],以及小鼠精母细胞中的CCR4-NOT 去腺苷化酶复合体[36]。这些都表明piRNA介导的mRNA降解不仅可以通过MIWI对靶mRNA进行切割,还可以通过对mRNA的同时去腺苷化并可能去帽(decap)来实现。除了对mRNA的降解,PIWI-piRNA复合体还可以对靶向的mRNA进行转录激活[44-48]以及调控靶mRNA在亚细胞中的定位[49]。
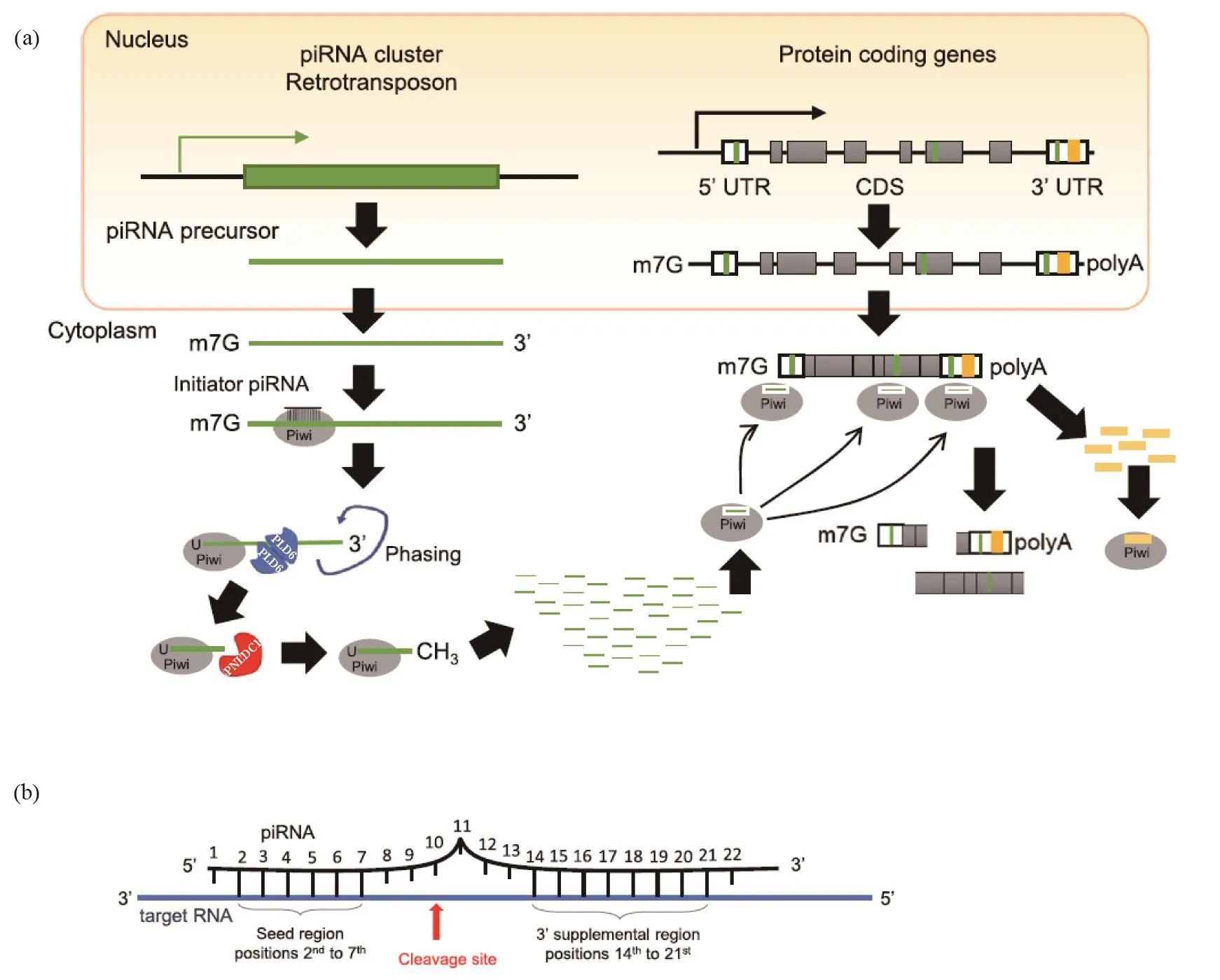
图2 piRNA通过转座子介导mRNA调控[3]。(a)piRNA前体是由包含逆转录转座子序列(绿色框)的piRNA簇转录而来。与Piwi蛋白相结合的成熟的piRNA(绿色短线)将Piwi-piRNA复合物引导到互补转座子序列,该序列主要位于特定的mRNA的3'UTR,偶尔也在mRNA的5'UTR或CDS区域[33-35]。被靶向的mRNA通过PIWI剪切机制和其他调控机制来降解。另外,piRNA由3'UTR中包含转座子序列(橙色框)的mRNA生成。这些piRNA(橙色短线)反过来会靶向相应的mRNA并介导其降解[39-40,82]。(b)以线虫研究为例的piRNA靶向RNA的配对规则。其他生物似乎也遵循类似的规律(此图来自文献[3])
PIWI-piRNA通路还调控长链非编码RNA。近期研究表明,lncRNA中的转座子序列是转座子衍生的piRNA的靶向位点,这些piRNA识别出这些靶向位点从而对lncRNA进行降解。大概而言,PIWI-piRNA复合体切割靶标lncRNA的方式与切割mRNA的方式类似。PIWI-piRNA通路还参与假基因对mRNA的调控。PIWI蛋白通过假基因衍生的piRNA调控与假基因同源的mRNA的表达[34]。卫星重复序列衍生的piRNA可介导PIWI-piRNA通路负向调控mRNA的稳定性,并且这可能是进化上非常保守的一种转录后调控机制。引人注意的是,piRNA甚至参与了调节端粒和着丝粒。端粒和着丝粒的piRNA在多种生物中已有报道。有研究表明piRNA序列可匹配到果蝇基因组的亚端粒区域。从果蝇到哺乳动物,亚端粒区的序列和结构都是高度保守的。亚端粒有许多重要的生物功能,比如抑制和调节邻近常染色质基因的表达等。从亚端粒衍生出的piRNA对端粒的正常功能非常重要。除了端粒区的重复序列可衍生出piRNA外,在果蝇中,着丝粒外周的卫星重复序列也可产生piRNA,并对着丝粒的功能至关重要。比如一项最新的在小鼠中的研究表明,MIWI可通过piRNA引导剪切多余的主要和次要卫星RNA来阻止减数分裂过程中的非整倍体产生[50]。这一调控确保了同源着丝点对的正常组装。如果将这些被MIWI-piRNA剪去的多余的卫星RNA在野生型减数分裂细胞中过表达也会导致非整倍体。这些发现都表明了PIWI蛋白和卫星RNA在减数分裂期间染色体分离中的直接作用。
3 PIWI与piRNA在肿瘤中的表达
充分的研究表明PIWI-piRNA在生殖系中具有非常重要的作用,并展现出“多面手”的网络调控能力。2002年,PIWI蛋白(HIWI:人类PIWI蛋白之一)第一次被发现在人的睾丸精原细胞瘤中异常高表达[51]。至此之后,PIWI的功能研究继发现其在生殖系中强大的功能之后又打开了一扇新的大门。近年来,大量的研究发现在多种不同的肿瘤中PIWI蛋白表现出异常表达。一直以来精准医疗的目标是在不影响正常组织的情况下治愈癌症。人类的PIWI蛋白通常只在生殖细胞中表达,用于生育,而在正常体细胞中几乎不表达,因此,在不同类型的癌症中异常表达的PIWI蛋白为精准医疗提供了一个很有前途的机会。抑制PIWI的表达有望阻止癌症但不影响正常的身体功能。关于PIWI在肿瘤中的表达已有不少综述,这里我们将简单概述PIWI蛋白在不同肿瘤中的表达情况。
人类的PIWI蛋白家族共有4个成员,分别是PIWIL1(HIWI)、PIWIL2(HILI)、PIWIL3和PIWIL4(HIWI2)。人类PIWI蛋白之一的PIWIL1(HIWI)被报道在胃癌、结肠癌、食管癌、软肉瘤、宫颈癌、子宫内膜癌、肝癌、神经胶质瘤、卵巢癌、膀胱癌和肾细胞癌等多种不同类型的癌症中高度表达[52]。在不同癌症中,比如在结肠癌、胃癌、神经胶质瘤、乳腺癌和肾细胞癌中,PIWIL1的表达与病理分期、肿瘤分化程度和肿瘤表型的进展程度密切相关。在食管癌、结肠癌、胃癌、宫颈癌、子宫内膜癌和肾细胞癌中晚期病人肿瘤样本中的PIWIL1的表达要显著高于早期的肿瘤样本。此外,在胃癌、结肠癌、肝癌、乳腺癌、膀胱癌、子宫内膜癌和肾细胞癌中有报道PIWIL1的异常表达与淋巴转移程度呈正相关[10,52-53]。这些发现提示PIWIL1高表达有可能成为多种恶性肿瘤进展程度加剧的标志物。KMplotter数据库的Kaplan-Meier分析也展现出PIWIL1的高表达与乳腺癌、肾细胞癌、直肠腺癌、肉瘤患者以及低分化的胃癌患者的总生存恶化显著相关,提示肿瘤组织中PIWIL1异常表达的鉴定可能有助于癌症诊断和预后评估。PIWIL2(HILI)被报道在神经胶质瘤、宫颈癌、非小细胞肺癌、肾细胞癌、卵巢癌[54]和精原细胞瘤[55]等多种不同类型的癌症中高度表达。其中PIWIL2的高表达与神经胶质瘤和肾细胞癌的预后和生存密切相关。PIWIL3则是在癌症中被报道最少的PIWI蛋白。PIWIL3在胰腺癌[56]、胃癌和多发性骨髓瘤中高表达,但也有一篇文章报道PIWIL3在神经胶质瘤组织中低水平表达,并与胶质瘤的病理分级呈负相关。PIWIL4(HIWI2)被报道在胰腺癌[56]、三阴性乳腺癌[57]、宫颈癌[58]中高表达,并且在肝癌中被报道PIWIL4和PIWIL2共表达的病人预后更差[59]。虽然PIWI蛋白在癌症中的表达被长时间广泛研究且研究的结果令我们欢欣鼓舞,但在一片喝彩的乐观中我们更应该保持谨慎和严谨。不少PIWI在癌症中表达的检测都是基于免疫组化方法。免疫组化的成功与否最重要一点就是取决于抗体的特异性,然而几乎没有文章严格地论证抗体特异性的好坏,缺乏严谨的阳性对照(小鼠睾丸组织)和阴性对照(PIWI敲除细胞)来考察抗体的特异性。事实上很多被广泛使用的商品化抗体,在产品说明书中展示的蛋白免疫印迹图中显示的抗体特异性并不好。这就让我们在使用它们时更需要小心论证得出结论。还有,PIWI在癌症中的高表达的结论是基于qPCR结果,虽然看到qPCR上有相对升高,但是否真的有完整的能被翻译的PIWI的mRNA高表达或者有PIWI蛋白被高表达还需要进一步考证。
除了PIWI蛋白,piRNA也被大量研究和报道其表达和肿瘤的相关性。比如piR-36712、piR-021285和piR-DQ598677这些序列被报道在乳腺癌中高表达,而piR-932被报道在乳腺癌中低表达[60-63]。piR-34871、piR-651和piR-52200被报道在肺癌中高表达,而piR-35127、piR-55490和piR-46545被报道在肺癌中低表达[64-67]。piRFR222326、piR-FR290353、piR-FR064000和piR-FR387750被报道在胃癌中高表达,而piR-823被报道在胃癌中低表达[68-70]。piR-1245、piR-54265、piR-823和piR-015551被报道在结肠癌中高表达[71-73]。除此之外,piRNA还在肝癌、恶性胶质瘤、恶性血液瘤、肾癌、纤维肉瘤、卵巢癌和胰腺等多种癌症中异常高或低表达[53,74]。虽然这么多不同的piRNA序列在不同的癌症中被检查到表达,有的甚至有功能方面的报道,但是这些小RNA序列几乎都是单一的一条一条地被报道表达,没有群体检测这些癌症中piRNA的表达情况,也很少有文章详细地考察生成这些piRNA所必需的蛋白机器的表达情况,如PIWI、TDRD、MEAL、MYB和DDX等经典的piRNA生成通路中的蛋白的表达。此外,在不少肿瘤中报道过的piRNA序列和tRNA来源的小RNA(tRF)的序列非常相似,如有文章回顾了大量已发布的数据库和文献中的各种癌细胞和组织中的小RNA测序,发现精子中tRNA (tRNAGly或tRNA-Glu)衍生出的tRNA小片段和不少已经注释的piRNA的序列几乎一致[75],所以那些被大量报道的体细胞肿瘤中的piRNA的可信度和功能有待进一步好好考证。
4 PIWI与piRNA在肿瘤中的功能
PIWI蛋白在肿瘤中的功能也在多种肿瘤中有过描述,并有报道提出了一些相应的调控机制。PIWI被报道过有促进肿瘤细胞增殖、细胞周期运行、细胞迁移、小鼠体内成瘤和体内转移等促癌的生物学功能,在调控机制方面涉及PIWI的经典功能,主要是表观遗传甲基化调控以及上调一些已知的促癌基因或抑制一些抑癌基因的表达[53,76]。虽然已有的文献向我们展现了PIWI蛋白家族在癌症中强大而多面的促癌生物学功能,但PIWI在癌症表观遗传方面的调控的研究并没有解释PIWI是如何在癌细胞中发挥表观遗传调控的,是否如生殖系一样需要piRNA的介导,转座子的情况是怎么样的也未考察,主要在细胞质中表达分布的PIWIL1蛋白是否也在细胞核中表达,以及如何在细胞核中发挥功能的,这些问题都没有很好地阐明。已有的研究大多并没有确定PIWI是间接还是直接调控了PIWI下游的促癌基因和抑癌基因的表达,或这其中的调节是否有piRNA的介导。总而言之,大多关于PIWI功能和机制的研究论述都未提及piRNA,并没有把PIWI-piRNA作为一个整体去考察,而更多的是将两者割裂开来分别论述其各自的功能,没有明确回答PIWI是通过依赖piRNA还是非依赖piRNA的调控方式来实现这些生物学功能的。直到近期,不约而同地,两个实验室分别在胰腺癌和胃癌中明确了piRNA几乎不表达以及PIWI蛋白的非依赖于piRNA的促癌功能。刘默芳实验室[77]发现PIWIL1在没有piRNA负载的情况下,作为APC/C复合物的共激活物,靶向细胞黏附蛋白Pinin进行降解,部分解释了PIWIL1作为促癌基因促进胰腺导管腺癌(PDAC)转移的作用,并提出了不同于生殖系精子细胞中的PIWI调控机制。在晚期精子细胞中,PIWI蛋白被E3复合体APC/C泛素化和降解,并发现这种PIWI-piRNA机制的适当去除对精子成熟至关重要。在生殖系外的胰腺癌细胞中,PIWIL1的作用从一个底物转变为APC/C复合物的共激活物,进而促进细胞-细胞黏附蛋白Pinin的蛋白水解泛素化,并促进肿瘤转移。林海帆实验室[78]发现在PIWIL1高表达的胃癌细胞中几乎检测不到piRNA的表达,但在此情况下PIWIL1仍可以发挥促进癌细胞生长、周期运行、细胞迁移、癌细胞成瘤和转移等促癌的生物学功能。在胃癌细胞中,PIWIL1很可能通过与UPF1蛋白相结合协同无义mRNA降解通路(NMD)负向调控一些PIWIL1直接结合的抑癌基因的mRNA的表达,从而部分解释了PIWIL1促进胃癌细胞迁移的促癌功能(图3)。该工作从多角度论证了胃癌细胞中是否有piRNA的表达,而且通过结合piRNA能力缺失的PIWIL1突变体在PIWIL1敲除细胞中的一系列回补实验,有力地阐明PIWIL1并不依赖piRNA来调控其下游的促癌和抑癌的靶基因的表达以及调控细胞周期和细胞迁移的运行。在没有piRNA的胃癌细胞中,PIWIL1却依然可以直接结合一些mRNA、lncRNA和假基因转录本并对它们的表达进行调控,这就非常耐人寻味了。同时,该工作也是第一次将PIWI通路和细胞中最重要的RNA调控通路之一的NMD通路进行关联研究,为其他PIWI蛋白在癌症中的调控,也为NMD通路在癌症中的调控机制提供了新的思路。总而言之,近期的这两个工作不约而同地指出了PIWI蛋白不依赖piRNA的调控方式和生物学功能,给一直以来平静的PIWI-piRNA的“湖面”投入一块石子,掀起了一阵波澜。
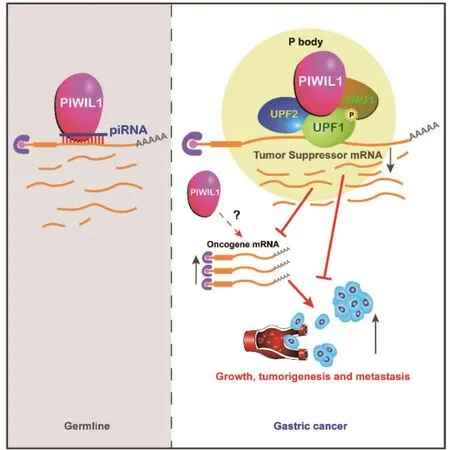
图3 PIWIL1通过不依赖piRNA的调控方式调节胃癌细胞中mRNA的周转(右),与经典的PIWIL1在生殖系细胞质中的作用机制相反,在生殖系细胞质中PIWIL1的靶向作用是由与mRNA序列互补的piRNA引导的(此图来自文献[76])
piRNA在多种肿瘤中的功能也已被提出。piRNA被报道过有调节肿瘤细胞增殖、细胞周期运行、细胞凋亡、细胞迁移和细胞浸润等重要的生物功能。比如在肺癌细胞中piRNA可通过p-ERM、caspase-3、Akt/mTOR等去调控癌细胞的生长、凋亡、迁移和浸润。在结肠癌细胞中,piRNA通过HSF1、BTG1和FAS去调控癌细胞的生长、凋亡和细胞周期运行。在肝癌细胞中,piRNA可通过靶向p-AKT和VEGF通路去调节癌细胞的生长和浸润以及小鼠体内成瘤和体内转移等促癌的生物学功能。正如之前那些关于PIWI在癌症中的研究一样,这些piRNA在肿瘤中的功能和机制的研究也多是把piRNA就简单地当成一条小RNA来研究,而不把PIWI和piRNA综合在一起来考虑。那些研究piRNA的肿瘤细胞有不少在TCGA数据库中可以看到,它们本身PIWI的表达就很低,而且这些被研究的piRNA也没有被证明是真的能结合PIWI,所以很难说这是真的piRNA还是被错误注释的别的小RNA。在探究piRNA如何通过下游靶基因发挥其癌症中的生物学功能时,也很少有研究通过突变piRNA对靶基因的识别序列或是突变PIWI对piRNA的结合序列来论证,的确是piRNA直接参与了这些下游靶基因的调控从而发挥生物学功能。
5 总结和展望
癌症的靶向治疗一直备受关注,寻找到一个好的特异性靶点也一直是大家努力的方向。正因为如此,才使得PIWI,这个生殖系中的“明星分子”成为肿瘤研究的新星。在生殖系中,PIWI向我们展示了它复杂多面的网络调控能力和进化保守的不可或缺的生物学功能。在癌症中,PIWI向我们展示了它在癌组织中特异性表达而在正常组织中几乎不表达的令人振奋的特点,并且随着近年来的不懈研究,PIWI在癌症中的调控机制也越来越清晰,特别是关于非piRNA依赖的PIWI的功能和机制的研究给人意外的惊喜,打开了我们认识PIWI在生殖系外体细胞系统中的功能和机制的新大门。我们需要进一步深入研究PIWI如何通过不依赖piRNA的方式去调控和发挥功能;我们也需要进一步探究是否有新的、不同于传统意义的piRNA的小RNA参与到PIWI在癌症中的调控和功能中;或是有新的PIWI功能拍档蛋白参与到PIWI的调控和功能中去。这些对PIWI在癌症中功能和机制的不断深入的研究最终将为PIWI在癌症精准治疗中的运用提供扎实的理论基础,并为未来的癌症治疗带去希望。

