中介体复合物结构与转录调控机制
张贺桥,聂焱
上海科技大学 免疫化学研究所,上海 201210
1 真核生物转录及中介体复合物
中心法则 (central dogma) 是所有原核和真核生物都遵循的生物学基本法则。中心法则主要指存储着遗传信息的DNA在细胞核内经过转录(transcription)生成信使RNA (messenger RNA,简称mRNA),然后mRNA经核糖体翻译(translation)产生蛋白质的过程。其中,基因转录是最基础的生命活动之一,大致可分为转录起始、转录延伸和转录终止。转录起始是其中最复杂的一步。
原核生物的RNA聚合酶只包含5个亚基,并且转录所需的其他关键组分只有σ因子。真核生物的转录要复杂得多,其转录起始过程需要RNA聚合酶II (RNA polymerase II,简称Pol II)、各种通用转录因子(general transcription factor,简称GTF)以及中介体复合物 (Mediator complex)[1-3]。真核生物转录发生时,转录激活子(transcriptional activator,也被称为基因特异型转录因子(gene-specific transcription factor))会首先结合在携带有转录激活信号的上游增强子(enhancer)区域(也被称为上游激活序列,upstream activation sequence,简称UAS),然后在基因的启动子(promoter) 区域组装成一个极其复杂的超级复合物——转录前起始复合物(preinitiation complex,简称PIC) (图1)[3]。转录前起始复合物包含RNA聚合酶II、各种通用转录因子以及中介体复合物。酵母来源的转录前起始复合物共包含约66种不同的蛋白组分:RNA聚合酶II、通用转录因子 (TFIIA、TFIIB、TBP/TFIID、TFIIE、TFIIF、TFIIH)以及中介体复合物。这些组分各司其职、共同协作,促进转录起始的发生 (图1)。在转录起始发生时,真核生物与原核生物最大的区别在于:负责激活基因转录的转录激活子/基因特异型转录因子在原核生物中直接与核心转录机器——RNA聚合酶结合;在真核生物中,转录激活子/基因特异型转录因子不直接与RNA聚合酶II结合,而是由中介体复合物介导(图1)。换句话说,对于真核生物而言,中介体复合物在转录激活子/基因特异型转录因子和RNA聚合酶II之间起到桥梁的作用。中介体复合物对真核生物所有基因的转录都是必需的,是通用转录机器必不可少的一部分[3-4]。

图1 转录前起始复合物组分示意图(不同组分用不同颜色的形状代表),包含RNA聚合酶II(Pol II)、通用转录因子(TFIIA、TFIIB、TBP、TFIIE、TFIIF、TFIIH)和中介体复合物(Mediator)。此外还展示了作为转录模板的DNA及其上的增强子(enhancer)和启动子(promoter)区域
2 中介体复合物在转录之外的其他功能
近年来,越来越多的证据表明,中介体复合物不仅参与了转录起始,还促进了转录延伸过程[5]。此外,美国麻省理工学院Richard Young研究组发现中介体复合物与黏连蛋白(cohesin)复合物共同介导了染色质的环化。众所周知,染色质高级结构调控对于所有基因的转录都是非常关键的。这是因为作为遗传物质的DNA在细胞内并不是以线性形式存在的,而是先缠绕在组蛋白八聚体上组装形成核小体,然后再继续被层层压缩形成染色质,乃至最后的染色体。近年来的研究发现,染色质会发生环化,进而导致基因的增强子和启动子之间的距离被大大缩短。这种环化被认为是调控基因转录的重要因素,而中介体复合物与黏连蛋白复合物一起协作,直接介导了染色质的环化[6]。此外,中介体复合物在与转录调控有关的相分离过程中可能也发挥着重要作用。2018年《科学》杂志发表的一篇论文表明,中介体复合物可以通过其中部模块中的Med1蛋白上内在无序区域(intrinsically disordered region,简称IDR)与基因特异型转录因子的激活结构域非特异性相互作用,促进转录区域相分离的发生[7]。随着对中介体复合物研究的不断深入,人们越来越认识到其可能作为一个“多面手”,在转录外的多种重要生理过程中发挥着关键调控作用。
3 中介体复合物的发现及组成
中介体复合物的组分高度复杂,在酿酒酵母中共包含21个亚基,在哺乳动物中则包含26个亚基,分子量超过1 MDa (表1)。中介体复合物的发现要追溯到20世纪90年代初,美国斯坦福大学教授Roger Kornberg (2006年诺贝尔化学奖得主)在研究酿酒酵母基因转录过程时发现,过量表达人工改造过的转录激活子VP16-GAL4可以抑制另外一种未知转录激活子的功能[8]。Kornberg教授根据这种现象推测,细胞核内可能存在一种成分,在转录激活子和RNA聚合酶II之间发挥作用。Kornberg实验室随后的研究发现,经过不同的层析柱分离酿酒酵母的细胞上清后,有一种粗提物可以减弱这种转录抑制效应。Kornberg教授把这种在转录激活子和RNA聚合酶II之间起到中介作用的蛋白称为中介体[9]。1994年,Kornberg实验室在酿酒酵母中纯化出了均一的中介体复合物,并首次发现中介体复合物至少包含20种不同的蛋白,且其中少数组分与之前美国麻省理工学院的Richard Young教授经遗传筛选发现的基因产物是重合的。Kornberg实验室还发现,中介体复合物在酵母细胞中也能以与RNA聚合酶II结合的方式存在[10]。自从Kornberg实验室于1994年确切地在酿酒酵母中鉴定出中介体复合物后,果蝇、线虫、高等哺乳动物等来源的中介体复合物也相继被报道出来[11-12]。

表1 酵母、嗜热真菌及人源中介体复合物不同模块亚基组成
早在1999年,Roger Kornberg实验室首次对从酵母以及小鼠细胞纯化到的中介体复合物样品进行负染电镜观察,并挑取少量颗粒进行了二维分类。他们发现酵母和小鼠的中介体复合物整体形状非常相似,呈现出一种类似于光学显微镜的形状[13]。Kornberg实验室把中介体复合物划分为三个模块:头部模块 (head module)、中部模块(middle module)以及尾部模块(tail module)[13]。在酿酒酵母中,头部模块包含Med6、Med8、Med11、Med17、Med18、Med20、Med22亚基,而中部模块包含Med1、Med4、Med7、Med9、Med10、Med19、Med21以及Med31,尾部模块在三个模块中分子量最大,柔性最强,它包含Med2、Med3、Med5、Med15、Med16亚基。而哺乳动物细胞中介体复合物包含一些哺乳动物特异的亚基,它除了包含与酿酒酵母中Med2、Med3、Med5、Med15、Med16对应的Med29、Med27、Med24、Med15和Med16外,还另外编码了Med23、Med25、Med26和Med30等亚基(表1)[14]。一些嗜热真菌的尾部模块不包含Med2和Med3,但是MED15基因编码的蛋白大很多,整体尾部模块分子量达到450 kDa。不管是在酿酒酵母、嗜热真菌还是哺乳动物细胞中,Med14亚基都作为一个骨架成分,将各个模块串联到一起,组装成一个完整的中介体复合物[15]。研究表明:头部模块和中部模块主要负责与RNA聚合酶II结合,而尾部模块直接结合携带有转录激活信号的转录激活子。后续的研究表明:中介体复合物不仅包含这三个模块,还包含一个可解离的CDK8激酶模块(CDK8 kinase module,简称CKM)。CDK8激酶模块包括4个亚基:CDK8、CyclinC、Med12和Med13。其中Med12和Med13蛋白均超过1 500个氨基酸。整个CDK8激酶模块的分子量达到430 kDa[16-17]。
ChIP-seq数据显示,CDK8激酶模块在基因组水平上与中介体复合物分布一致。也就是说,CDK8激酶模块与中介体复合物在细胞内是以更大的复合物形式出现的。体外的生化实验表明:CDK8激酶模块(尤其是在转录起始阶段)可以大大抑制中介体复合物的活性。而CDK8激酶活性对于抑制中介体是否必需,各个研究组报告的结果并不一致。目前普遍认为:当中介体复合物以单独形式存在时,相关基因的转录会被激活;而当中介体复合物与CDK8激酶模块结合时,相关的基因转录活动会被抑制[17]。
4 中介体复合物的结构生物学研究进展
中介体复合物自1994年被首次鉴定后,全世界多个实验室持续对其开展结构和功能研究。首个对中介体复合物的结构生物学研究成果是上文中提及的,Kornberg实验室于1999年发表在《科学》上的低分辨率负染电镜研究结果[13]。在冷冻电镜革命性的时代到来之前[18],针对中介体复合物结构的高分辨率研究仅局限于使用X射线晶体学或者溶液核磁共振的方法解析单个亚基及其结构域,或者含2~3个亚基的亚复合物。例如,德国马克斯·普朗克生物物理化学研究所Patrick Cramer实验室运用X射线晶体学和核磁共振的方法,成功解析了Med7-Med21、Med8-Med18-Med20、Med7-Med31、Med25-VP16、Med11-Med22等一系列亚复合物的高分辨率结构[19-27](图2)。

图2 2020年以前利用X射线晶体学或核磁共振方法解析的中介体部分亚基高分辨率结构
2011—2012年间,美国印第安纳大学Yuichiro Takagi实验室、德国马克斯·普朗克生物物理化学研究所Patrick Cramer实验室以及美国斯坦福大学Roger Kornberg实验室分别独立地解析了来自酿酒酵母或裂殖酵母的中介体复合物头部模块的晶体结构,分辨率分别为4.3 Å、3.4 Å (图3a)和4.5 Å[25,28-29]。尤其值得注意的是,Roger Kornberg实验室解析的头部模块还包含RNA聚合酶II的部分CTD (C-terminal domain)肽段,首次阐明了RNA聚合酶II-CTD与中介体复合物的结合方式[29]。2014年,美国斯克里普斯研究所的Francisco Asturias研究组通过单颗粒冷冻和负染电镜技术,结合MBP (maltose-binding protein)标签融合标记、遗传突变、化学交联等方法,纠正了之前基于低分辨率电镜结构所提出的中介体复合物结构模型(发现头部模块应位于中介体复合物的顶部,而非原先所认为的底部),并大致确定了酵母以及人源中介体复合物各个亚基的位置[14](图3a)。
冷冻电镜革命性的时代到来之后,中介体复合物的结构生物学研究迎来了快速发展。首先在2017年,《自然》杂志先后发表了两篇关于中介体复合物中头部模块-中部模块亚复合物高分辨结构的论文。第一篇论文来自美国斯克里普斯研究所Francisco Asturias研究组,他们用单颗粒冷冻电镜技术解析了头部模块-中部模块亚复合物4.4 Å的近原子分辨率结构,大致厘清了这两个模块中各个亚基之间的相互作用方式[30];第二篇论文来自德国马克斯·普朗克生物物理化学研究所Patrick Cramer实验室,他们经过上千次蛋白重组表达和结晶筛选条件的摸索,成功解析了头部模块-中部模块亚复合物3.4 Å的晶体结构,并对前一篇4.4 Å冷冻电镜的模型进行了纠正,使中介体复合物头部模块和中部模块以及它们的相互作用方式以高分辨率形式呈现在我们面前[31](图3a)。此外,已搬迁至美国科罗拉多大学的Francisco Asturias实验室于2019年和2021年3月先后报道了分辨率为5.9 Å和4.0 Å的小鼠中介体复合物冷冻电镜结构,大致确定了各个亚基的位置(图3b)[32-33]。

图3 (a)已解析的中介体复合物头部模块、中部模块高分辨率结构模型(冷冻电镜、X射线晶体学)及酵母低分辨率完整中介体冷冻电镜结构(右列头部模块晶体结构模型不同亚基用不同颜色表示,左列头部-中部模块结构模型不同亚基用其他不同颜色表示);(b)4.0 Å小鼠来源完整中介体复合物冷冻电镜结构模型
如前所述,中介体复合物最主要的功能有两个:一是结合上游的转录激活子蛋白;二是结合核心转录机器RNA聚合酶II。它的第二个功能主要由头部模块和中部模块完成,而第一个功能则主要由分子量更大、构象更柔性多变的尾部模块完成。有意思的是,作为真核生物的最主要的转录共激活子(co-activator),中介体复合物是几乎所有转录激活子共同的结合目标。而这些结构各异、几乎没有序列和结构同源性的转录激活子在酵母细胞中就有几百种,几乎都可以直接结合中介体复合物的尾部模块,由此可见尾部模块的重要性,同时也能解释它的构象为何需要如此灵活多变。尽管中介体复合物头部模块-中部模块亚复合物的高分辨率冷冻电镜结构以及晶体结构得到解析,但是在2020年之前,关于酵母和哺乳动物细胞中介体复合物尾部模块高分辨率结构生物学的研究一直是空白的。
我们实验室于2021年1月发表在《分子细胞》(Molecular Cell)的工作,集中在研究嗜热毛壳菌(Chaetomium thermophilum)这一嗜热真菌的中介体复合物上。由于传统的酿酒酵母中介体复合物样品柔性较强、均一性较差,国际上多个实验室近30年的研究表明,解析酿酒酵母完整中介体复合物高分辨率冷冻电镜结构非常困难。因此,我们借鉴了Ada Yonath (2009年诺贝尔化学奖得主)选择嗜热细菌来源的核糖体进行X射线晶体学研究,并成功解析得到高分辨率晶体结构的研究经验[34],决定纯化来源于一种嗜热真菌——嗜热毛壳菌的中介体复合物用于结构生物学研究(嗜热毛壳菌是极少数几种能够在50 ℃以上环境中生存的真核生物,最高耐受温度可达到60 ℃)。这是因为相对于来自酿酒酵母和裂殖酵母等中温生物(mesophile)的蛋白质而言,嗜热毛壳菌来源的蛋白质热稳定性更高,所以结构一般更稳定、构象刚性更强,更适合用于结构生物学研究。
我们实验室构建了可以纯化内源中介体复合物的嗜热毛壳菌细胞系,利用融合在Med6亚基羧基端Protein A标签进行纯化。大致步骤为:首先利用穿梭质粒对制备好的嗜热毛壳菌原生质体(protoplast)进行转化,并在固体培养基平板中加入特比萘芬(Terbinafine,一种具有广谱抗真菌活性的丙烯胺类药物)来筛选阳性克隆;随后,通过发酵罐培养以及IgG亲和层析等纯化方法成功获得了毫克级别高纯度的中介体复合物样品,并使用单颗粒冷冻电镜技术成功解析了首个近原子分辨率的完整中介体复合物(6.6 Å)及其与RNA聚合酶II的复合物结构(4.3 Å)。我们据此搭建了迄今为止最完整的中介体复合物原子模型[35]。由于中介体复合物,尤其是尾部模块相对于其他两个模块柔性较大,我们采用冷冻电镜中常见的局部分类(focused classification)方法对尾部模块进行单独处理,使其分辨率提高到了3.6 Å。在尾部模块中:Med5几乎全部由α螺旋组成,位于该模块的最远端;Med16则由氨基端WD40结构域以及羧基端α螺旋型结构域组成,位于该模块中间,连接Med5和Med15;Med5与Med16氨基端的WD40结构域相互堆积,而Med16羧基端α螺旋型结构域与Med15以及Med14的羧基端结构域相互作用[35](图4)。需要指出的是,Med14的羧基端与Med16的α螺旋型结构域和Med15相互堆积在一起,这种相互作用模式被发现在哺乳动物细胞来源的中介体复合物中也是保守的。值得一提的是,Med15是酵母中转录激活子的主要结合靶点,且已经被证明是中介体复合物中柔性最强的亚基之一,核磁共振都不容易捕捉到确定的构象。我们首次解析了Med15包含7个α螺旋的螺旋束结构,确定了Med15在整个中介体复合物中的空间位置,并指出了转录激活子可能的结合位点(activator binding site,图4)[35]。嗜热毛壳菌的Med15亚基包含1 625个氨基酸,我们解析的Med15结构中只能确切地定位不到200个氨基酸,仍有超过1 400多个氨基酸无法被确切定位,说明这些部分是非常灵活的。这些灵活性可能赋予了Med15可以结合多种转录激活子的能力。
另外,通过对比完整中介体复合物及其与RNA聚合酶II的复合物结构,我们发现中介体复合物在结合RNA聚合酶II前后有三处明显的构象变化:尾部模块发生转动;Med1蛋白发生轻微平移;RNA聚合酶II-CTD结合位点处的缺口发生关闭。这些构象变化为阐明中介体复合物与转录激活子的结合方式,及其调控转录前起始复合物转录活性的分子机制提供了重要启示。有意思的是,Med14作为一个骨架成分,连接了中介体尾部模块、中部模块和头部模块,并一直延伸到了中部模块的Hook部位(图4)。由于尾部模块可以直接结合转录激活子,而Hook部位的运动被认为对于组装转录前起始复合物至关重要,因此,中介体复合物很可能在尾部模块接收转录激活子携带的转录激活信号后,在Med14亚基的帮助下,将此信号通过整体构象变化传递给核心转录机器——RNA聚合酶II,激活后续的转录步骤(图5)。当然,更具体的转录信号传递机制还需要进一步的结构生物学、生物化学乃至细胞生物学的工作来验证。
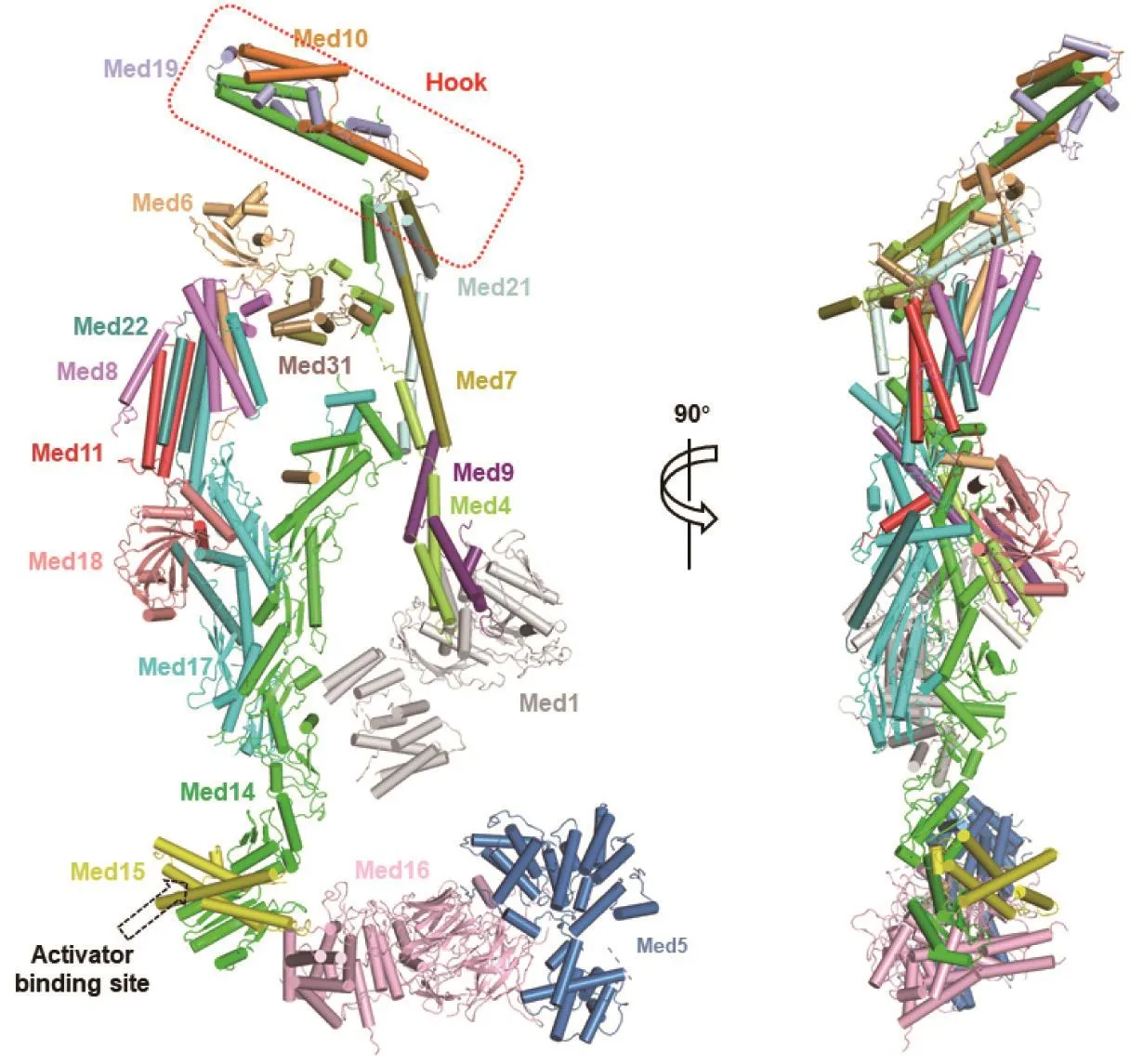
图4 嗜热毛壳菌来源完整中介体复合物近原子分辨率冷冻电镜结构模型

图5 中介体复合物促进转录前起始复合物组装以及激活转录起始过程的可能机制。左图展示了中介体复合物在结合RNA聚合酶II之前的构象(pre-conformation),Med14亚基的位置由图中白色数字“14”标示;中间图显示中介体复合物结合RNA聚合酶II后的过渡构象(intermediate conformation),位于头部模块和中部模块之间的RNA聚合酶II-CTD结合位点处的缺口开始关闭;右图显示最终正确的构象(correct conformation):尾部模块发生转动,Med1蛋白发生轻微平移,RNA聚合酶II-CTD结合位点处的缺口关闭。这些构象变化为解释中介体复合物调控转录起始过程的分子机制提供了重要线索和启示
5 总结和展望
近年来,由于冷冻电镜技术的革命性突破,中介体复合物的结构生物学取得了极大进展。尤其在2021年上半年,来源于嗜热真菌、小鼠和人的单独完整中介体复合物,以及含有中介体复合物的转录前起始复合物的多个高分辨率结构不断被发表出来。包括我们实验室在内的多个实验室,如上文中提到的Francisco Asturias实验室和Patrick Cramer实验室,以及美国西北大学何源实验室和复旦大学徐彦辉实验室,都在该领域取得了重要进展,将我们对于中介体复合物调控真核转录起始过程的认识推到了一个新的高度[36-38]。然而,中介体复合物在转录起始中发挥功能的许多细节仍有待于通过进一步研究来阐明。例如:
(1)目前的模型认为,中介体复合物头部模块Med6和中部模块Med7-Med31之间的距离很关键。距离大,也就是该区域处于开放构象时,是一种有利于结合RNA聚合酶II CTD的状态;而结合了RNA聚合酶II CTD之后,头部模块和中部模块相对距离缩短,随后通用转录因子TFIIH的激酶模块TFIIK对CTD进行磷酸化,促使RNA聚合酶II与中介体复合物解离,发生由转录起始向转录延伸过程的转变。然而,RNA聚合酶II的CTD被磷酸化后如何与中介体复合物发生解离,这一过程的细节尚不清楚。
(2)转录激活子/基因特异型转录因子如何与中介体复合物结合这一更关键的问题还没有明确答案。如前所述,中介体复合物的两个主要功能之一就是结合转录激活子/基因特异型转录因子。然而,直到目前,中介体复合物如何结合这些因子,以及结合之后是否以及如何发生构象变化来传递调控信号给核心转录机器——RNA聚合酶II尚不完全明确。这一过程的详细分子机制还需要更多的结构生物学和生物化学的研究来揭示。
(3)中介体复合物还包含一个可解离的CDK8激酶模块,也有的学者把CDK8激酶模块归为中介体复合物的一部分。研究表明,CDK8激酶模块可以抑制中介体复合物的活性。之前的两项低分辨率负染电镜研究提出了位阻效应,来解释CDK8激酶模块如何通过抑制中介体复合物与RNA聚合酶II之间的相互作用来抑制转录起始过程[16,39]。然而,相关结论是否确切,还需要高分辨率结构生物学及相关功能研究来验证。

