钝齿蟳线粒体基因组全序列测定及系统发育分析
李加爱,陈丽彬,柳斌彬,赵子瑜,俞烈超,尹孟雄,张 莹,龚 理
(浙江海洋大学海洋科学与技术学院,国家海洋设施养殖工程技术研究中心,海洋生物种质发掘与利用国家地方联合实验室,浙江舟山 316022)
绝大多数后生动物的线粒体基因组是一个大小为15~20 kb的双链闭合环状DNA 分子,共编码37 个基因,包括22 个转运RNA (tRNA) 基因、13 个蛋白编码基因(PCGs)和2 个核糖体RNA (rRNA) 基因;此外基因组中还有1 段长的非编码区,称为控制区(control region,CR) 或AT 富集区(AT-rich)[1]。由于线粒体基因组具有结构简单、组成稳定、排列保守、不同基因进化速率各异等特点,加上近年来测序技术的迅猛发展,其已被广泛应用于物种鉴定、群体遗传分化以及系统进化等研究领域[2-4]。
梭子蟹隶属于十足目Decapoda 短尾次目Brachyuran 梭子蟹科Portunidae,主要分布于日本、朝鲜、马来群岛、红海以及我国大陆绝大部分沿海海域。梭子蟹科种类丰富,据WoRMS 网站记载(http://www.marinespecies.org/aphia.php?p=taxdetails&id=106763&allchildren=1),目前该科包括62 属665 种,我国约有60 余种。很多梭子蟹科种类肉质鲜美、营养丰富,具有较高的经济价值,在海洋渔业中占有重要的经济地位,如三疣梭子蟹Portunus trituberculatus、红星梭子蟹P.sanguinolentus、日本蟳Charybdis japonica 和锈斑蟳C.feriata 等[5]。
当前大部分研究都聚焦在梭子蟹的渔业资源、生态习性、生长繁殖及疾病等方面[6-8],而少有研究系统地关注梭子蟹科的进化历程及亲缘关系[9-10]。虽然前期有少量研究揭示了梭子蟹科的系统发育关系,但是它们涉及的种类较少,且多数基于核基因或者线粒体基因片段,包含的有效信息位点十分有限,因而得到的系统进化关系并不一致[11-12]。线粒体基因组全序列为研究不同阶元系统发育关系提供了良好的分子标记,在众多生物类群都得到了广泛的应用[13-15]。钝齿蟳Charybdis hellerii,又名赫氏蟳,俗称石蟳,隶属于梭子蟹科蟳属,分布于印度-西太平洋热带海域,主要生活在潮间带礁岩下及长有水草的积水坑,是我国沿海海域重要的渔业资源组成部分[5]。目前关于该物种分子水平研究甚少,本研究首次测定分析了该物种的线粒体基因组全序列,并结合Genbank 数据库中已经公布的16 种梭子蟹科物种线粒体基因组全序列,构建了目前为止最全面的梭子蟹科系统发育树,以期为进一步探讨十足目的系统发育关系提供理论依据。
1 材料与方法
1.1 样品采集
2018 年8 月于海南陵水新村附近海域(18°24′39.48″ N,109°58′20.60″ E) 采集钝齿蟳作为实验样品,将新鲜样品用95%酒精固定后带回实验室。取肌肉组织用于基因组DNA的提取,多余组织置于-20 ℃冰箱中保存备用。根据形态学特征[5]并辅以NCBI 数据库中线粒体COI 序列(MN184097)鉴定所属种类。
1.2 基因组DNA 提取
取约30 mg的蟹类螯足肌肉剪碎放入离心管,采用SDS/蛋白酶K 裂解、酚-氯仿抽提法提取总DNA,经1.0%的琼脂糖凝胶电泳检测其完整性后,用紫外分光光度计检测DNA 质量与浓度,并稀释为50 ng·μL-1,置于-20 ℃冰箱保存备用。
1.3 引物设计与PCR 扩增
基于三疣梭子蟹和锈斑蟳的线粒体基因组全序列,用Primer-BLAST[16]设计用于扩增钝齿蟳线粒体基因组全序列引物(表1)。在BIO-RAD PCR 仪上进行扩增反应,PCR 反应总体积为44 μL,反应体系及程序如下:Mix 酶(北京溪洋汇智科技有限公司,规格1 mL,浓度2x)20.0 μL,ddH2O 18.0 μL,正反引物各2.0 μL,模板2.0 μL;95 ℃变性30 s,48~54 ℃退火50 s,68 ℃延伸1~3 min (35 个循环),循环前先经过95 ℃预变性3 min,循环后68 ℃继续延伸10 min。采用1%琼脂糖凝胶电泳检测PCR 扩增产物,用凝胶成像系统观察并照相记录。将目的片段的PCR 产物送往生工生物工程(上海)股份有限公司进行双向测序。

表1 钝齿蟳线粒体扩增引物序列Tab.1 Primer pairs for amplification of the complete mitogenome of C.hellerii
1.4 序列拼接、注释及分析
用Codoncode Aligner 5.1.5 (CodonCode Corporation,Dedham,MA) 将各目的序列进行首尾相接,拼接成一个完整的线粒体基因组全序列。拼接完成后通过MITOS Web Server[17]和tRNAscan-SE[18]确定蛋白质基因、tRNA 基因、rRNA 基因以及控制区的大致位置,再用Sequin 软件(version 15.10,http://www.ncbi.nlm.nih.gov/Sequin/) 对线粒体序列进行精准注释;利用CGview serve 软件[19]制作线粒体基因组环形图;利用MEGA X[20]计算基因组碱基组成、氨基酸使用频率及同义密码子相对使用频率。
1.5 系统进化树构建
以红点月神蟹Ashtoret lunaris 和红线黎明蟹Matuta planipes 作为外类群,从GenBank 中下载16 种梭子蟹科线粒体基因组全序列,结合本实验测定的钝齿蟳线粒体基因组全序列(表2),基于13 种蛋白编码基因的核苷酸序列进行系统发育分析。使用PhyloSuite[21]筛选以上所有物种13 个蛋白编码基因,分别用IQTREE[22]和MrBayes 3.2.6[23]构建梭子蟹科最大似然树(ML)和贝叶斯树(BI),探究梭子蟹科系统进化关系。

表2 建树所用物种线粒体基因组信息Tab.2 List of 17 Portunidae species and two outgroup used in this paper
2 结果与分析
2.1 线粒体基因组组成及其特征
钝齿蟳的线粒体基因组(Genbank 登录号MW228889)全长为15 910 bp,包含13 个蛋白编码基因,22个tRNA 基因,2 个rRNA 基因和1 个控制区(CR)。除了8 个tRNA 基因(tRNA-His、Phe、Pro、Leu1、Val、Gln、Cys、Tyr)、4 个蛋白编码基因(ND5、ND4、ND4L、ND1)和2 个rRNA 基因由轻链(L 链)编码外,其它所有基因都由重链(H 链)编码(图1,表3)。钝齿蟳线粒体基因组的碱基组成为:A(33.8%)、T(36.4%)、G(11.1%)、C(18.7%),表现出明显的AT 偏向性(70.2%)。AT-skew 和GC-skew 均为负值,分别为-0.037 和-0.255(表4)。

表4 钝齿蟳线粒体基因组核苷酸组成比例Tab.4 Composition and skewness in the mitogenome of C.hellerii
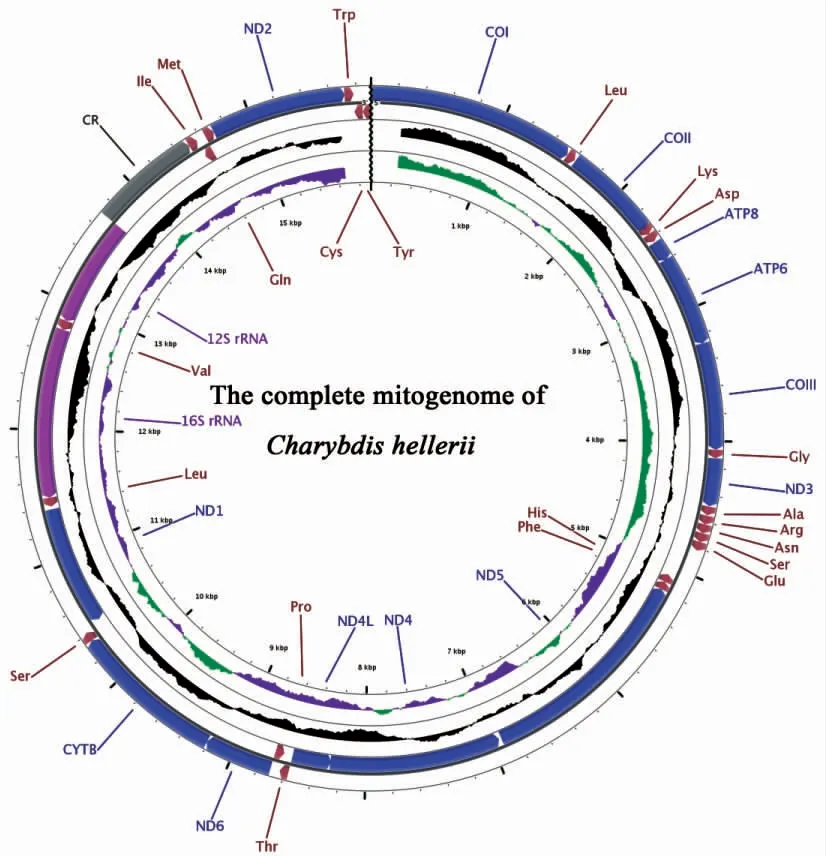
图1 钝齿蟳线粒体基因组基因环形图Fig.1 Gene map of the C.hellerii mitogenome
钝齿蟳线粒体基因组不同基因排列比较紧密,基因组中存在8 处共20 bp的重叠区,其中有4 处重叠基因在后生动物线粒体基因组中较为常见:ATP6 与ATP8 之间、ATP8 与COIII 之间、ND4L 与ND4 之间以及ND6 与Cyt b 之间分别存在4 bp、1 bp、7 bp 及1 bp的重叠。虽然基因组整体上排列紧凑,但是在钝齿蟳线粒体基因组中也发现了12 处,共354 bp的基因间隔,最长的间隔长达246 bp,位于tRNA-His 和tRNA-Phe 之间;最短的基因间隔为2 bp,存在于多个位置(表3)。
2.2 蛋白质编码基因
钝齿蟳线粒体基因组中13 个蛋白基因的总长为11 148 bp,共编码3 722 个氨基酸。起始与终止密码子使用情况显示,所有蛋白质编码基因均以ATN 作为起始密码子;除了3 个蛋白编码基因(COII、COIII 和Cyt b)使用不完全终止密码子T 外,其余蛋白编码基因均以TAG 或TAA 作为终止密码子(表3)。氨基酸使用频率结果显示亮氨酸(Leu)是最常用的氨基酸,占总数的17.37%,其次是苯丙氨酸(Phe),占总数的9.15%,而精氨酸(Arg)是使用频率最低的氨基酸,仅占1.18%(图2A)。此外,蛋白编码基因的相对同义密码子使用频率(RSCU)显示密码子UUU(苯丙氨酸)使用次数最多(239 次),其次是密码子UUA(亮氨酸)(233 次),而密码子ACG(苏氨酸)的使用次数最少,仅有4 次(图2B,表5)。钝齿蟳蛋白编码基因使用频率较高的密码子第3 位偏好使用A 和U,与一些短尾派蟹类相似[9,39-40]。

表5 钝齿蟳线粒体基因组相对同义密码子使用频率(RSCU)Tab.5 The relative synonymous codon usage (RSCU) in the mitogenome of C.hellerii

图2 钝齿蟳线粒体基因组氨基酸使用情况(A)及相对同义密码子使用频率(B)Fig.2 The frequency of amino acid (A) and relative synonymous codon usage (RSCU) (B) in the mitogenome of C.hellerii

表3 钝齿蟳线粒体基因组特征Tab.3 Features of the mitochondrial genome of C.hellerii
2.3 转运RNA(tRNA)、核糖体RNA(rRNA)和控制区(CR)
钝齿蟳线粒体基因组的22 个tRNA 中,14 个由重链编码,其余8 个由轻链编码,长度在63(His)-73 bp(Val)之间。除tRNA-Ser1和Thr 外,其余所有tRNA 都能形成典型的三叶草结构(图3)。tRNA-Ser1缺失二氢尿嘧啶臂(DHU 臂),tRNA-Thr 不能形成TΨ 环;前者在后生动物线粒体基因组中很常见[41],而后者却比较少见。此外,钝齿蟳线粒体基因组的22 个tRNA 中共有4 种碱基错配类型,即tRNA-His、Gln 和Met 中各有1 处U-U 错配,tRNA-Lys、Ser2和Cys 中分别有1 处C-U 错配、C-A 错配和A-A 错配,这些碱基错配现象在后生动物线粒体tRNA 基因中也很常见[9,10,40]。
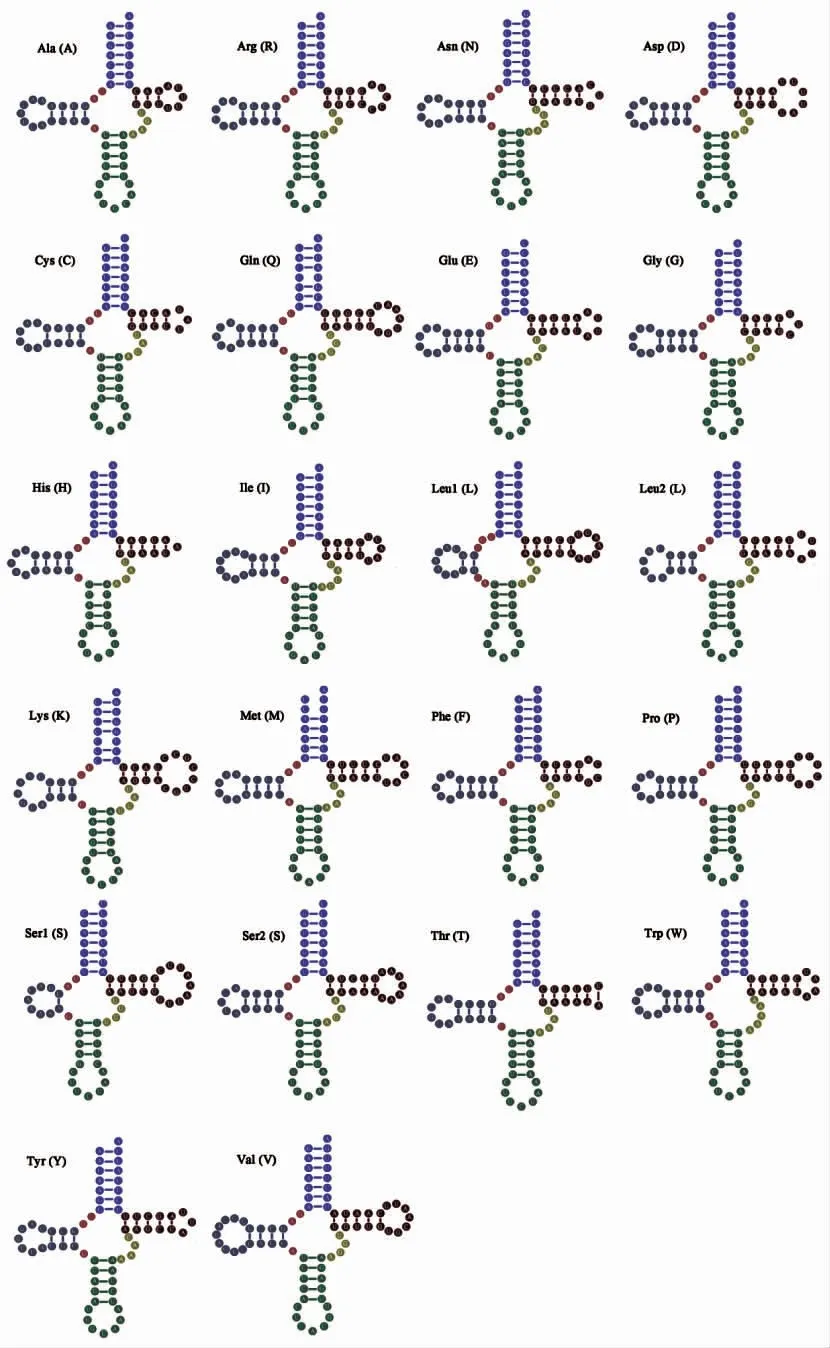
图3 钝齿蟳线粒体基因组22 个tRNA 二级结构预测图Fig.3 Secondary structures of the 22 transfer RNA genes in the mitogenome of C.hellerii
钝齿蟳线粒体基因组包含2 个rRNA 基因,16S rRNA 和12S rRNA。其中16S rRNA 位于tRNA-Leu1与Val 之间,长度为1 321 bp,12S rRNA 位于tRNA-Val 与控制区之间,长836 bp。两者AT 含量高达73.2%,AT-skew 和GC-skew 分别为0.027 和-0.298。12S rRNA的下游是一段长达802 bp的非编码区,即控制区(CR),它跟其它后生动物线粒体控制区一样,表现出明显的AT 偏向性(76.3%)。AT-skew 和GCskew 分别为-0.042 和0.347。控制区是线粒体基因组中进化速率最快的区域,其序列变异程度也最高。本研究比较分析了17 种梭子蟹科的控制区序列,结果发现梭子蟹科控制区几乎不存在明显的保守序列块。
2.4 系统进化分析
本研究基于13 个蛋白编码基因的核苷酸序列,以红点月神蟹和红线黎明蟹为外类群,同时构建了梭子蟹科的最大似然树(ML)和贝叶斯树(BI)。除了分支节点支持率略有区别,2 种方法构建的系统发育树几乎完全一致。系统树显示所有蟳属和青蟹属Scylla 物种分别聚为1 支,各形成1 个单系群;蟳属物种与短桨蟹属Thalamita 有着较近的亲缘关系;钝齿蟳与日本蟳亲缘关系最近。值得注意的是,梭子蟹属Portunus物种并不是聚为一支形成单系群,而是分为2 支,一支由红星梭子蟹、远海梭子蟹Portunus pelagicus 和三疣梭子蟹3 个物种组成,另一支则由纤手梭子蟹P.gracilimanus 单个物种组成(图4)。

图4 基于13 个蛋白编码基因构建的梭子蟹科最大似然树(ML)和贝叶斯树(BI)Fig.4 Phylogenetic tree of Portunidae species inferred from the 13 PCGs based on Bayesian inference (BI) and maximum likelihood (ML) analysis.
3 讨论
很多梭子蟹种类是世界海产大型经济蟹类,是沿海渔业重要组成部分;同时梭子蟹科种类在海洋生态系统中也占有十分重要的角色[5,12]。因此,加强对梭子蟹种类鉴定、群体遗传结构及系统发育等相关研究,以期为梭子蟹种质资源保存、挖掘利用及可持续发展提供理论基础显得尤为必要。
早期研究蟹类分类主要依靠经典的形态学方法,由于形态分类具有一定的主观性且受环境因素的影响,因此在蟹类分类及系统发育研究中很可能得到不一致的结论。近年来随着分子生物学的发展,尤其是测序技术的迅猛发展,基于分子标记的种类鉴定及系统发育有效地弥补了传统形态学方法的不足,已在分类和系统学的研究上解决了很多长期以有争议的问题[2,42-43]。但是由于当前有关梭子蟹科的研究主要集中在少数经济种类的养殖或群体遗传结构上[44-45],很少有关于梭子蟹科系统发育的报道;且多数研究是基于单个或少数线粒体或核基因片段,或者涉及的种类较少[11-12],关于梭子蟹科系统发育关系尚未得到较全面系统的结论。
线粒体基因组全序列为研究不同阶元系统发育关系提供了良好的分子标记,在众多生物类群都得到了广泛的应用[13-15]。本研究基于线粒体13 个蛋白编码基因序列首次构建了梭子蟹科系统发育关系,涉及6属17 个物种,这是迄今为止最全面的梭子蟹科分子系统发育树。系统发育树显示,蟳属与短桨蟹属亲缘关系最近,两者聚支后再与梭子蟹属相聚,然后再与Monomia 属和青蟹属Scylla 相聚。该研究结果与当前绝大多数基于线粒体基因组全序列构建的系统发育关系一致[10,46-47],但是与吴惠仙等[11]基于12S rRNA 序列构建的梭子蟹亚科Portuninae 系统关系略有区别,虽然其ML 树也显示蟳属与短浆蟹属亲缘关系最近,但是两者相聚后先与青蟹属相聚,然后再与梭子蟹属相聚;而BI 树则显示青蟹属与梭子蟹属亲缘关系较近,两者相聚后再先短浆蟹属相聚,然后再与蟳属相聚。虽然还有其它关于梭子蟹科系统发育的研究,但是绝大多数都是基于少量线粒体片段(如COI、Cyt b 和16S rRNA 等)或核糖体序列(如18S rRNA),且涉及的物种数较少,因此难以得到准确一致的结果[11,12,48]。
我国早期形态学家戴爱云等[5]基于纤手梭子蟹头胸甲具有成群的颗粒,螯足掌节明显比长节纤细以及游泳节长节后缘有刺等特征,将其归于梭子蟹属,但是本研究及近期分子研究结果均显示纤手梭子蟹并不与梭子蟹属其它种类聚在一起,而其它梭子蟹属物种则聚为一支,从分子水平支持纤手梭子蟹不应该归属于梭子蟹属[10,36]。因此,关于梭子蟹科是否是单系群,需要包括更多的物种才能定论。

