pH 急性胁迫对棘胸蛙蝌蚪行为、尾部皮肤色差及耗氧率、排氨率和窒息点的影响
刘哲宇,申屠琰,杨 程,朱卫东,王志铮
(1.浙江海洋大学水产学院,舟山 316022;2.余姚市水产技术推广中心,余姚 315400)
就养殖生产而言,养殖生物实质上就是一台以维系存活并促进其生长为主要运动方式的“产肉机器”,其对养殖环境的感应与适应在宏观水平上常通过对其行为、体色、呼吸、排泄等的调节来反映或体现。pH既是水生动物最敏感的环境因子之一[1],也是评价养殖水环境优劣的必检项[2]。因水生生物的光合作用和呼吸活动,池塘水体pH 常波动于6.6~10.2 之间[3-4],故池养水产动物常处于pH 胁迫状态。研究表明,养殖水体易变的pH,不仅可直接影响水生动物的载氧能力并麻痹其呼吸中枢,而且还可通过影响水中物质的存在形式和迁移过程间接毒害水生动物,从而导致机体出现多种损伤症状[5-6]。因此,探究并确定目标养殖对象适宜的水环境pH 范围一直是水产养殖动物生理生态学研究的常规命题之一。棘胸蛙Quasipaa spinosa 素有“百蛙之王”之美誉,是一种我国南方丘陵山区极具养殖开发潜力的特有经济蛙种。为切实弄清棘胸蛙蝌蚪期养殖水体的适宜pH 范围,本文作者在探究该蛙蝌蚪尾部皮肤和肝脏对养殖水体pH 抗氧化应答特征的同时[7],较系统开展了pH 急性胁迫对该蛙蝌蚪行为、尾部皮肤色差及耗氧率、排氨率和窒息点的影响研究,旨为该蛙蝌蚪的平原化安全高效培育提供科学依据。
1 材料与方法
1.1 材料
本研究所用棘胸蛙蝌蚪的来源、实验前驯养处理和实验个体的选择要求与规格,以及实验水源和实验用水的pH 配置方法均完全同刘哲宇等[7]。
1.2 方法
1.2.1 蝌蚪行为及尾部皮肤色差值的观测
以直径32 cm的塑料盆为实验容器单元(实验实际容积为5 L),以2 000 ind·m-3为蝌蚪实验密度,以96 h 为实验周期,设置5.5、6.5、7、7.5、8.5 和9.5 等6 个pH 处理梯度(每一梯度设3 个重复),完全按朱卫东等[8]的方法观察并统计蝌蚪水层分布、集群状况及个体移动率,并于实验终了时刻测定各pH 处理梯度组实验蝌蚪(每一梯度各任测5 ind)尾部皮肤黑、白斑的表观色泽。
1.2.2 蝌蚪耗氧率、排氨率的测定
以直径32 cm的塑料盆为实验容器单元(实验实际容积为5 L),以2 000 ind·m-3为蝌蚪实验密度,以24 h为实验周期,设置5.5、6.5、7、7.5、8.5 和9.5 等6 个pH 处理梯度(每一梯度设3 个重复),按杨程等[9]的方法,以凌晨2:00 为实验起始时点,测算各pH 处理梯度组的OR (耗氧率)、NR (排氨率) 和O:N (氧氮比)。
1.2.3 蝌蚪窒息点的测定
以容量为500 mL的容量瓶(实验实际容积为50 mL)为呼吸室,设置5.5、6.5、7、7.5、8.5 和9.5 等6 个pH 处理梯度(每一梯度设3 个重复,每个重复均放入实验蝌蚪4 ind),将蝌蚪置于对应实验pH 处理组的呼吸室后即刻开始实验,并按杨程等[9]的方法测定各pH 处理梯度组的窒息点。
1.3 数据处理使用
2 结果
2.1 行为
观察发现,棘胸蛙蝌蚪的活动区域、需氧压力和运动频率均与其所处水环境pH 存在密切关联,主要表现为:(1)实验期间,pH 5.5~6.5 实验组的蝌蚪散游于水体近表面,pH 7.0 和9.5 实验组的蝌蚪散布于整个水体,均可见浮头现象,而pH 7.5~8.5 实验组蝌蚪则集群游动于整个水体,且未见有浮头现象;(2) pH 5.5~7.0实验组蝌蚪的移动频率明显高于其它实验组。综上可知,就分布格局、集群行为、需氧压力和移动频率观,棘胸蛙蝌蚪偏好弱碱性环境,其适宜pH 范围为7.5~8.5。
2.2 尾部皮肤色差
由表1 可见,尽管棘胸蛙蝌蚪尾部皮肤黑、白斑的表观色泽A、B 值均无组间差异(P>0.05),但其L 值却与所处水环境pH 存在密切关联,主要表现为:(1)黑、白斑L 值均以pH 5.5 和6.5 两实验组为最大(P<0.05),pH 8.5 实验组为最小(P<0.05);(2)pH 7.5 和9.5 两实验组的黑、白斑L 值均无组间差异(P<0.05),且均显著小于pH 7.0 实验组(P<0.05)。综上可知,用于表征尾部皮肤亮度的L 值呈酸性环境>中性环境>碱性环境(P<0.05),对pH 环境具指示作用,以pH 8.5 为最低(P<0.05)。
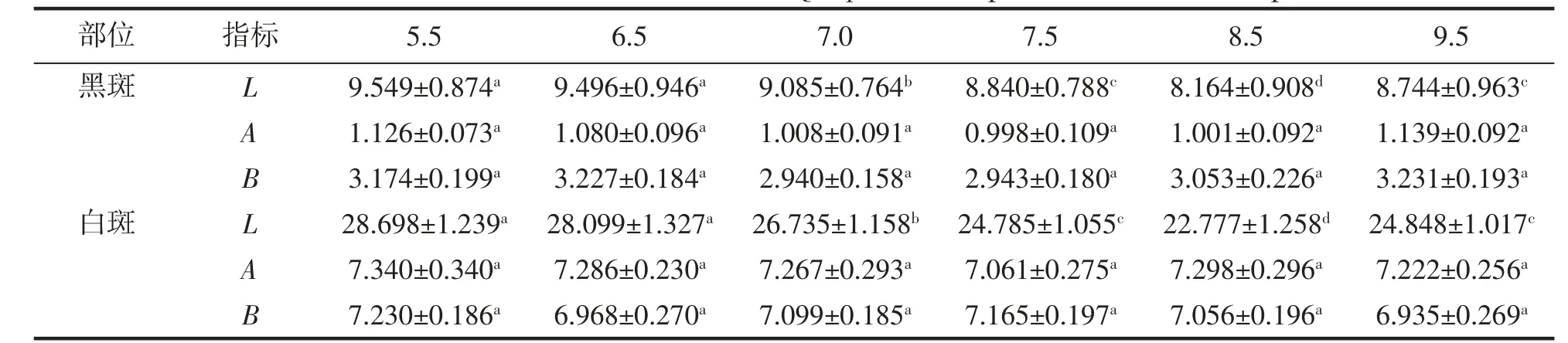
表1 不同pH 条件下棘胸蛙蝌蚪尾部表观色泽的L、A、B 值Tab.1 The Hunter L,A,B values of Q.spinosa tadpole tail in different pH
2.2 OR(耗氧率)
由图1 可见,pH 对蝌蚪OR的影响主要表现为:(1)从时段OR 看,碱性环境下的OR 较酸性和中性环境高。其中,pH 5.5 与6.5 实验组间存在显著差异的时段仅为06:00-10:00,两者间的时段相似性达83.3%,而其与其它实验组的相似性则均为0;pH 6.5 与7.0 实验组间的时段相似性为100%,两者与pH 7.5 实验组间的相似性分别为16.7%和33.3%,与pH 8.5 实验组间的相似性分别为33.3%和50%,而与pH 9.5 实验组间的相似性则分别为50%和67.7%;pH 7.5 与8.5 实验组间以及pH 8.5 与9.5 实验组间的时段相似性均为100%,而pH 7.5 与9.5 实验组间的时段相似性则降为83.3%,表明本研究所涉碱性环境与酸性和中性环境间时段OR 差异最大的为pH 7.5 实验组,而与pH 7.5 实验组时段OR 最为接近的则为pH 8.5实验组;(2)从昼均、夜均和日均OR 看,各实验组均呈夜均>昼均≈日均(P<0.05),与所涉酸性和中性范围内类似,碱性范围内的组间夜均、昼均和日均OR 相似性也均为100%,但其中仅pH 7.5 和8.5 两实验组的夜均、昼均和日均OR 均显著高于酸性和中性环境(P<0.05),表明尽管本研究所设pH 范围内蝌蚪的耗氧昼夜节律尚未发生根本性改变,不同pH 性质范围内的组间夜均、昼均和日均OR 均较稳定,但仍改变不了弱碱性环境下蝌蚪夜均、昼均和日均OR 均明显高企的事实。综上可知,棘胸蛙蝌蚪的最适pH 为7.5,适宜范围为7.5~8.5,当所处水环境pH 偏离7.5~8.5 范围时,其时段及夜均、昼均和日均OR 均会出现不同程度的下降。

图1 pH 对棘胸蛙蝌蚪耗氧率的影响Fig.1 Effects of pH on oxygen consumption rate of Q.spinosa tadpole
2.3 NR (排氨率)
由图2 可见,pH 对蝌蚪NR的影响主要表现为:(1)从时段NR 看,各实验组间的时段NR 均具较高的相似性。其中,pH 5.5 与6.5 实验组间的时段NR 相似性为100%,两者与pH 7.0、7.5、9.5 实验组间的相似性均为88.3%,与pH 8.5 实验组间的相似性分别为33.3%和66.7%;pH 7.0、7.5 和9.5 实验组间的时段NR相似性均为100%,三者与pH 8.5 实验组间的相似性分别为66.7%、88.3%和88.3%,表明与酸性和中性环境间时段NR 差异最大的组别为pH 8.5 实验组;(2)从昼均、夜均和日均NR 看,各实验组均呈夜均>昼均≈日均(P<0.05),与所涉酸性和中性范围内类似,中性和碱性范围内的组间夜均、昼均和日均NR 相似性也均为100%,其中与酸性环境夜均、昼均和日均NR 差异最大的组别为pH 8.5 实验组,表明本研究所设pH范围内蝌蚪的排氨昼夜节律尚未发生根本性改变,不同pH 性质范围内的组间夜均、昼均和日均NR 均较稳定,但仍改变不了pH 由碱性转为酸性时夜均、昼均和日均NR 均出现一定程度下降的事实。综上可知,棘胸蛙蝌蚪的最适pH 为8.5。
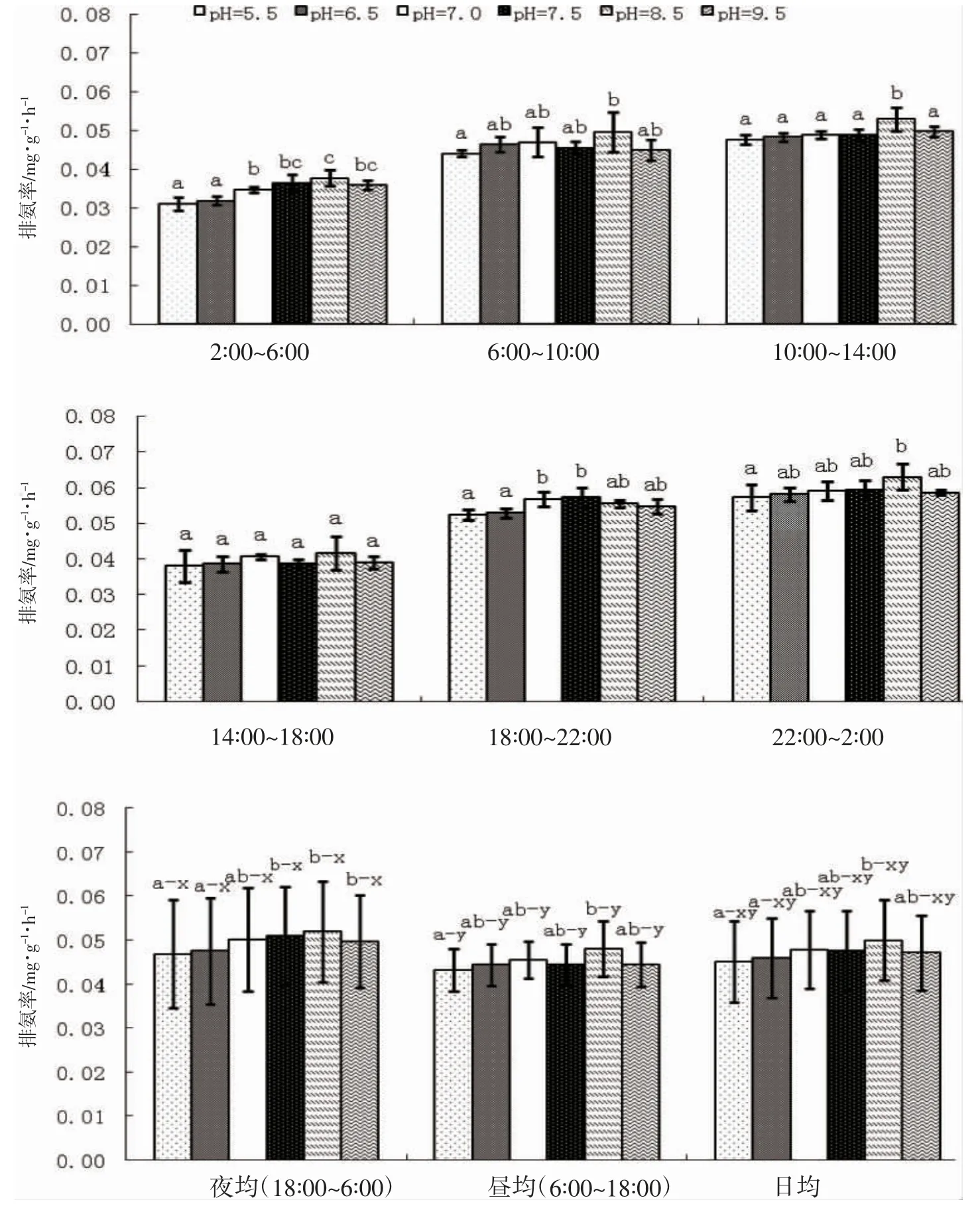
图2 pH 对棘胸蛙蝌蚪排氨率的影响Fig.2 Effects of pH on ammonia excretion rate of Q.spinosa tadpole
2.4 O:N (氧氮比)
由图3 可见,pH 对蝌蚪O:N 值的影响主要表现为:(1)诸实验组中,夜均、昼均和日均O:N 值除pH 5.5实验组均低于16 外,其余均波动于16.00~20.07 之间;(2)昼均O:N 值以pH 5.5 实验组最小(P<0.05),pH 7.5 实验组最大(P<0.05),其余实验组间均无显著差异(P>0.05);(3)夜均O:N 值随pH 上升呈阶梯式稳步上升趋势,阶梯式上升的临界点分别为pH 6.5 和7.5(P<0.05);(4)日均O:N 以pH 7.5 和9.5 两实验组最大(P<0.05),pH 5.5 实验组最小(P<0.05),其余实验组间均无显著差异(P>0.05);(5)除pH 7.5、8.5 两实验组的O:N值呈昼均>夜均(P<0.05)外,其余实验组间均呈夜均≈昼均(P>0.05)。综上可知,诸实验组中昼均、夜均和日均O:N 值均以pH 5.5 实验组为最小(P<0.05),仅pH 7.5 实验组的昼均、夜均和日均O:N 值均不低于其它实验组,唯pH 7.5~8.5 范围内的O:N 值具昼夜差异(P<0.05)。
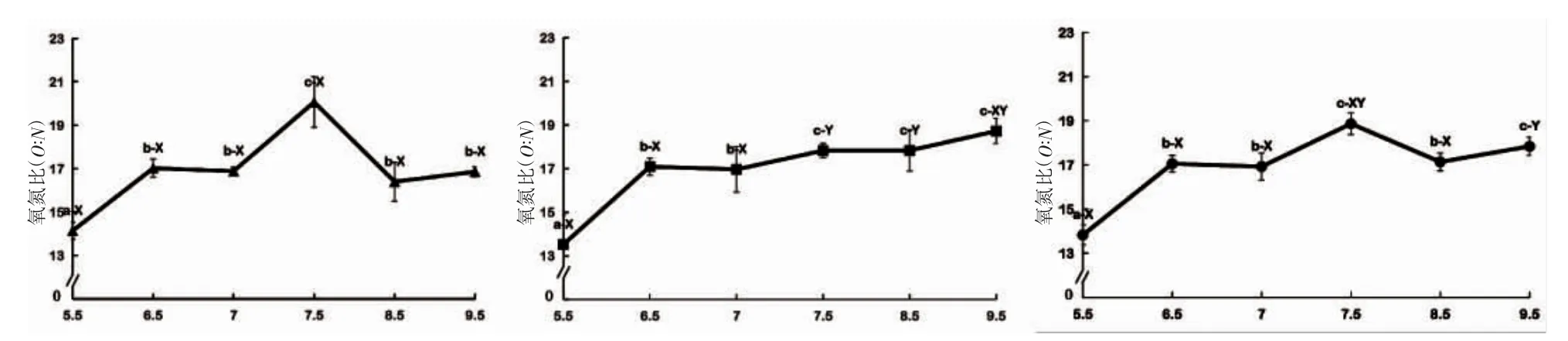
图3 pH 对棘胸蛙蝌蚪氧氮比的影响Fig.3 Effects of pH on ammonia excretion rate of Q.spinosa tadpole
2.5 窒息点
由图4 可见,蝌蚪窒息点的水中氧含量随pH 上升呈先降后升走势,并于pH 7.5 时到达谷底(P<0.05);其中,与pH 6.5 实验组无显著差异的仅为pH 9.5 实验组(P>0.05),而与pH 7.0 实验组无显著差异的仅为pH 9.5 实验组(P>0.05)。由此可知,蝌蚪所处水环境pH 偏离7.5 越远,其窒息点水中氧含量也就越高(P<0.05)。
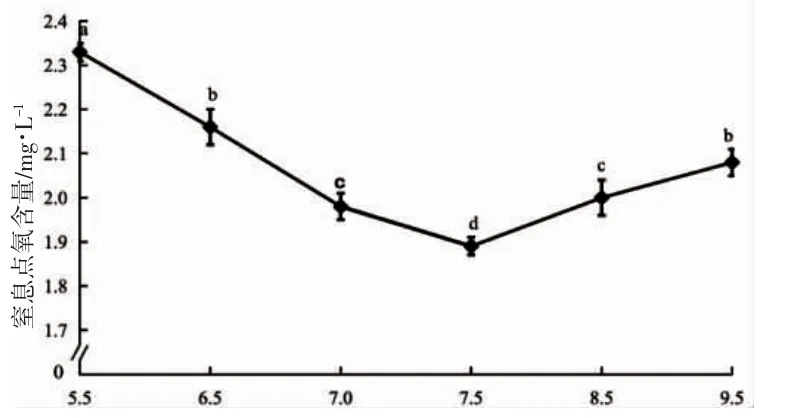
图4 pH 对棘胸蛙蝌蚪窒息点的影响Fig.4 Effects of pH on the suffocation point of Q.spinosa tadpole
3 讨论
3.1 棘胸蛙蝌蚪对pH 急性胁迫的应答特征
蛙类是重要的环境指示生物,对水质变化极为敏感[10]。据报道,薄且布有大量毛细血管的皮肤为无尾类蝌蚪的主要呼吸器官并兼具渗透压调节等多种功能[11-12],处于低氧水域中的蝌蚪皮肤往往有变薄和毛细血管增多的倾向[13-14]。这与棘胸蛙蝌蚪尾部皮肤L 值随水温升高而显著增加(P<0.05)的情形[8]相吻。故,可将尾部皮肤L 值作为指示棘胸蛙蝌蚪供氧压力的显性指标,即供氧压力随尾部皮肤L 值的增大而增加,反之亦然。观察发现,仿生态条件下饲养的棘胸蛙蝌蚪具聚群活动的习性[15]。无疑,本研究pH 5.5~7.0范围内蝌蚪所表露的固有集群行为消失、移动频率加大、运动无序性和浮头个体明显增加的现象,与表1所示尾部皮肤L 值显著大于pH 7.5~9.5 (P<0.05),图1 所示夜均和日均OR 均显著低于pH 7.5~9.5 (P<0.05),以及图2 所示pH 由碱性转为酸性时夜均、昼均和日均NR 均出现一定程度下降的情形相对应,表明pH 5.5~7.0 范围内高企的皮肤供氧压力已对其机体代谢产生负面影响,尤以对皮肤具高腐蚀性的酸性环境为甚。
研究发现,水生动物OR 和NR 呈昼低高夜的变化特征与其昼伏夜出的生活习性密切相关[16-17]。由图1、图2 所示,各实验组的OR 和NR 均呈夜均>昼均(P<0.05),与其固有生活习性相符[8-9,18-19],表明它们的耗氧和排氨昼夜节律均未发生根本性改变。但各实验组间在O:N(图3)和窒息点(图4)的应答机制上却不尽相同,主要表现为:(1)O:N 值系反映机体代谢底物利用状况的重要生理指标,当取值3~16 时代谢底物完全为蛋白质,50~60 时为等量的脂肪和蛋白质,无穷大时则完全为脂肪和糖类[20]。由图3 可见,除pH 5.5 实验组的代谢底物完全为蛋白质外,其余各实验组均仍保持其常态下以蛋白质为主、脂肪为辅的代谢底物利用模式[9.18],诸实验组中仅pH 7.5 实验组的昼均、夜均和日均O:N 值均不低于其它实验组,唯pH 7.5~8.5 范围内的O:N 值具昼夜差异呈昼均>夜均(P<0.05),表明棘胸蛙蝌蚪机体代谢过程中脂肪动员能力的强弱以及是否具有昼夜差异,系应答其pH 是否处于适宜范围的重要依据,即pH 环境越适宜,固有生活习性就越稳定,机体脂肪动员能力就越强,体内产氨量就越小,反之亦然,由此也进一步印证了牛春格等[18]所述该蛙蝌蚪具通过增强脂肪动员以抑制蛋白质水解和氨基酸代谢水平,从而主动减少体内产氨量的耐氨策略的可靠性;(2)窒息点系评价水生动物耐低氧能力的重要指标。由图4 可见,pH 偏离7.5 越远,窒息点水中氧含量就越高,表明棘胸蛙蝌蚪血液载氧能力就越弱,皮肤供氧压力也就越大,故窒息点亦可作为该蛙蝌蚪应答其pH 是否处于适宜范围的重要依据。综上,上述有关O:N 和窒息点对pH 急性胁迫的应答特征,既与pH 偏离7.5 时,棘胸蛙蝌蚪尾部皮肤ATP 酶和肝脏GSH 酶活力均呈显著上升(P<0.05),尾部皮肤与肝脏的SOD 酶和CAT 酶活力均呈显著下降(P<0.05)的结果相符[7],也揭示了皮肤供氧压力与脂肪动员能力对pH 急性胁迫的互助应答效应,即皮肤供氧压力越小,脂肪动员能力也就越强,固有生活习性也就越稳定。
至于,pH 9.5 实验组尾部皮肤L 值显著大于pH 6.5 实验组(P<0.05),而与pH 7.5 实验组无显著差异(P>0.05)(表1),窒息点水中氧含量与pH 6.5 实验组无显著差异(P>0.05),而显著高于pH 7.5 实验组(P<0.05)(图4),且其固有集群行为消失、运动无序性增加并伴有浮头现象的原因,一方面可能与该实验组蝌蚪皮肤的受腐蚀程度弱于pH 6.5 实验组有关,另一方面应与其丧失O:N 值昼夜节律导致皮肤供氧压力有所增加有关。由此,进一步表明O:N 值和窒息点在表征pH 适宜范围上较尾部皮肤L 值更具准确性。无疑,pH 7.5 较pH 8.5 更适宜棘胸蛙蝌蚪的原因亦同此理,尽管pH 7.5 实验组尾部皮肤的L 值显著大于pH 8.5实验组(P<0.05)(表1)。
3.2 pH 急性胁迫下棘胸蛙蝌蚪的内稳态保持机制
通过内稳态保持机制维系或扩大生态幅,是动物积极响应外界环境胁迫以有效消除或降低由此引发的负面影响的重要手段,尽管该机制存在较明显的局限性。行为调节和生理调节作为动物内稳态保持机制的主要途径,两者在响应外界环境变化并共同保持动物内稳态上往往会形成“表里互通”的代偿效应。就本研究而言,pH 急性胁迫下维系OR 和NR 昼夜生理节律是棘胸蛙蝌蚪通过行为调节和生理调节保持内稳态的前提(图1、图2),而维系皮肤供氧水平和机体脂肪动员能力间的适配性则是pH 急性胁迫下棘胸蛙蝌蚪内稳态保持机制的内核,这与水温[8-9]、氨氮[18,21]急性胁迫对棘胸蛙蝌蚪行为和生理影响效应的研究结果相一致。
如上所述,尽管水温、氨氮和pH 间在理化性质上存在较明显的差异,但它们在棘胸蛙蝌蚪适宜范围或最适点的形成机制上却具明显的相似性,即:(1)随水温上升,当蝌蚪夜均、昼均和日均O:N 值均抵达峰值(P<0.05),窒息点水中含氧量脱离稳定阶段并显著增加(P<0.05),各测定时段尾部皮肤ATP 酶活力持续处于峰值(P<0.05)时,表明该水温(24.5 ℃)已偏离最适水温(23 ℃)[8-9]。也就是说,随水温继续增加,即使OR和NR 昼夜节律不发生改变,但其皮肤供氧能力却已无法有效保障机体进一步动员脂肪的需求;(2)随氨氮质量浓度增加,当蝌蚪各测定时段尾部皮肤CAT 酶和肝脏GSH 酶、CAT 酶活力均持续处于峰值(P<0.05),昼均O:N 值处于峰值区氨氮质量浓度上限时,表明此时已处于蝌蚪维系低毒兴奋效应和耐氨策略的临界,该氨氮质量浓度(14.70 mg·L-1)为其安全质量浓度的上限[18,21]。也就是说,随氨氮质量浓度的继续增加,即使其OR 和NR 昼夜生理节律尚未发生根本性改变,但其皮肤供氧能力却已难以挽回脂肪动员能力即将显著回落的结果;(3)由表1、图3 和图4 可见,当窒息点水中含氧量抵达谷底(P<0.05),昼均O:N 值处于峰值(P<0.05),各测定时段尾部皮肤ATP 酶和肝脏GSH 酶活力均持续处于谷底(P<0.05),尾部皮肤和肝脏的SOD 酶、CAT 酶活力均处于峰值(P<0.05)时,该pH 为蝌蚪的最适pH(7.5),即当环境pH 偏离该值时,即使其OR 和NR 昼夜生理节律未发生根本性改变,也难以改变因皮肤供氧压力的持续增加而导致其机体脂肪动员能力显著下降的事实。综上可知,就以蛋白质为主和脂肪为辅的代谢底物利用模式的棘胸蛙蝌蚪而言,维系皮肤供氧水平和机体脂肪动员能力间的适配性既是保障其机体生理活动正常运行的重要基础,更是其启动内稳态保持机制的源动力。

