直丝紫链霉菌A8发酵条件优化、活性成分初步分析及对水稻纹枯病的防效研究
王明环,孙爱丽,赵联晶,刘 列,赵添琦,董文汉,罗 琼,黄惠川,李成云*,杨根华*
(1.云南农业大学/省部共建云南生物资源保护与利用国家重点实验室,昆明 650201;2.云南农业大学科技处,昆明 650201)
水稻纹枯病(Rice sheath blight disease)是由立枯丝核菌Rhizoctonia solani感染的真菌病害,是当前水稻生产上的主要病害之一[1]。为了控制水稻病害,生物防治因为绿色、高效、无公害的特点已经成为当今防治水稻病害的研究热点[2]。诸多学者利用拮抗微生物包括拮抗真菌、细菌和放线菌或者其代谢产生的拮抗物质作为生物防治的材料来控制水稻病害的发生[3,4]。放线菌是环境中广泛存在的一类微生物,能够产生抗病原菌的生物活性物质[5-7]。数据显示,放线菌产生的10000多种生物活性次生代谢物中,有7600多种来自链霉菌属,约占75%[8,9],显示了链霉菌作为药物生产者的巨大价值。过去十年,不同环境中分离的链霉菌分泌的生物活性新型代谢物数量在不断增长。根据其化学结构的不同主要分为多肽、醌类、大环内酯类、萜烯类、聚酮类、吲哚类、酶、酶抑制剂以及脂类等[10]。链霉菌主要用于医用抗生素和农用抗生素的生产,其中产业化的农用抗生素对防治农作物病害有着重大的作用,但就目前抗生素的数量、质量和品种而言还远远不能满足农业生产的需要[11]。从现有的知识和统计数据分析,链霉菌在未来的很长一段时间里仍是抗生素的主要来源[8]。
直丝紫链霉菌A8属于链霉菌属,是本实验室从土壤中分离出的一株拮抗放线菌,对引起烟用香精香料变质的微生物包括芽胞杆菌、醋酸杆菌、土壤球菌均有明显的抑制作用[12],且对立枯丝核菌也有一定的抑制作用。前人对直丝紫链霉菌的研究较少,仅李纪顺等[13]报道从山东省科学院中试基地内的番茄根际土中分离出一株同源性与直丝紫链霉菌达98.9%的菌株A-29,对供试的8种植物病原真菌均有拮抗作用,且从其发酵上清液中鉴定出 4种可能起抑菌作用的活性物质。直丝紫链霉菌A8发酵液中含有抑菌的活性物质,为了进一步提高其活性物质的产量及增强抑菌作用,我们对直丝紫链霉菌A8的发酵培养基成分和发酵条件包括接种量,装液量、初始pH和发酵温度进行了优化。同时为解析该活性物质的构成,本研究对菌株 A8所产生的代谢产物通过气相色谱−质谱技术(GC−MS)进行初步检测。将分离和鉴定出的不同组分以分析纯物质替代,以蜡状芽胞杆菌和立枯丝核菌AG-1作为指示菌进行生物活性测定试验,探究菌株A8代谢活性物质从细菌到真菌的广谱抗性。进而研究菌株A8固体发酵制剂对水稻纹枯病的大田防控效果,探究其在水稻纹枯病病害生物防治中的价值。
1 材料与方法
1.1 试验材料
直丝紫链霉菌S.rectiviolaceus A8由本实验室鉴定并保存,蜡状芽胞杆菌B.cereus和立枯丝核菌R.solani AG-1均由本实验室提供,枯草芽胞杆Bacillus subtilis BT205由云南星耀生物制品有限公司提供,供试水稻品种为云粳37由楚雄市植保植检站提供。
1.2 培养基及种子液的制备
PDA培养基:马铃薯20%,葡萄糖2%,琼脂2%;LB培养基:蛋白胨1%,酵母粉0.5%,NaCl 1%,琼脂 2%;种子培养基:可溶性淀粉 2%,NaCl 0.05%,KNO30.1%,K2HPO4·3H2O 0.05%,MgSO4·7H2O 0.05%,FeSO4·7H2O 0.001%,pH 7.5,发酵基础无机盐培养基:NaCl 0.05%,K2HPO4·3H2O 0.05%,MgSO4·7H2O 0.05%,FeSO4·7H2O 0.001%,pH 7.5,碳、氮源按照试验要求加入。
将直丝紫链霉菌A8均匀涂布于种子固体培养基中,30 ℃培养7 d至培养基表面菌苔出现紫褐色孢子。将活化好的菌株A8孢子用打孔器打成菌饼,挑取10个大小相似的菌饼接入种子培养基(500 mL锥形瓶装液量200 mL),25 ℃、120 r/min摇床培养7 d,即得种子液。然后以10%(体积分数,下同)的接种量接入发酵培养基中(500 mL锥形瓶装液量100 mL),相同条件培养7 d。
1.3 发酵碳、氮的优化
1.3.1 碳源的选择 玉米粉、葡萄糖、麦芽糖、蔗糖、乳糖和可溶性淀粉作为发酵培养基中的碳源,以不接菌株A8但含有不同碳源的培养液作为空白对照,将种子液接入发酵培养基中,25 ℃、120 r/min发酵7 d,每个处理3个重复,每个重复测定菌株A8菌体干重及采用牛津杯法测定菌株A8上清液对蜡状芽胞杆菌抑菌圈的大小(下同),筛选出合适的碳源。菌丝干重测定[14]:取每种培养基的发酵液50 mL至已烘干称重的离心管(W0)中,6000 r/min离心10 min,弃去上清液,将带菌体的离心管置于65 ℃鼓风干燥箱中烘干至恒重(W1),换算出1000 mL发酵液中菌丝体的干重,用质量浓度表示菌体干重(g/L),计算公式为W=(W1―W0)×1000/50。抑菌圈的测定[15]:将不同处理的发酵液6000 r/min离心15 min,发酵上清液用0.45 µm滤膜过滤除菌,同时将蜡状芽胞杆菌(浓度约为1×107cfu/mL)菌悬液加入溶化冷却至50 ℃的LB培养基中,混匀制成含菌培养基,将牛津杯(内径6 mm)置于平板上,加入200 µL发酵滤液,对照组中加入200 µL相应的培养液。然后将平板于25 ℃条件下培养24 h,之后测量透明圈直径(透明圈>6 mm,说明具有抑菌作用)。
1.3.2 氮源的选择 分别以酵母膏、黄豆粉、牛肉膏、蛋白胨、(NH4)2SO4和NH4Cl和KNO3作为发酵培养基的氮源,以不接菌株A8但含有不同氮源的培养液作为空白对照,将种子液接入发酵培养基中,25 ℃、120 r/min发酵7 d,测定菌株A8菌体干重和抑菌圈的直径。
1.3.3 氮源比例的确定 分别将黄豆粉和酵母膏以4:1、3:2、2:3和1:4比例总共0.1%的用量作为发酵培养基的氮源,以不接菌株A8但含有不同比例氮源的培养液作为空白对照,接入种子液,25 ℃、120 r/min培养7 d后测定菌株A8菌体干重和抑菌圈的直径。
1.3.4 碳、氮源浓度的初步确定 采用正交法设计试验方案,把已筛选出的合适碳、氮源分别以浓度梯度加入发酵基础培养基中,发酵7 d,测定不同碳、氮源浓度发酵液的菌株A8菌体干重和抑菌圈大小,以确定最佳的碳、氮源浓度。
1.4 发酵条件的优化
1.4.1 发酵时间的优化 将种子液接入优化碳、氮源后的培养基培养,从第1 d到第12 d每天分别取样,过滤后取上清液放入4 ℃冰箱中备用,取样全部结束后测定发酵液菌株A8菌体干重和抑菌活性,每个处理重复3次。
1.4.2 装液量的优化 在500 mL锥形瓶中分别装入100、150、200、250、300、350 mL优化碳、氮源的培养基,每个处理重复3次,25 ℃、120 r/min条件下培养8 d,测定不同装液量条件下发酵液菌株A8菌体干重和抑菌活性。
1.4.3 接种量的优化 用优化碳、氮源后的培养基,分别按3%、5%、7%、9%、11%、13%、15%的接种量接入种子液,每个处理重复3次,25 ℃、120 r/min条件下培养8 d,测定不同接种量条件下发酵液的菌体干重和抑菌活性。
1.4.4 发酵温度的优化 将种子液按7%接种量接种于优化的发酵培养基中,将发酵培养基分别在22 ℃、25 ℃、28 ℃、31 ℃、34 ℃和37 ℃条件下振荡培养8 d,每个处理重复3次,测定不同温度条件下菌株A8菌体干重和抑菌活性,筛选出最适发酵温度。
1.4.5 初始pH的优化 将发酵液初始pH分别调节为4.0、5.0、6.0、7.0、8.0、9.0和10.0,每个处理重复3次,7%接种量接入种子液,28 ℃、120 r/min发酵8 d,测定不同初始pH条件下菌株A8菌体干重和抑菌活性,筛选出最适的初始pH。
1.5 活性物质粗提物的制备
取10 L菌株A8发酵液用8层纱布过滤,滤液8000 r/min离心10 min,吸取上清液用0.45 µm微孔滤膜过滤除菌,得到含有活性物质的发酵滤液。乙酸乙酯作为萃取剂,与滤液等体积混合于1000 mL分液漏斗中,充分振荡后室温静置15 min,收集上层有机相于1000 mL锥形瓶中,萃取操作重复3次,使物质萃取充分,每1000 mL有机相中加入10 g无水硫酸钠,室温过夜干燥脱水。有机相通过旋转蒸发仪40 ℃减压浓缩,以回收液成滴状下流为最佳蒸馏状态。收集浓缩物,加入乙酸乙酯定量至1000 μL,用0.20 µm针式滤膜过滤器2次过滤后收集于1.5 mL棕色样品瓶中[16]。
1.6 有机相和无机相抑菌活性的测定
将10 L乙酸乙酯萃取的发酵滤液有机相通过旋转蒸发仪40 ℃蒸馏浓缩至干,得到的黄褐色膏状粗提物经DMSO溶解,稀释成1%、3%、5%、10%、20%、30%、40%、50%的DMSO溶解液,采用平板对扣法以立枯丝核菌为指示菌测定其抑菌活性,方法为:吸取400 µL不同浓度粗提物的DMSO溶液均匀涂布在PDA平板上,取活化好的立枯丝核菌菌饼,接于PDA平板中央,与涂有粗提物的DMSO溶液平板对扣、密封,25 ℃恒温培养箱培养。以涂布400 µL DMSO溶液的平板作为对照,待对照平板菌丝长满培养皿时观察并测量各培养皿的菌落直径,每处理5个重复[17],抑制效果用抑制率表示,抑制率(%)=(对照培养菌落直径—处理菌落直径)/(对照培养菌落直径—菌饼直径)×100。
1.7 菌株A8挥发性活性成分的GC-MS检测
将1.5中收集的粗提物采用岛津GCMS-QP2010型气质联用仪进行测定。GC条件:进样口温度 250 ℃,柱箱温度 65 ℃;进样方式:分流;载气:He;初始压力 500~900 kPa;流量控制方式:线速度;压力:59.4 kPa;总流量:24.0 mL/min;柱流量:1.0 mL/min;线速度 36.6 cm/sec;吹扫流量:3.0 mL/min;分流比:20.0。MS条件:离子源温度:200 ℃;接口温度:250 ℃;溶剂延迟时间:3 min;检测器电压:0.1 kV。利用面积归一化法计算各成分的相对含量,3次重复检测。
1.8 挥发性纯品物质对丝核菌AG-1的抑菌检测
用分析纯品物质代替气相色谱-质谱法(GC-MS)分离鉴定出的不同组分来检测不同组分的生物活性。分别吸取挥发性活性物质400 µL以25、125、250、500、1000 µL/mL的浓度梯度均匀涂布在PDA平板上,采用1.6中平板对扣法[17]测定挥发性纯品物质的抑菌活性。
1.9 挥发性纯品物质对蜡状芽胞杆菌的抑菌检测
将分析纯品物质分别用20%的DMSO溶解并配制成浓度为10、50、100、200、400 µg/mL的溶液,以20%的DMSO无菌溶液作为对照,采用1.3.1中牛津杯法[15]测定不同浓度的纯品物质对蜡状芽胞杆菌的抑菌圈大小,每个处理3个重复。
1.10 直丝紫链霉菌A8对水稻纹枯病的田间防效
1.10.1 菌株A8生防固体制剂的制备 由于固态菌剂的菌体孢子数量大,且便于保存和运输,将谷壳、麦麸和水以3:2:3的配比总共800 g加入到5 L的锥形瓶中,灭菌,每个锥形瓶中接入400 mL菌株A8发酵液,每天摇晃3~4次,使之均匀混合。室温发酵10 d后倒出在阴凉处晾干备用。
1.10.2 大田试验区设计 根据当地生产实际,试验时间为2019年4月4—24日。试验地点设在云南省楚雄市东华镇新柳村委会苴午村(N24°57′39.98″,E101°28′51.40″)。稻田土壤肥力中等,常年稻瘟病、纹枯病发生较重。试验小区采用单因素随机区组排列设计,设6个处理,分别为:CK(对照)、F-1(40%稻瘟灵乳油)、BT(枯草芽胞杆菌BT205)、A8-1(250 g菌株A8生防固体制剂)、A8-2(450 g菌株A8生防固体制剂)、A8-3(650 g菌株A8生防固体制剂),每个处理3个小区,每个小区10 m2,试验田总面积1200 m2。
生防菌施用时间、用量和方法:7月15号水稻分蘖中期和8月10号孕穗期F-1小区施用40%稻瘟灵1.2 mL,兑水750 mL,喷雾施药;7月29号在水稻处于孕穗期,施入A8生防菌到水稻田中,均匀撒开,其中A8-1小区施用250 g菌株A8固体生防制剂,A8-2小区施用450 g菌株A8固体生防制剂,A8-3小区施用650 g菌株A8固体生防制剂;同时BT小区施入枯草芽胞杆菌BT205,每个小区施用2 g,兑水1000 mL,在水稻抽穗后(施药后28 d)开始调查病害。
1.10.3 病害程度和发病率调查 在水稻生长至分蘖末期和抽穗前期,此时试验小区中的环境高温高湿,易发生病害,此时调查水稻的总株数、病株数和病情指数。分级标准:0级(植株健康,全株无病),1级(稻株基部叶鞘或叶片发病,3级(顶叶或剑叶以下第三叶鞘、叶片发病),5级(顶叶或剑叶以下第二叶鞘、叶片发病),7级(顶叶或剑叶以下第二叶鞘、叶片发病),9级(顶叶叶鞘、叶片发病[18]。发病率(%)=(发病株数/调查总株数)×100%,病情指数=∑(病级株数×各级代表数值)/(调查总株数×发病最重级代表数值)×100。
1.11 数据统计与分析
试验数据采用SPSS 23.0和Excel软件进行统计和分析。
2 结果与分析
2.1 碳源筛选结果
不同碳源培养基中,玉米粉和可溶性淀粉有利于菌株A8的生长,菌体干重分别3.12和2.29 g/L,显著高于其他处理(P<0.05);可溶性淀粉处理的抑菌圈直径最大,为19.3 mm,显著高于以玉米粉作为碳源的处理(P<0.05),更有利于菌株A8代谢活性物质的产生(表1)。因此,综合考虑选用可溶性淀粉作为最佳碳源。
2.2 氮源筛选结果
不同氮源试验处理中,酵母膏和黄豆粉有利于菌株A8发酵产生活性物质,抑菌圈直径分别为22.7和21.2 mm,显著高于蛋白胨、牛肉膏、(NH4)2SO4等处理(P<0.05);在不同氮源菌株A8的生物量上,黄豆粉和蛋白胨处理的菌体干重最大,为4.51和4.22 g/L,显著高于其他处理(P<0.05)(表2)。但蛋白胨价格贵,不适于生产应用,综合材料价格和抑菌活性物质产量考虑选用酵母膏和黄豆粉作为菌株A8发酵培养的氮源。
2.3 不同氮源比例试验结果
不同比例的酵母膏和黄豆粉替代初始培养基中的氮源对菌体生长和抑菌活性影响表明,随着黄豆粉和酵母膏比例中酵母膏的增加,菌体的生物量随之减少,而抑菌活性随之上升,这与不同氮源筛选的试验结果相吻合。在黄豆粉、酵母膏比例为3:2和2:3时抑菌活性最高,抑菌圈直径都为23.2 mm,但黄豆粉、酵母膏比例为3:2时菌体干重为4.07 g/L,显著高于黄豆粉、酵母膏比例为2:3组合(P<0.05)。因此选择黄豆粉、酵母膏为3:2组合(表3)。
2.4 正交试验对发酵培养基营养成分进行优化
在单因素试验结果的基础上,选择可溶性淀粉作为碳源,黄豆粉和酵母膏比例为3:2作为氮源组合,设计A、B两因素4水平L16(42)正交试验,因素水平和试验结果见表4和表5。从表5结果中可知编号11(组合A3B3)最为合适,该组合中抑菌圈直径达到28.2 mm,抑菌活性物质产量相较其他试验组合高,菌体干重为7.15 g/L,生物量相对较高,说明菌丝生长状况良好。故确定最优发酵培养基配方:可溶性淀粉3%、黄豆粉0.6%、酵母膏0.4%、NaCl 0.05%、K2HPO4·3H2O 0.05%、MgSO4·7H2O 0.05%、FeSO4·7H2O 0.001%。

表4 优化培养基的L16(42)正交试验因素和水平Table 4 The orthogonal experiment factors and level L16 (42) of optimal medium
2.5 发酵时间对菌体生长和抑菌活性物质产量的影响
放线菌在发酵培养过程中,菌株A8对营养物质的利用速度在不同发酵时间的生长量和抑菌活性物质产量表现出如下规律,发酵2 d基本无抑菌活性物质分泌,第3 d时菌株A8有一定的生长量和少量的抑菌活性物质产生,此后菌株的生长量和活性物质的分泌越来越多,在第8 d达到最高的生长量和最大抑菌活性,分别为8.04 g/L和28.7 mm,显著高于前7 d的生长量和抑菌活性物质产量(P<0.05),第9 d后生长量和抑菌活性有下降的趋势,但幅度不大(图1)。
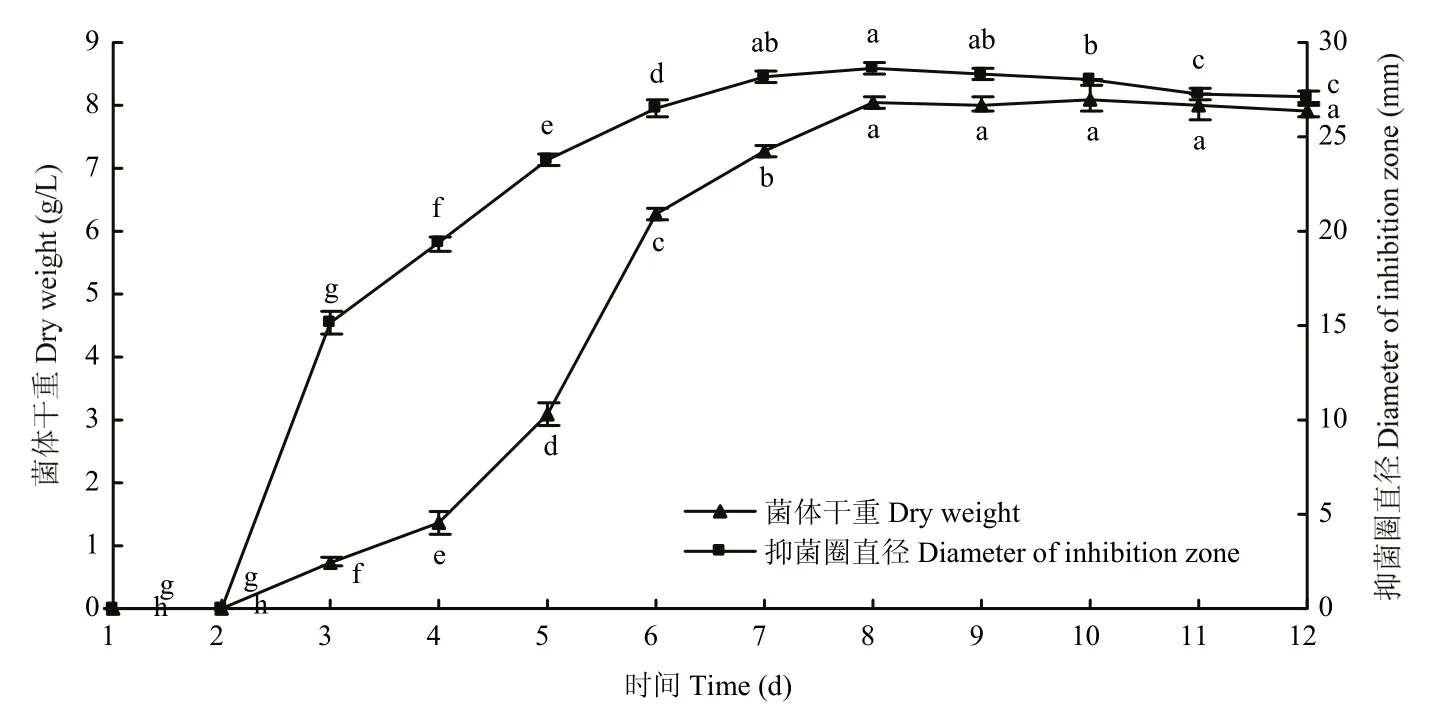
图1 不同发酵时间对菌株A8菌体生长和抑菌活性的影响Fig.1 Effects of different culture time on strain A8 antifungal activity and bacteria growth mass
2.6 装液量对菌体生长和菌株抑菌活性物质产量的影响
500 mL锥形瓶中不同体积的培养液造成相对空气量和传质阻力的不同,不同处理的抑菌圈大小和菌体干重存在着明显的区别(表 6)。多个处理表现出空气量大,氧气传质阻力小,菌株生长量和活性物质产量高的趋势。其中100、150、200和250 mL装液量处理显著高于300和350 mL处理(P<0.05)。

表6 不同装液量对菌株A8菌体生长和抑菌活性的影响Table 6 Effects of different loaded liquid on the antifungal activity and bacteria growth mass of strain A8
2.7 接种量对菌体生长和菌株抑菌活性物质产量的影响
试验结果表明,当接种量为3%~7%时,菌株A8的生长量和活性物质产量较高,没有显著差异。其中接种量在7%时,菌株A8的生长量和活性物质产量最高,分别为29.5 mm和9.26 g/L。接种量超过7%时,生长量逐渐降低,接种量为9%~15%处理显著低于3%~7%处理(P<0.05);接种量超过9%时,活性物质产量也逐渐降低,接种量为11%~15%处理显著低于3%~9%处理(P<0.05)(表7)。
2.8 培养温度对菌体生长和菌株抑菌活性物质产量的影响
试验结果表明,当培养温度在25 ℃~34 ℃,均适合菌株A8的生长,其中28 ℃培养菌株A8的生长量和活性物质产量达到最高,分别为31.0 mm和10.00 g/L;当培养温度低于22 ℃或者高于34 ℃,都不利于菌株A8的生长,生长量和活性物质产量较低,显著低于其他处理(P<0.05)(表8)。说明该菌株比较适宜在相对偏高的条件下发酵培养。
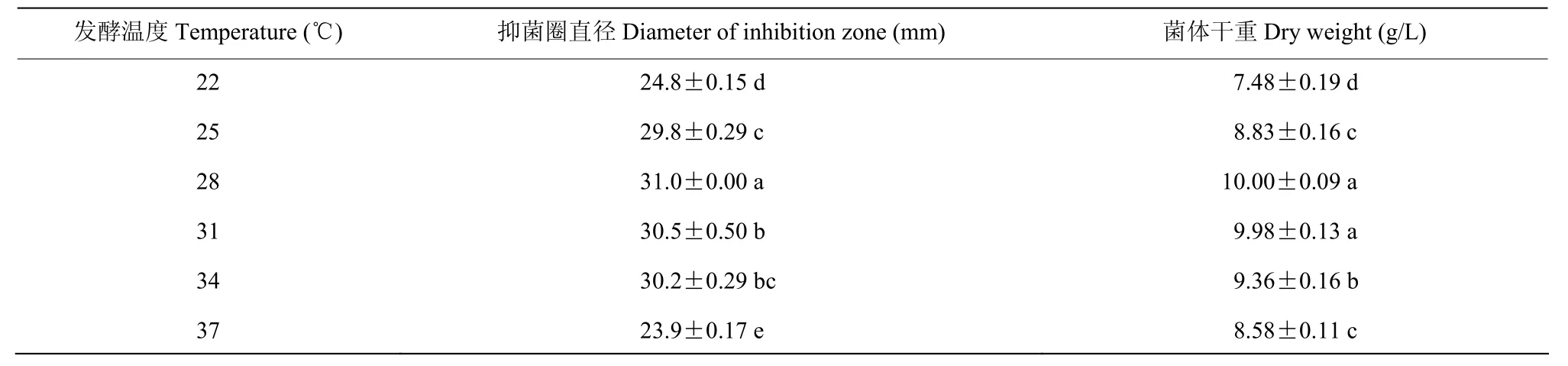
表8 培养温度对菌株A8菌体生长量和抑菌活性的影响Table 8 Effects of different temperature on antifungal activity and bacteria growth mass of strain A8
2.9 pH对菌体生长和菌株抑菌活性物质产量的影响
试验结果表明,在pH 5.0~10.0均能生长且有抑菌物质的分泌,在pH 6.0~9.0的条件下菌株生长量和抑菌活性物质产量较大,其中在 pH 7.0中性条件下菌株生长量和抑菌活性物质产量达到最大,分别为32.0 mm和10.38 g/L,显著高于其他处理(P<0.05)。pH 6.0以下或者pH 9.0以上随着酸度或者碱度的增大,菌株生长量和抑菌活性物质产量都随之减小(表9)。
2.10 无机相和有机相抑菌活性测定
通过对发酵滤液粗提物的抑菌活性测定结果表明,水相中的物质对丝核菌AG-1没有抑制作用,有机相中存在抑制丝核菌AG-1的活性物质,且随着活性物质浓度的增加,抑制率也随之增加,且不同活性物质浓度间的差异显著(P<0.05)(图2)。
2.11 挥发性活性物质分析
菌株A8发酵液乙酸乙酯粗提物GC-MS分析总离子流见图3,由总离子流图中分离度、分辨率和基线的稳定性可看出本次实验的分离鉴定方法的条件选择是有效的。总共分离出151个色谱峰,出峰时间主要集中在前22.5 min和后45 min,中间存在断断续续出峰的现象,其中在13.5 min左右时峰面积最大,其次是18、28.5和46 min。
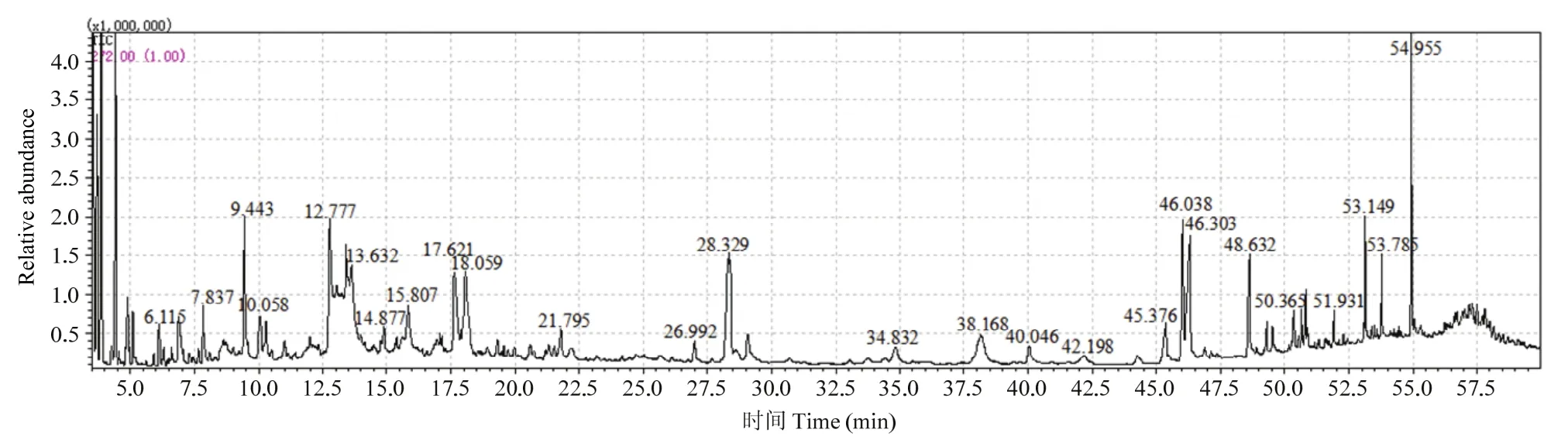
图3 直丝紫链霉菌A8发酵液乙酸乙酯相GC-MS图谱Fig.3 The GC-MS spectrum of the Ethyl acetate phase from the strain A8
将所得质谱信息与NIST标准谱库对照分析,质谱峰匹配度大于85的物质视为检出物,按峰面积归一化法确定各组分在挥发性物质中的相对含量,具体信息详见表10。菌株A8所产生的挥发性物质主要有醇类、酮类、酰胺类、烷烃类、脂类、羧酸类和芳香烃类物质。其中脂类物质相对含量最高,达到15.7%以上,其次为芳香烃类和羧酸类物质,相对含量在11.7%和11.3%。
2.12 挥发性纯物质对立枯丝核菌的生物活性测定
通过GC-MS分析菌株A8产生的挥发性活性物质,NIST标准谱库检索得到26种组分,经过查阅文献,有些物质不存在抑菌作用,或者因毒性较高安全起见没有做相关生物活性测定试验,此外,还有一些物质较难买到,因此总共购得 12 种不同组分的化合物替代菌株A8检出物进行生物活性测定试验。
进行生物活性测定试验的 12种分析纯物质包括:邻苯二酚(Catechol)、1,2,4,5-四甲基苯(Benzene,1,2,4,5-tetramethyl-)、十六烷(Hexadecane)、邻苯二甲酸二甲酯(Dimethyl phthalate)、邻苯二甲酸二丁酯(Dibutyl phthalate)、邻苯二甲酸二异辛酯(Diisooctyl phthalate)、邻苯二甲酸二壬酯(1,2-Benzenedicarboxylic acid,dinonyl ester)、邻苯二甲酸二(7-甲基辛基)酯(Phthalic acid,bis(7-methyloctyl) ester)、2-呋喃羧酸,酰肼(2-Furancarboxylic acid,hydrazide)、N-(2-苯乙基)-乙酰胺(Acetamide,N-(2-phenylethyl)-)、二氢-3-亚甲基-2,5-呋喃二酮(2,5-Furandione,dihydro-3-methylene-)、3-甲基-1,2-环戊二酮(1,2-Cyclopentanedione,3-methyl-)。生测试验结果表明邻苯二甲酸二(7-甲基辛基)酯、十六烷、邻苯二甲酸二壬酯、邻苯二甲酸二异辛酯和N-(2-苯乙基)-乙酰胺5种物质的抑菌率在20%以下。另外7种物质的抑菌作用随着接种浓度的增加而增强,其中 3-甲基-1,2-环戊二酮、1,2,4,5-四甲基苯和二氢-3-亚甲基-2,5-呋喃二酮的抑菌作用明显,在接种400 µL时达到70%以上(表11)。
2.13 分析纯物质对蜡状芽胞杆菌的生物活性测定
通过菌株 A8活性物质不同组分对蜡状芽胞杆菌的抑菌作用研究表明:邻苯二甲酸二(7-甲基辛基)酯、邻苯二甲酸二壬酯、邻苯二甲酸二异辛酯、1,2,4,5-四甲基苯和十六烷无抑菌圈的形成,对蜡状芽胞杆菌没有抑制作用。其他7种化合物对蜡状芽胞杆菌表现出明显的抑制作用,都随着浓度的增加抑菌作用增强,且不同浓度间的差异显著(P<0.05)。其中二氢-3-亚甲基-2,5-呋喃二酮、2-呋喃羧酸,酰肼、邻苯二酚和3-甲基-1,2-环戊二酮在微剂量的浓度(50 µg/mL)下就形成较大的抑菌圈,分别是27.0、25.9、26.7和22.0 mm,二氢-3-亚甲基-2,5-呋喃二酮、2-呋喃羧酸,酰肼和邻苯二酚在400 µg/mL的浓度下更是达到37.0、34.7和33.0 mm(图4)。
2.14 生防菌A8对水稻纹枯病发病程度的防治结果
由表12可知,施药后28 d,施了稻瘟灵和生防菌的水稻的发病率和病情指数均显著低于对照组(P<0.05)。发病率和病情指数由高到低的处理分别为A8-3、A8-2、枯草芽胞杆菌、A8-1、稻瘟灵以及对照组,A8防效与枯草芽胞杆菌相近,且随A8施加量的增加,对水稻纹枯病的防效越好。
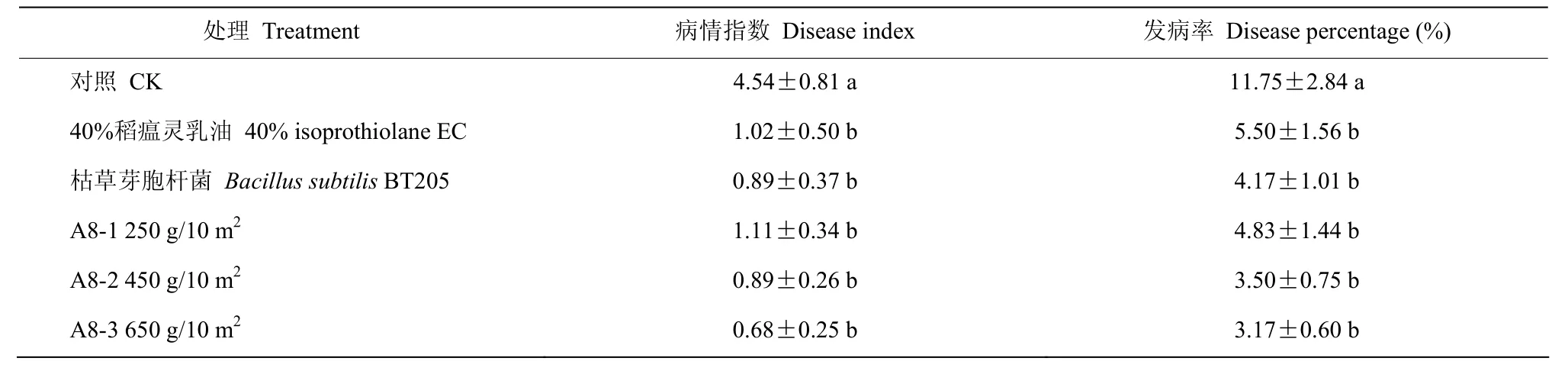
表12 生防菌和农药对水稻纹枯病的田间防效Table 12 Field control effects of biocontrol bacteria and pesticides on rice sheath blight
3 讨论
放线菌的生长繁殖和生物活性次生代谢产物的分泌与培养基营养成分和环境条件密切相关,针对筛选出的有拮抗活性的放线菌深入地研究其营养及发酵条件,对于拮抗放线菌的进一步开发研究及以后可能的工厂化生产均有重要意义[19]。直丝紫链霉菌A8在不同的营养和环境条件下菌丝生长量和抑菌活性物质的产量有着显著的差异。在营养条件方面,可溶性淀粉和玉米粉作为缓效碳源比起葡萄糖、麦芽糖等速效碳源更加有利于菌株A8菌丝的生长和抑菌活性物质的产生。Nagato等[20]研究发现速效碳葡萄糖有利于Streptomyces griseoviridus G-89菌丝体的生长,但肽内酯抗生素neoviridogrisein II的产量低,而以缓效碳作为碳源时,菌株G-89的生长虽慢,但是抗生素产量高。黄豆粉和酵母膏组合作为有机氮源其菌丝生长量和活性物质产量比起无机氮源KNO3要更高,说明有机氮源更加适合菌株A8的发酵培养。在发酵培养基碳、氮源正交实验中,适量的增加培养基中碳、氮源的含量能明显提高菌株A8的菌丝生长量和活性物质的产量,但是可溶性淀粉、黄豆粉和酵母膏含量过大后,培养基的液态性较差而影响摇床培养,因此兼顾较好的产量及培养液性状,选择3%含量的可溶性淀粉,0.6%黄豆粉和0.4%酵母膏作为最佳的碳、氮源配比浓度。同时碳、氮源配比浓度的增加菌株A8的生物量也更高,但是其活性物质的产量并没有随之增加,说明菌株A8次生代谢物质的产量并不完全由菌丝体的生物量决定,其代谢途径复杂[11]。发酵环境条件对菌株A8的发酵培养也有着显著的影响,研究结果表明,该菌株最适宜的培养温度是28 ℃~31 ℃,初始pH 7.0~8.0,装液量是500 mL锥形瓶装液100~200 mL,相对空气量高、氧气传质阻力小更有利于菌株A8的生长,接种量3%~7%,过高的接种量其次生代谢物质含量高从而在菌株A8生长前期阶段可能影响其扩大生长繁殖。本试验菌株A8发酵条件的优化是在高氏一号培养基的基础上,虽然菌丝的生物量和代谢活性物质产量经过碳、氮源以及发酵环境条件的优化有一定的提高,但是相关微量元素如Na+、K+、Fe2+等的优化并未验证,有待进一步的研究。
利用链霉菌等拮抗微生物的生物活性次级代谢产物是防治植物病害的一种有效途径[21]。最近研究表明,微生物挥发性有机化合物(MVOCs)在抑制病原菌生长,诱导植物产生抗病性和对非生物胁迫的耐受性有着重要的影响[22,23]。近些年来,Ahsan等[7]通过GC-MS技术从链霉菌KX852460产生的次级代谢产物中提取和鉴定出二十烷、邻苯二甲酸二丁酯等抗真菌活性物质,能抑制丝核菌AG-3菌株的生长。Jalaluldeen等[24]从辣椒根际土壤分离的链霉菌 KJ872546产生的次级代谢产物中鉴定出的主要成分有六氢-吡咯并{1,2-a}吡嗪-1,4-二酮(Pyrrolo{1,2-a}pyrazine-1,4-dioe,hexahydro-)、六氢-3-(2-甲基丙基)-吡咯并{1,2-a}吡嗪-1,4-二酮(Pyrrolo{1,2-a}pyrazine-1,4-dione,hexahydro-3-(2-methylpropyl)-)和 5,10-二乙氧基-2,3,7,8-四氢-1H,6H-二吡咯并{1,2-a; 1,2-d}吡嗪(5,10-Diethoxy-2,3,7,8-tetrahydro-1H,6H-dipyrrolo{1,2-a;1,2- d}pyrazine)等物质,其能抑制尖孢镰刀菌菌丝的生长。Prabavathy等[25]从链霉菌PM5中分离得到两种脂肪族化合物 SPM5C-1和SPM5C-2分别带有内酯和酮羰基,两种化合物对稻瘟病菌和水稻纹枯病菌具有一定的抑制作用。但是这些报道的生防菌只是对真核真菌具有抑制作用。本研究直丝紫链霉菌A8次级代谢物质中含有丰富的生物活性化合物,在进行生物活性测定试验的12种分析纯物质中,邻苯二酚、邻苯二甲酸二甲酯、邻苯二甲酸二丁酯、2-呋喃羧酸,酰肼、二氢-3-亚甲基-2,5-呋喃二酮和3-甲基-1,2-环戊二酮对立枯丝核菌AG-1和蜡状芽胞杆菌的生长均具有抑制作用,其中3-甲基-1,2-环戊二酮和二氢-3-亚甲基-2,5-呋喃二酮在低浓度下就能对立枯丝核菌AG-1和蜡状芽胞杆菌产生较强的抑制作用,具有潜在的同时抑制真菌和细菌的作用,为开发广谱生防制剂提供很好的材料。目前关于这两种酮类挥发性物质对立枯丝核菌 AG-1和蜡状芽胞杆菌的抑制效果尚未报道,针对其抑菌机理还有待进一步研究。此外,本研究只进行了菌株A8的挥发性活性物质的检测鉴定,关于其非挥发性活性物质还有待研究。
目前,国内外用于防治水稻纹枯病的微生物主要有真菌中的木霉菌Trichoderma sp.[26]、细菌中的芽胞杆菌Bacillus sp.[27,28]和假单胞菌Pseudomonas sp.[29],以及放线菌中的链霉菌Streptomyces sp.等[30,31],但尚未有用直丝紫链霉菌防治水稻纹枯病的研究报道。本试验研究发现直丝紫链霉菌A8对水稻纹枯病有一定的防效,为水稻纹枯病病害的生物防控提供新的生防材料。

