牛筋草生防菌NJC-16的分离鉴定及生物学特性研究
顾琼楠,欧 翔,褚世海,黄启超,陈安安,李儒海*
(1.湖北省农业科学院植保土肥研究所/农业农村部华中作物有害生物综合治理重点实验室/农作物重大病虫草害防控湖北省重点实验室,武汉 430064;2.中华人民共和国桂林海关,桂林 541004)
牛筋草Eleusine indica (L.) Gaertn.是农田的一种恶性杂草,分布于中国南北各省(区)及全世界温带和热带地区,主要危害玉米、棉花、大豆等粮食作物,及蔬菜、果树等经济作物[1]。使用化学除草剂是其主要的防除措施,然而随着化学除草剂的大量使用,导致牛筋草抗药性以及环境污染问题日益加重,牛筋草的高效安全防除面临着严峻挑战,因此开发微生物除草剂或利用自然界生物中具有生物活性的代谢产物开发新的生物源除草剂成为高效防除牛筋草、进而替代现有化学除草剂的有效途径之一[2]。
自然界中植物致病微生物-真菌是开发生物除草剂的重要来源[3]。目前,有超过40个属的真菌已经或正在被考虑开发成生物除草剂,其中包括刺盘孢菌属 Colletotrichum、疫霉属 Phytophthora、镰刀菌属Fusarium、交链孢菌属Alternaria等[4]。其中,炭疽菌已应用于防除多种杂草[5],如胶孢炭疽菌菟丝子专化型Colletotrichum gloeosporiodes (Penz.) Sacc.f.sp.cuseutae的商品化除草剂“鲁保一号”对大豆田菟丝子有明显的防除效果[6]。盘长孢状刺盘孢合萌专化型C.gloeosporioides f.sp.aeschynomene的商品化除草剂“Collego”能够用来防除水稻及大豆田间生长的豆科杂草,如弗吉尼亚合萌等[7]。瓜类炭疽菌C.orbiculare可以用来防治澳大利亚牧羊区和灌溉作物中的杂草刺苍耳[8]。禾谷炭疽菌C.graminicola菌株KA001可用来防除水稻田里的稗属杂草[9]。盘长孢状刺盘孢锦葵专化型C.gloeosporioides f.sp.malvae的商品除草剂“Bio Mal”主要用于防治圆叶锦葵[10]。猪毛菜炭疽菌C.gloeosporioides f.sp.salsolae可以用来防除北美地区农田中的入侵性杂草猪毛菜或风滚草[11]。此外,平头炭疽菌C.truncatum可以用来防治大果田菁[12]及巴西农田杂草狼把草[13]。胶孢炭疽菌C.gloeosporioides可以防除夏威夷森林中的恶性杂草毛野牡丹藤[14]。蒲黄炭疽菌C.typhae有防治水生杂草香蒲的潜力[15]。虽然已有许多炭疽菌在杂草防除上的报道,但是利用炭疽菌防治牛筋草的报道较少。
为了进一步挖掘适合于湖北省牛筋草的生防菌资源,本研究前期从牛筋草植株上分离出一株强致病力炭疽菌菌株,通过形态学及分子生物学对该病原菌进行分类鉴定,并通过对病原菌的生物学特性、生防效果和作物安全性的评估,明确该菌的生物学特性,以期为研究牛筋草生物除草剂提供理论依据。
1 材料与方法
1.1 材料
供试植株:牛筋草、稗、马唐、大巢菜等杂草种子均为本实验室采集并保存,反枝苋种子由南宁海关技术中心桂林分中心实验室提供。玉米、小麦、水稻品种分别为鄂玉24、郑麦9023及晚籼98。菌株NJC-16分离于湖北省武汉市江夏区金水农场玉米田自然发病的牛筋草植株。
培养基:马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基、马铃薯蔗糖琼脂(Potato sucrose agar,PSA)培养基、燕麦琼脂(Oatmeal agar medium,OA)培养基、燕麦番茄琼脂(Oatmeal tomato agar medium,OTA)培养基、胡萝卜琼脂(Carrot agar medium,CA)培养基、绿豆汁(Mung bean agar medium,MBA)培养基、查氏(Czapek)培养基等基本配方参考方中达[16]的方法。
试剂及仪器:Green Taq Mix,南京诺唯赞生物科技公司;其他试剂均为国产分析纯。Eppendorf Centrifuge 5810R,德国Eppendorf公司;Olympus IX81显微镜,日本Olympus公司;东胜ETC811 PCR扩增仪,北京东胜创新生物科技有限公司。
1.2 方法
1.2.1 病原菌的分离及致病性测定 采用常规组织分离法分离病原菌,用清水洗净病叶并剪取4 mm×4 mm的病健交界处组织,用75%乙醇处理30 s,0.1%升汞消毒1~2 min,无菌水冲洗3遍,接种在PDA培养基上,25 ℃下培养5 d,将获得的菌株通过单孢纯化后保存在PDA斜面及滤纸片上,分别置于4 ℃及-20 ℃冰箱保存备用。
致病性测定采用菌丝块离体接种及分生孢子液活体接种进行。菌丝块接种:从三叶期健康牛筋草植株上选取大小一致的无病害叶片20片,70%酒精1 min进行表面消毒,打取直径为5 mm的菌丝块,接种至牛筋草健康叶片上;以接种PDA培养基作为对照,置于30 cm×50 cm的瓷盘内25 ℃保湿培养,接种2 d后移去菌丝块,观察发病情况。
分生孢子悬浮液活体接种:收集牛筋草炭疽菌的分生孢子,将分生孢子配成浓度为1×106孢子/mL的分生孢子悬浮液。牛筋草植株种于10 cm的花盆中,每盆10~15株,将配制好的分生孢子悬浮液以10 mL/盆的接种量(含0.05%的吐温80)均匀喷洒到3叶期的健康牛筋草植株上,以含0.05%的吐温80的无菌水作对照,25 ℃、黑暗保湿培养2 d后,16 h/8 h光/暗培养,观察发病情况。根据柯赫氏法则,对发病叶片进行再分离、培养,在显微镜下观察分离得到的菌株是否为原接种菌株。
1.2.2 病原菌鉴定 病原菌形态学鉴定:将病原菌接种到 PDA、PSA平板上,25 ℃光照培养,观察菌落形态、颜色、分生孢子及附着胞的特征等,参照《真菌鉴定手册》[17]及Crouch等[18]的方法,对病原菌进行形态学的鉴定。
病原菌的分子鉴定:采用CTAB法提取病原菌株的基因组DNA。采用通用引物ITS1(5'-TCCGTAGGTG AACCTGCGG-3')/ITS4(5'-TCCTCCGCTTATTGATATGC-3')扩增该病原菌的目的基因序列,引物均由武汉擎科生物技术有限公司合成。PCR反应体系:PCR反应体系总体积为25 μL,反应液组分为:Green Taq Mix 12.5 μL(诺唯赞生物科技公司,南京),模板DNA 1 μL,引物ITS1和ITS4(25 μmol/L)各1 μL,加ddH2O使总体积达到25 μL,在东胜ETC811 PCR扩增仪上进行扩增。
扩增产物的测序委托武汉擎科生物技术有限公司进行,所得到的核苷酸序列与 GenBank(http://blast.ncbi.nlm.nih.gov/Blast.cgi)中序列进行BLAST比对分析,使用MEGA 7.0软件将供试菌株的ITS序列与BLAST上同源性高的菌株序列进行比对,采用邻近法(neighbor-joining,NJ)进行聚类分析,构建系统发育树。
1.2.3 菌株NJC-16的生物学特性测定 不同培养基对病原菌生长的影响:将直径为6 mm的菌丝块,分别接至PDA、PSA、OTA、OMA、CA、MBA平板的中央,在25 ℃条件下培养,7 d后观察菌丝生长情况,并采用十字交叉法测量菌落直径,并用5 mL的ddH2O洗平板,四层擦镜纸过滤,对分生孢子进行计数,每个处理5个重复。
温度对病原菌生长的影响:将直径为6 mm的菌丝块,接至PDA平板中央,分别在5 ℃、10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、35 ℃的恒温条件下培养,观察菌丝生长情况,5 d后采用十字交叉法测量菌落直径,每处理5次重复。
光照对病原菌生长的影响:将直径为6 mm的病原菌菌丝块接至PDA平板中央,将平板分别置于连续光照、12 h光暗交替、连续黑暗的人工气候培养箱,25 ℃恒温培养,5 d后用十字交叉法测量菌落直径,每处理5个重复。
pH对病原菌生长的影响:打取直径为6 mm的菌丝块,接至PDA平板中央, pH分别设为4、5、6、7、8、9和10,25 ℃恒温条件下培养,观察菌丝生长情况,5 d后采用十字交叉法测量菌落直径,每处理5个重复。
碳、氮源对病原菌生长的影响:以查氏(Czapek)培养基为基础培养基,用等质量碳元素的葡萄糖、可溶性淀粉、甘露醇、半乳糖、山梨醇、麦芽糖、柠檬酸钠、果糖、乳糖替代蔗糖,以不加碳源的查氏培养液作为对照;用等质量氮元素的酵母浸粉、蛋白胨、甘氨酸、硝酸铵、氯化铵、硝酸钠代替 KNO3,以不加氮源的查氏培养液作为对照。打取直径为6 mm的菌丝块接至含不同碳(氮)源的PDA平板上,25 ℃条件下培养7 d,十字交叉法测量菌落直径,每处理5个重复。
病原菌菌丝致死温度的测定:将直径为6 mm的病原菌菌丝块接至无菌试管中,加入2 mL灭菌水,置于35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃的水浴中加热10 min,每个处理5个重复,然后接种于PDA平板中央,25 ℃光照培养,5 d后用十字交叉法测量菌落直径,10 d后观察菌落最终生长情况。
1.2.4 菌株NJC-16对不同杂草的防效 将菌株NJC-16接种于PSB培养基,25 ℃、220 r/min培养7 d,收集分生孢子并配制成浓度为1×106孢子/mL的分生孢子悬浮液(含0.05%的吐温80)。每盆喷施10 mL分生孢子悬浮液于3叶期稗草、马唐和反枝苋等杂草植株上,25 ℃、黑暗保湿培养2 d后,16 h/8 h光/暗培养。以喷施0.05%的吐温80的植株为对照,21 d后观察植株的发病情况,统计发病率、致死率,并收集杂草地上部分,统计鲜重抑制率。每处理3个重复。
1.2.5 作物安全性测定 将浓度为1×106孢子/mL的分生孢子悬浮液(含0.05%的吐温80)喷施2~3叶期玉米、小麦和水稻植株,接种量及培养方法同1.2.4。接种7 d后,观察供试玉米、小麦和水稻的发病情况。21 d后收集作物地上部分,统计鲜重抑制率,鲜重抑制率(%)=(对照平均鲜重-处理平均鲜重)/对照平均鲜重×100。
1.3 数据统计与分析
试验数据采用DPS 15.10软件和Excel进行统计分析,用最小显著差数(LSD)法进行差异显著性检验。
2 结果与分析
2.1 牛筋草病原菌的分离及致病性
采用常规组织分离法对采集的病叶进行病原菌的分离。从分离的不同真菌中选择代表性菌株进行致病性测定结果表明,只有接种代表菌株NJC-16时,牛筋草的叶片产生黑褐色轮纹状病斑。
离体接种牛筋草叶片在25 ℃下保湿培养24 h后,叶片病斑初为水渍状,随发病时间延长逐渐扩展为黑褐色轮纹状。活体接种分生孢子悬浮液的牛筋草植株在喷雾接种3 d后产生水渍状病斑,后逐渐扩大并形成黑褐色轮纹状病斑。2种接种方法产生的症状均与田间自然发病症状一致,从发病叶片上重新分离到的病原菌与原接种菌株培养性状和形态特征一致,进一步确认菌株NJC-16为牛筋草的致病菌。

图1 牛筋草炭疽菌田间发病症状及室内接种症状Fig.1 Symptoms of anthracnose disease of goosegrass
2.2 菌株NJC-16的鉴定
对牛筋草病原菌菌株NJC-16进行了形态学上的鉴定,菌株NJC-16在PDA培养基上菌落呈圆形,边缘规则,绒状,25 ℃培养条件下7 d菌落直径为5.9 cm,菌落初期白色,后期为黑色(图2A);在PSA培养基上菌落圆形,边缘规则,呈绒状,25 ℃培养条件下7 d菌落直径为6.1 cm,菌落初期白色,后期为黑色,气生菌丝较多(图2B),菌丝有隔,透明,0.6~5.0 μm,有脂滴。
分生孢子无色,单孢,长椭圆状或镰刀状,大小为(2.8~4.6)μm×(7.3~11.8)μm,分生孢子内含脂滴(图 2C)。附着胞圆形或长圆形,卵球形或倒卵球形或棒状,边缘光滑,少有叶瓣状附着胞,大小为(4.3~6.0)μm×(6.7~11.6) μm(图2D),初步通过形态学鉴定菌株NJC-16为子囊菌亚门腔孢纲黑盘孢目禾生炭疽菌复合种C.graminicola complex下的牛筋草炭疽菌C.eleusines。
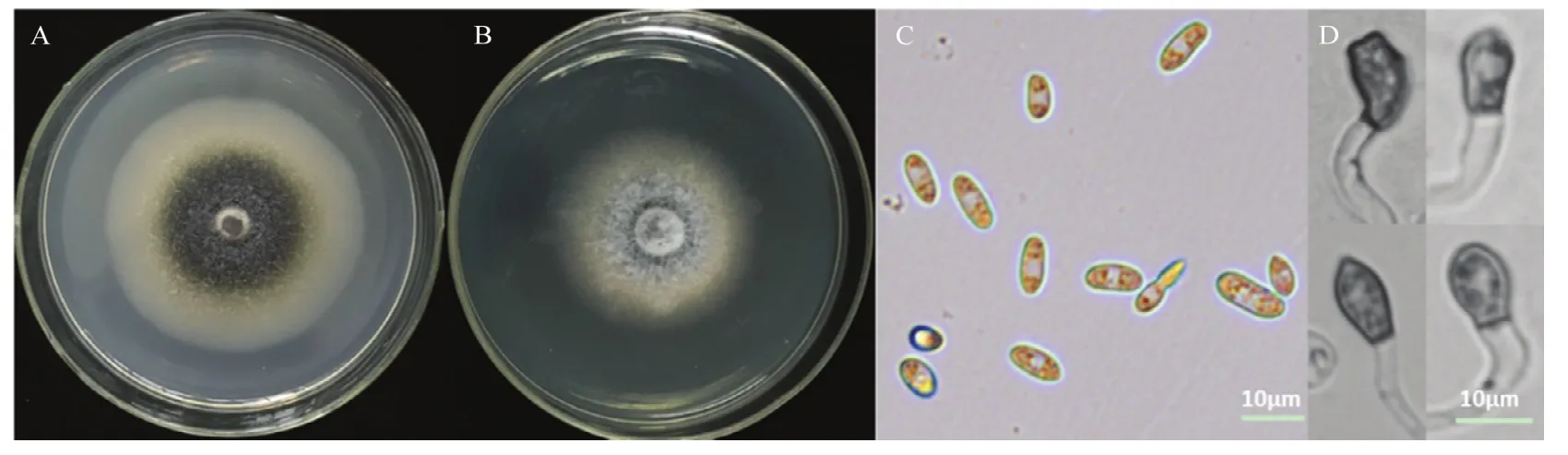
图2 生防菌NJC-16的形态特征Fig.2 Symptoms of NJC-16
分子鉴定采用通用引物ITS1/ITS4进行PCR扩增,得到554 bp大小的片段,将此片段在GenBank中进行 BLAST比对,发现该菌株与牛筋草炭疽菌(MAFF 511155)的同源性最高,为99.62%。通过构建系统发育树发现,菌株NJC-16序列与牛筋草炭疽菌遗传距离最近,聚在一起(图 3),结合形态学特征及分子鉴定结果,将菌株NJC-16鉴定为牛筋草炭疽菌。
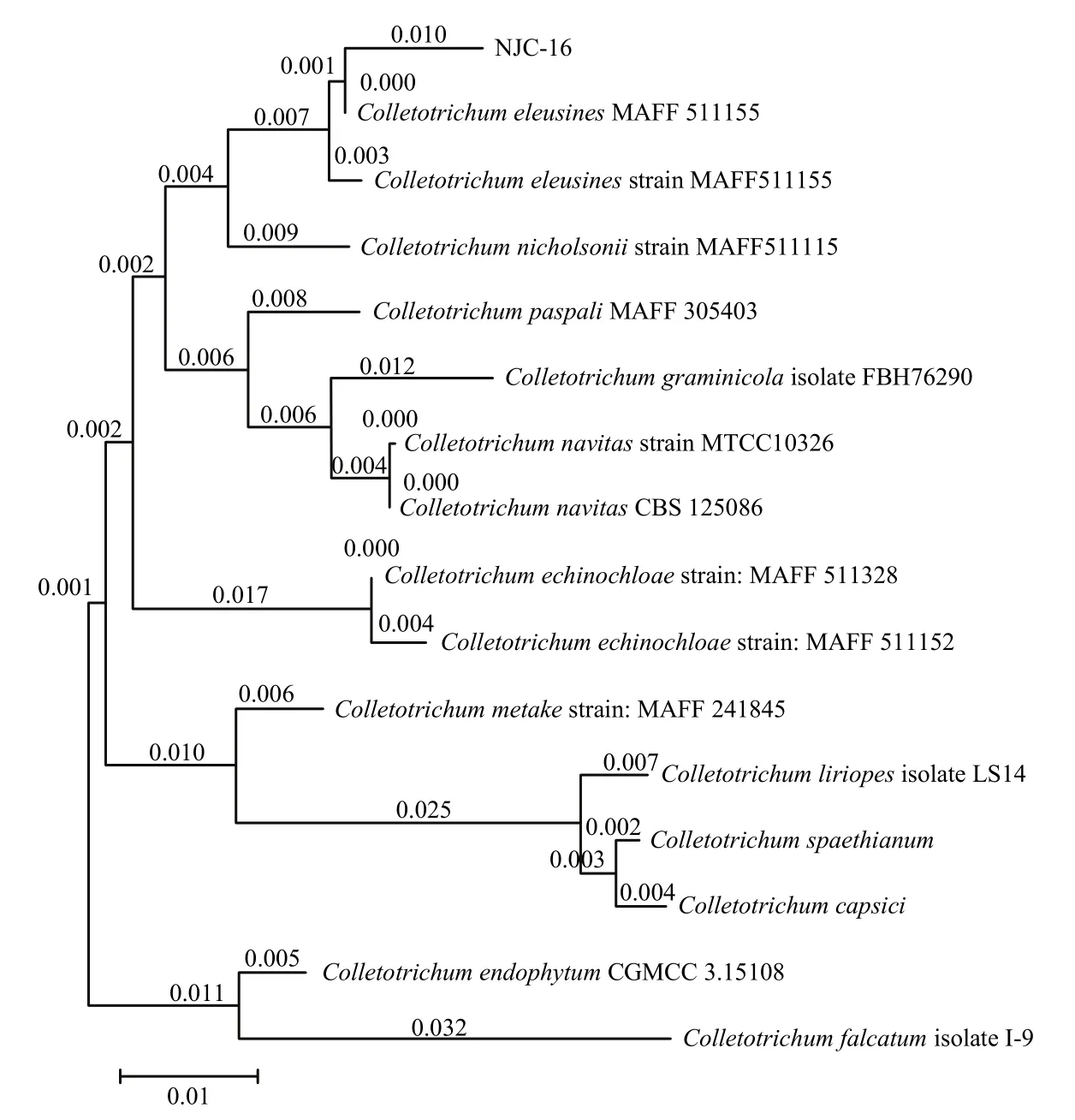
图3 基于ITS序列采用NJ法构建菌株NJC-16及其相关菌株的系统发育树Fig.3 Phylogenetic tree of strain NJC-16 and related strains based on ITS sequences by the NJ method
2.3 菌株NJC-16的生物学特性
2.3.1 菌株NJC-16在不同培养基上的生长 将菌株NJC-16分别在PDA、PSA、OTA、OMA、CA及MBA培养基上25 ℃黑暗培养,在OMA、PSA、PDA培养基上长势最好,生长速度较快,培养7 d后菌落直径分别为6.2、6.1和5.9 cm;但在不同培养基上产孢有明显差别,在OTA、MBA、PSA上产孢情况较好,产孢量分别为75×105、43×105和33×105孢子/皿,在CA、PDA、OMA固体培养基上产孢较差(表1)。

表1 菌株NJC-16在不同培养基上的生长速率及产孢量Table 1 The growth rate and the sporulation of strain NJC-16 on different culture media
2.3.2 温度、光照及pH对菌株NJC-16的生长影响 不同温度对供试菌株菌丝生长的影响差异显著。菌株NJC-16在20 ℃~30 ℃生长较好,其中25 ℃最适合菌丝生长,生长5 d后的菌落直径达到45.0 mm;在5 ℃以下及35 ℃以上时,菌株NJC-16菌丝不生长(图4)。
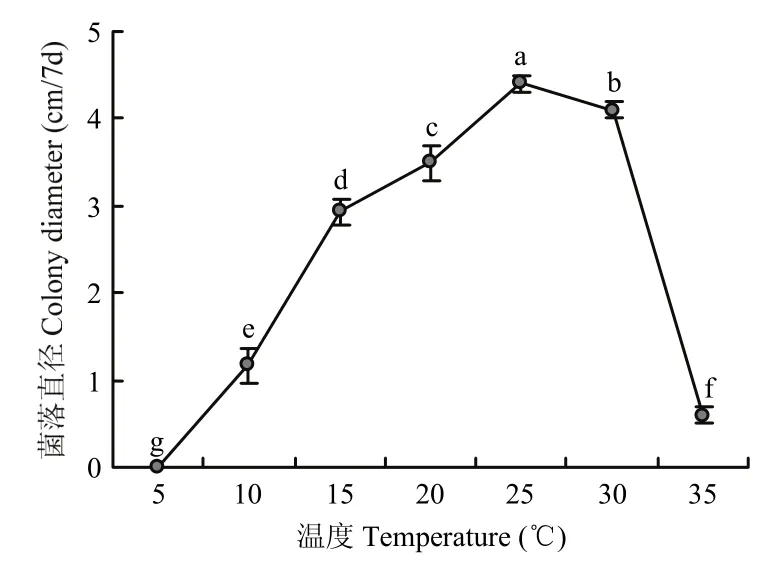
图4 不同温度对牛筋草炭疽菌菌丝生长的影响Fig.4 Effects of temperature on mycelial growth of the pathogen C.eleusines
不同光照条件对病原菌菌丝的生长影响不显著。在连续光照、连续黑暗、12 h光暗交替条件下培养5 d,菌落平均直径分别为55.3、54.6、54.6 mm(图5),无明显差异。
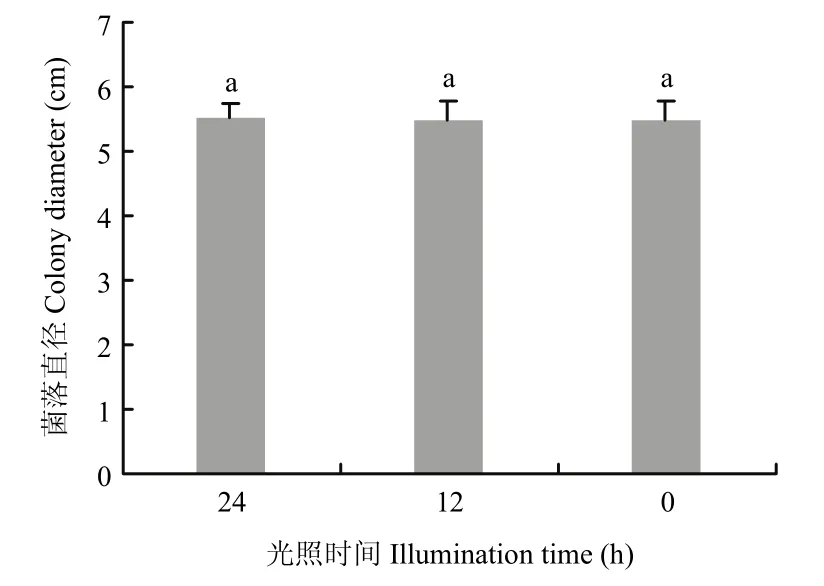
图5 不同光照条件对牛筋草炭疽菌菌丝生长的影响Fig.5 Effects of illumination on mycelial growth of the pathogen C.eleusines B
不同pH对供试菌株菌丝生长的影响差异显著。菌株NJC-16在pH为4~10的培养基上均能生长,菌落直径表现为先增加后减少,在pH为6~9时生长最好,当pH<5和pH>10时生长速率开始受到抑制(图6)。
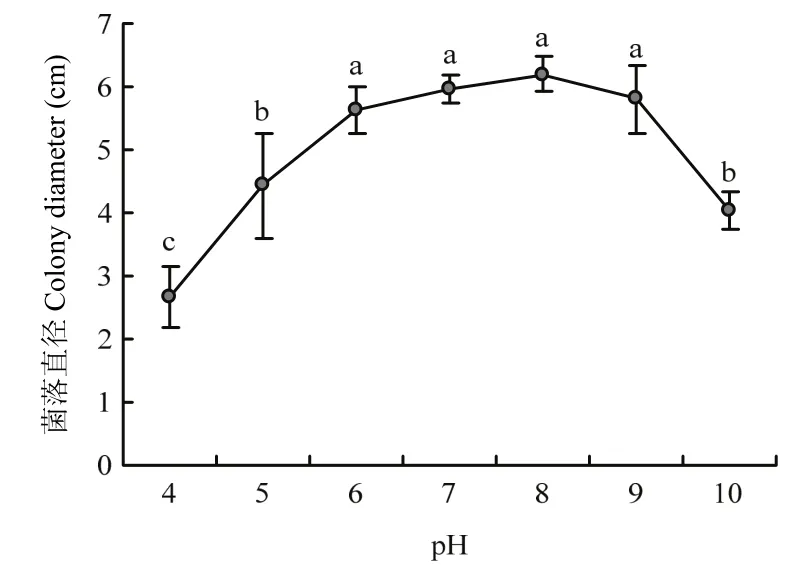
图6 不同pH对牛筋草炭疽菌菌丝生长的影响Fig.6 Effects of pH on mycelial growth of the pathogen C.eleusines C
2.3.3 碳源和氮源对菌株NJC-16生长的影响 菌株NJC-16在10种不同碳源和7种不同氮源的培养基质条件下都能够生长,但对不同碳、氮源的利用程度不同。在不同碳源中,菌株 NJC-16对淀粉的利用效率最高,培养5 d后菌落直径为8.35 cm,其次是葡萄糖和麦芽糖,而对柠檬酸钠利用效果最差。在不同氮源中,菌株 NJC-16对酵母浸提液的利用效率最高,培养5 d后的菌落直径为8.50 cm,其次为甘氨酸和蛋白胨,对氯化铵利用效果最差,生长缓慢(表2)。
2.3.4 病原菌的致死温度 用不同温度的水浴处理供试菌株的菌丝块结果表明,菌丝块在35 ℃~60 ℃水浴处理10 min后,置于PDA平板上培养,5 d后均可长出菌丝,而经65 ℃、70 ℃处理下,培养10 d后仍未观察到菌丝生长,由此初步判断病原菌菌丝的致死温度为65 ℃、10 min。
2.4 菌株NJC-16对不同杂草防效分析
将菌株NJC-16的分生孢子液分别接种于三叶期的牛筋草、稗草、马唐、千金子、大巢菜、反枝苋等杂草植株。室内生防试验结果表明,菌株NJC-16分生孢子悬浮液对牛筋草生防效果最佳,接菌21 d后牛筋草发病率为83.2%,致死率达89.7%,鲜重抑制率达73.2%;对马唐、千金子和反枝苋的生防效果较差,鲜重抑制率仅为5.8%、5.2%、9.4%;稗草虽然发病,但是却不致死;接种大巢菜21 d后在大巢菜叶片上可见菌落,但致死率以及鲜重抑制率均不高(表3)。
2.5 作物安全性分析
将菌株NJC-16分生孢子液分别接种3叶期的玉米、小麦及水稻植株,室内作物安全性试验结果表明,在喷雾菌株NJC-16分生孢子液7 d后,玉米(鄂玉24)、小麦(郑麦9023)和水稻(晚籼98)叶片均没有明显病斑;21 d后,玉米、小麦和水稻等作物鲜重没有明显的抑制,表现为安全(表4)。

表4 菌株NJC-16孢子液对不同作物的安全性比较Table 4 Comparison of the effect of NJC-16 strain spores on the safety of different crops
3 讨论
现代农业以极高的规模为人类提供高质量的农产品,这在一定程度上是通过合理使用农药来实现的,农药保护作物不受病虫害的侵害、减少杂草的竞争,从而有助于保持作物的高产。然而,近年来因长期大量使用化学除草剂造成的环境污染和杂草抗药性问题日益严峻,急需开发新的杂草管理方法[19]。随着人们对植物病原菌研究的不断深入,微生物除草剂的开发研究获得了良好进展。从自然发病的杂草病株中筛选出来的植物病原菌具有较强的除草活性,因此有开发成为微生物除草剂的潜力。微生物除草剂具有对目标杂草选择性高、环境负效应小、对作物安全性高等优点,亦可以满足全球对有机农产品长期增长的需求[20]。
评价生物防治的潜力指标涉及菌株生物学特性、毒力水平等方面[21]。据报道,牛筋草炭疽菌在 PDA培养基上菌落生长和产孢均较好,在多种真菌培养基上均能生长,表明该菌对营养要求比较低[22]。在本研究中,牛筋草炭疽菌菌株NJC-16在PDA、PSA、OTA、MB等培养基上均能生长,在PSA上生长产孢较好,在以淀粉和酵母浸提液为碳、氮源的培养基上生长较好,这为低成本大规模人工培养提供了依据。另外,牛筋草炭疽菌对温度适应性较广,温度对炭疽菌产孢、孢子的萌发及后续的侵染起着重要的作用。在不同的炭疽菌中,不同孢子的生长最适温度也不近相同[23],香蕉炭疽病菌C.musae生长最适温度为27 ℃~30 ℃[24],马铃薯炭疽病C.coccodes 生长最适温度在20 ℃~30 ℃[25]。在本研究中,菌株NJC-16最适生长温度和最适产孢温度均为25 ℃~30 ℃,该菌的生长适合湖北省牛筋草生长期高温、高湿的气候。并且该菌对pH和光照条件均不敏感,在不同的pH及光照条件下产孢无明显差异。综上,在生物学特性上该菌株非常利于其在生物防治上的应用,是一种很有应用前景的植物病原真菌。
此外,获得的牛筋草炭疽菌菌株 NJC-16能引起牛筋草发病,对牛筋草具有良好的防效。前人研究报道,在牛筋草上分离出几种病原真菌,主要有牛筋草平脐蠕孢、狗尾草平脐蠕孢、香茅弯孢、长喙凸脐胞、灰梨孢等[26]。这些分离出的病原真菌不仅对牛筋草有致病性,对其他禾本科的杂草也有相应的致病性。对菌株NJC-16初步的寄主范围测定表明对其他杂草如稗草、马唐、反枝苋、大巢菜等杂草的防效一般,说明菌株 NJC-16对牛筋草有较好的寄主专一性。初步的生物安全试验表明,该菌株不侵染玉米、小麦和水稻等大田作物,接种后不产生典型的水渍状病斑,对以上作物的生物安全性较高。菌株NJC-16对牛筋草具有良好防效,同时对其他常见作物安全,因此有开发为牛筋草生防菌的潜力。
获得一个有潜力开发为生物除草剂的生防菌株是开发生物除草剂的前提和基础,但离成功开发一个商用的生物除草剂仍有许多工作要做。如牛筋草炭疽菌菌株NJC-16,需要进一步扩大寄主测定范围,尤其对其在田间的使用进行安全评估。在后续工作中,还可以对该菌株进行基因改良,提高其产孢量及致病性。同时可对其发酵液中的活性物质进行提取及鉴定,从该菌株中的天然产物入手,通过生物信息学等方法,有针对性地发现除草活性物质,鉴定其结构,以开发新的生物农药。

